Pierwiastek chemiczny kobalt jest klasyfikowany jako metal przejściowy. Został odkryty w 1735 roku przez Georga Brandta.

Strefa danych
| Klasyfikacja: | Kobalt jest metalem przejściowym |
| Kolor: | biało-niebieski |
| Masa atomowa: | 58.9332 |
| Stan: | stały |
| Temperatura topnienia: | 1495 oC, 1768 K |
| Temperatura wrzenia: | 2930 oC, 3203 K |
| Elektrony: | 27 |
| Protony: | 27 |
| Neutrony w najobficiej występującym izotopie: | 32 |
| Powłoki elektronowe: | 2,8,15,2 |
| Konfiguracja elektronowa: | 3d7 4s2 |
| Gęstość @ 20oC: | 8.90 g/cm3 |
Pokaż więcej: Ciepła, Energie, Utlenianie, Reakcje,
Związki, Promienie, Przewodności
| Objętość atomowa: | 6.7 cm3/mol |
| Struktura: | hcp: heksagonalny zwarty pkd |
| Twardość: | 5,0 mohs |
| Ciepło właściwe | 0.42 J g-1 K-1 |
| Ciepło topnienia | 16,190 kJ mol-1 |
| Ciepło atomizacji | 426 kJ mol-1 |
| Ciepło parowania | 373.3 kJ mol-1 |
| 1. energia jonizacji | 758.4 kJ mol-1 |
| 2. energia jonizacji | 1646 kJ mol-1 |
| 3. energia jonizacji | 3232.2 kJ mol-1 |
| Stosunek do elektronów | 63,8 kJ mol-1 |
| Minimalna liczba utlenienia | -1 |
| Min. wspólna liczba utlenienia. | 0 |
| Maksymalna liczba utlenienia | 5 |
| Max. common oxidation no. | 3 |
| Elektronegatywność (Skala Paulinga) | 1.88 |
| Objętość polaryzacji | 7,5 Å3 |
| Reakcja z powietrzem | łagodna, w/ht ? Co3O4 |
| Reakcja z 15 M HNO3 | żywotna, ? Co(NO3)2, NOx |
| Reakcja z 6 M HCl | łagodna, ? H2, CoCl2 |
| Reakcja z 6 M NaOH | – |
| Tlenek(y) | CoO, Co3O4 |
| Wodorek(s) | Brak |
| Chlorek(s) | CoCl2 |
| Promień atomowy Promień | 135 pm |
| Promień jonowy (jon 1+) | – |
| Promień jonowy (jon 2+) | 83.8 pm |
| Promień jonowy (jon 3+) | 71.8 pm |
| Promień jonowy (1- jon) | – |
| Promień jonowy (2- jon) | – |
| Promień jonowy (3- jon) | – |
| Przewodność cieplna | 100 W m-1 K-1 |
| Przewodność elektryczna | 17.9 x 106 S m-1 |
| Punkt zamarzania/topnienia: | 1495 oC, 1768 K |
Odkrywanie kobaltu
Od czasów starożytnych związki kobaltu były używane do produkcji niebieskiego szkła i ceramiki.
Pierwiastek ten został po raz pierwszy wyizolowany przez szwedzkiego chemika Georga Brandta w 1735 roku. Wykazał on, że to obecność pierwiastka kobaltu powoduje niebieski kolor w szkle, a nie bizmut, jak wcześniej sądzono.
W około 1741 roku napisał: „Jak istnieje sześć rodzajów metali, tak i ja wykazałem za pomocą wiarygodnych eksperymentów… że istnieje również sześć rodzajów półmetali: nowy półmetal, mianowicie kobalt regulus oprócz rtęci, bizmutu, cynku i regulus antymonu i arsenu.”
Słowo kobalt pochodzi od niemieckiego „kobold”, co oznacza goblina lub elfa. Poniższy obraz kobaltu jest autorstwa Bena Millsa.


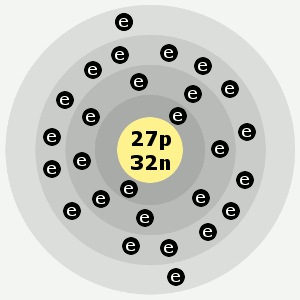
Powłoki elektronowe kobaltu
Wygląd i właściwości
Skutki szkodliwe:
Kobalt i jego związki są uważane za lekko toksyczne w kontakcie ze skórą i umiarkowanie toksyczne po spożyciu.
Charakterystyka:
Kobalt jest niebiesko-białym, błyszczącym, twardym, kruchym metalem. Jest ferromagnetyczny.
Metal ten jest aktywny chemicznie, tworząc wiele związków. Kobalt pozostaje magnetyczny do najwyższej temperatury spośród wszystkich pierwiastków magnetycznych (jego punkt Curie wynosi 1121oC).
Zastosowanie kobaltu
Kobalt jest stosowany w stopach na części silników lotniczych oraz w stopach odpornych na korozję/zużycie.
Kobalt jest szeroko stosowany w akumulatorach i w galwanotechnice.
Sole kobaltu są używane do nadawania niebieskich i zielonych kolorów w szkle i ceramice.
Radioaktywny 60Co jest używany w leczeniu raka.
Kobalt jest niezbędny dla wielu żywych istot i jest składnikiem witaminy B12.
Kobalt jest również używany w samarowo-kobaltowych magnesach stałych. Są one stosowane w przetwornikach gitarowych i silnikach wysokoobrotowych.
Abundance and Isotopes
Abundance earth’s crust: 25 parts per million by weight, 8 parts per million by moles
Abundance solar system: 4 części na milion wagowo, 0,7 części na milion molowo
Koszt, czysty: 21$ za 100g
Koszt, luzem: 4,40$ za 100g
Źródło: Kobalt nie występuje w przyrodzie jako wolny pierwiastek. Znajduje się on w rudach mineralnych. Główne rudy kobaltu to kobaltyt (CoAsS), erytryt (uwodniony arsenian kobaltu), glaukodot (Co,Fe)AsS, i skutterudyt (Co,Ni)As3. Kobalt jest generalnie produkowany jako produkt uboczny górnictwa niklu i miedzi.
Isotopy: Kobalt ma 22 izotopy, których okresy półtrwania są znane, o liczbach masowych od 50 do 72. Naturalnie występujący kobalt składa się z jego jednego stabilnego izotopu, 59Co.

- Edward Smedley, Hugh James Rose, Henry John Rose, Encyclopaedia Metropolitana; or Universal Dictionary of Knowledge…, 1845, Volume 4, p693 William Clowes and Sons.
Cite this Page
Cite this Page
Dla linkowania online, proszę skopiować i wkleić jeden z poniższych:
<a href="https://www.chemicool.com/elements/cobalt.html">Cobalt</a>
lub
<a href="https://www.chemicool.com/elements/cobalt.html">Cobalt Element Facts</a>
Aby zacytować tę stronę w dokumencie akademickim, proszę użyć następującego cytatu zgodnego z MLA:
"Cobalt." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/cobalt.html>.
.