Sole żółciowe i kwasy żółciowe są polarnymi pochodnymi cholesterolu, i stanowią główną drogę eliminacji steroidu z organizmu.
Są to cząsteczki o podobnej, ale nie identycznej strukturze i różnych właściwościach fizycznych i biologicznych.Ponieważ w fizjologicznym pH cząsteczki te są obecne jako aniony, terminy kwas żółciowy i sole żółciowe są stosowane w niniejszym dokumencie jako synonimy.
Składniki
- Struktura chemiczna soli żółciowych
- Pierwotne, sprzężone i drugorzędowe sole żółciowe
- Funkcja kwasów żółciowych
- Wewnątrzwątrobowe krążenie soli żółciowych
- Metabolizm jelitowy kwasów żółciowych
- Włókna rozpuszczalne i reabsorpcja soli żółciowych
- Synteza pierwotnych kwasów żółciowych
- Scieżka klasyczna lub obojętna
- Scieżka alternatywna lub kwaśna
- Mniejsze ścieżki
- Sole żółciowe: regulacja syntezy
- Struktura chemiczna soli żółciowych
- Pierwotne, sprzężone i wtórne sole żółciowe
- Funkcja kwasów żółciowych
- Wewnątrzwątrobowe krążenie soli żółciowych
- Wewnętrzny metabolizm kwasów żółciowych
- Rozpuszczalne włókna i reabsorpcji soli żółciowych
- Synteza podstawowych kwasów żółciowych
- Scieżka klasyczna lub neutralna
- Scieżka alternatywna lub kwaśna
- Pomniejsze szlaki
- Sole żółciowe: regulacja syntezy
Struktura chemiczna soli żółciowych
Sole żółciowe mają podobieństwa i różnice z cząsteczką cholesterolu.
Podobnie jak steroidy, mają jądro złożone z czterech stopionych pierścieni: trzech pierścieni cykloheksanowych, oznaczonych jako A, B i C, oraz pierścienia cyklopentanowego, oznaczonego jako D. Struktura ta to perhydrocyklopentanofenantren, bardziej znany jako jądro steroidowe.
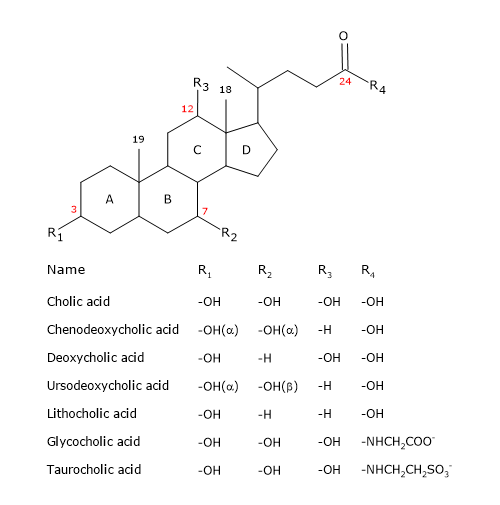
W wyższych kręgowcach mają 24 atomy węgla, gdyż łańcuch boczny jest o trzy karbony krótszy od pierwotnego. U niższych kręgowców kwasy żółciowe mają 25, 26, lub 27 atomów węgla. Łańcuch boczny kończy się grupą karboksylową, zjonizowaną w pH 7, która może być połączona z aminokwasem glicyną lub tauryną (patrz poniżej).
Oprócz grupy hydroksylowej w pozycji 3, mają grupy hydroksylowe w pozycjach 7 i/lub 12.
Wszystko to czyni je znacznie bardziej polarnymi niż cholesterol.
Ponieważ pierścienie A i B są stopione w konfiguracji cis, struktura planarna jądra steroidu jest zakrzywiona, i możliwe jest zidentyfikowanie:
- wklęsłej strony, która jest hydrofilowa, ponieważ grupy hydroksylowe i grupa karboksylowa łańcucha bocznego, z lub bez połączonego aminokwasu, są zorientowane w jej kierunku;
- wypukłej strony, która jest hydrofobowa, ponieważ grupy metylowe obecne w pozycji 18 i 19 są zorientowane w jej kierunku.
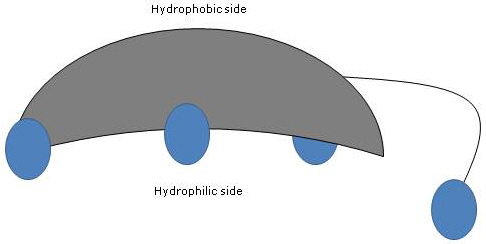
W związku z tym, posiadając zarówno grupy polarne, jak i niepolarne, są cząsteczkami amfifilowymi i doskonałymi surfaktantami. Jednak ich budowa chemiczna odróżnia je od wielu innych surfaktantów, często składają się z polarnego regionu głowy i niepolarnego ogona.
Pierwotne, sprzężone i wtórne sole żółciowe
Pierwotne kwasy żółciowe to te, które są syntetyzowane bezpośrednio z cholesterolu w hepatocytach. U człowieka najważniejsze z nich to kwas cholowy i kwas chenodeoksycholowy, które stanowią 80% wszystkich kwasów żółciowych. Przed wydzieleniem do dróg żółciowych są one prawie całkowicie sprzęgane, nawet do 98%, z glicyną lub tauryną, tworząc odpowiednio glikokoniugaty i taurokoniugaty. W szczególności, około 75% kwasu cholowego i kwasu chenodeoksycholowego jest sprzężone z glicyną, tworząc kwas glikocholowy i kwas glikofenodeoksycholowy, a pozostałe 25% z tauryną, tworząc kwas taurocholowy i kwas taurochenodeoksycholowy.
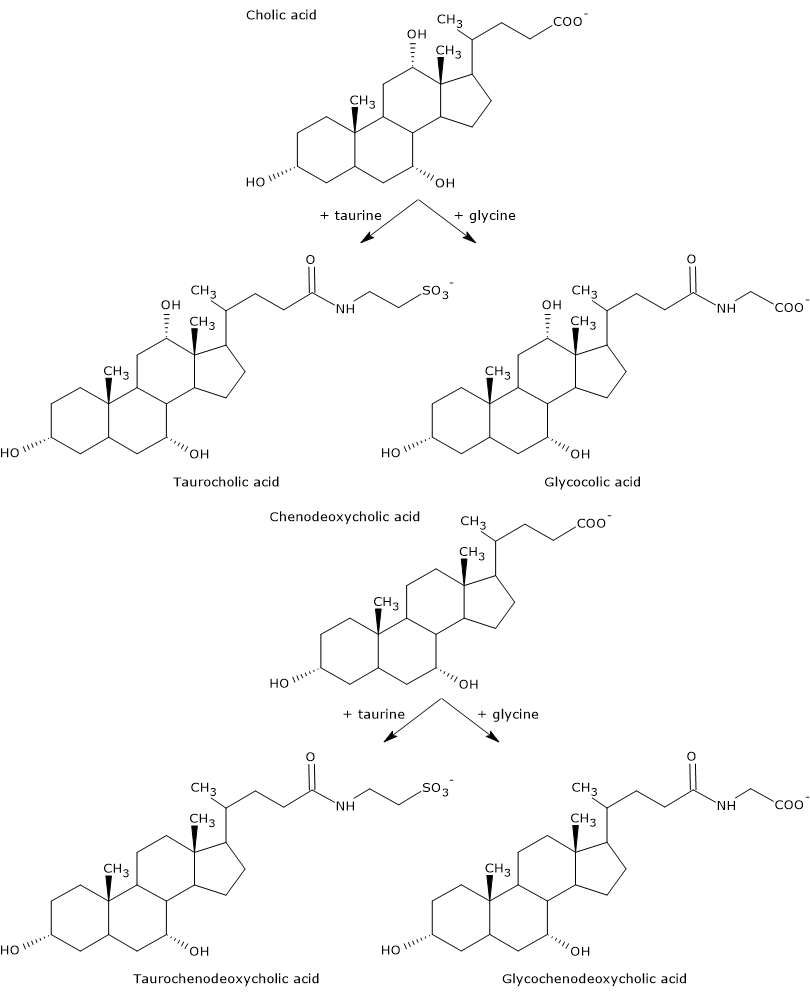
Skoniugowane kwasy żółciowe to cząsteczki o większej ilości grup hydrofilowych niż niesprzężone kwasy żółciowe, a więc o zwiększonej zdolności emulgującej. W rzeczywistości koniugacja obniża pKa kwasów żółciowych, z około 6, wartości typowej dla niesprzężonych cząsteczek, do około 4 dla kwasu glikocholowego i około 2 dla kwasu taurocholowego. Sprawia to, że sprzężone kwasy żółciowe są jonizowane w szerszym zakresie pH tworząc odpowiednie sole.
Hydrofilowość wspólnego kwasu i soli żółciowych zmniejsza się w następującej kolejności: sprzężony z glicyną < sprzężony z tauryną < kwas litocholowy < kwas deoksycholowy < kwas chenodeoksycholowy < kwas cholowy < kwasursodeoksycholowy.
Wreszcie, koniugacja zmniejsza również cytotoksyczność pierwotnych kwasów żółciowych.
Drugorzędowe kwasy żółciowe powstają z pierwotnych kwasów żółciowych, które nie zostały ponownie wchłonięte z jelita cienkiego. Po dotarciu do jelita grubego, mogą być poddane kilku modyfikacjom przez mikrobiotę jelitową, tworząc wtórne kwasy żółciowe (patrz poniżej). Stanowią one pozostałe 20% puli kwasów żółciowych w organizmie.
Inny sposób kategoryzacji soli żółciowych opiera się na ich koniugacji z glicyną i tauryną oraz stopniu hydroksylacji. Na tej podstawie wyróżnia się trzy kategorie.
- Trójhydroksykoniugaty, takie jak kwas taurocholowy i kwas glikocholowy.
- Dihydroksykoniugaty, takie jak kwas glikodezoksycholowy, kwas glikofenodezoksycholowy, kwas taurochenodezoksycholowy i kwas taurodeoksycholowy. Stanowią one około 60% soli żółciowych obecnych w żółci.
- Nieskoniugowane formy, takie jak kwas cholowy, kwas deoksycholowy, kwas chenodeoksycholowy i kwas litocholowy.
Funkcja kwasów żółciowych
Wszystkie ich funkcje fizjologiczne są wykonywane w postaci sprzężonej.
- Są one główną drogą eliminacji cholesterolu z organizmu człowieka.
Ludzie nie mają enzymów, aby otworzyć pierścienie cykloheksanowe lub pierścień cyklopentanowy jądra steroidu, ani do utleniania cholesterolu do CO2 i wody.
Inny mechanizm eliminacji steroidu z organizmu jest jako cholesterol per se w żółci. - Sole żółciowe są silnymi środkami powierzchniowo czynnymi. A w szczególności, di- i trihydroksykoniugaty są najlepsze środki powierzchniowo czynne wśród kwasów żółciowych, znacznie bardziej skuteczne niż niesprzężone odpowiedniki, ponieważ mają więcej polarnych groups.
Po zetknięciu się z apolarnych lipidów w świetle jelita cienkiego, wypukła powierzchnia apolarna oddziałuje z apolarnych lipidów, takich jak triglicerydy, estry cholesterolu i estry witamin rozpuszczalnych w tłuszczach, podczas gdy wklęsła powierzchnia polarna oddziałuje z otaczającym medium wodnym. Zwiększa to dyspersję apolarnych lipidów w środowisku wodnym, ponieważ umożliwia tworzenie się drobnych kropel lipidowych, zwiększając powierzchnię dla:
aktywności lipaz, głównie lipazy trzustkowej, (sole żółci odgrywają również bezpośrednią rolę w aktywacji tego enzymu);
aktywności esterazy jelitowej.
W konsekwencji ułatwiają wchłanianie produktów trawienia lipidów, a także witamin rozpuszczalnych w tłuszczach przez błonę śluzową jelit dzięki tworzeniu mieszanych miceli.
Kwasy żółciowe pełnią podobną funkcję w pęcherzyku żółciowym, gdzie tworząc mieszane micele z fosfolipidami, zapobiegają wytrącaniu się cholesterolu.
Uwaga: W wyniku ułożenia grup polarnych i niepolarnych, kwasy żółciowe tworzą w roztworze wodnym micele, składające się zwykle z mniej niż 10 monomerów, o ile ich stężenie jest powyżej tzw. krytycznego stężenia micelarnego lub CMC.
- Na poziomie jelitowym modulują wydzielanie enzymów trzustkowych i cholecystokininy.
- W jelicie cienkim i grubym wykazują silną aktywność przeciwbakteryjną, głównie kwas deoksycholowy, w szczególności wobec bakterii Gram-dodatnich. Aktywność ta może być spowodowana oksydacyjnym uszkodzeniem DNA, i/lub uszkodzeniem błony komórkowej. Dlatego odgrywają one ważną rolę w zapobieganiu przerostowi bakterii, ale także w regulacji składu mikrobioty jelitowej.
- W ciągu ostatnich kilku lat, staje się oczywiste ich rola regulacyjna w kontroli metabolizmu energetycznego, a w szczególności dla wątrobowej obsługi glukozy.
Wewnątrzwątrobowe krążenie soli żółciowych
Po spożyciu tłuszczu komórki enteroendokrynne dwunastnicy wydzielają cholecystokininę do krwiobiegu. Hormon wiążąc się z receptorami na komórkach mięśni gładkich pęcherzyka żółciowego pobudza ich skurcz, powoduje również rozkurcz zwieracza Oddiego. Wszystko to powoduje wydzielanie żółci, a więc i kwasów żółciowych do dwunastnicy.
W warunkach fizjologicznych pula soli żółciowych u człowieka jest stała i wynosi około 3-5 g. Jest to możliwe dzięki dwóm procesom:
- ich jelitowej reabsorpcji;
- ich syntezy de novo (patrz niżej).
Do 95% wydzielanych soli żółciowych jest ponownie wchłaniane z jelita, nie razem z produktami trawienia lipidów, ale poprzez proces zwany krążeniem entero-wątrobowym.
Jest to niezwykle wydajny system recyklingu, który wydaje się występować co najmniej dwa razy na każdy posiłek, i obejmuje wątrobę, drzewo żółciowe, jelito cienkie, okrężnicę i krążenie wrotne, przez które wchłonięte cząsteczki wracają do wątroby. Taka recyrkulacja jest konieczna, ponieważ zdolność wątroby do syntezy kwasów żółciowych jest ograniczona i niewystarczająca do zaspokojenia potrzeb jelitowych, gdyby sole żółciowe były wydalane z kałem w dużych ilościach.
Większość soli żółciowych jest reabsorbowana do dystalnego jelita krętego, dolnej części jelita cienkiego, przez sodozależny transporter w granicy szczoteczkowej enterocytów, zwany sodozależnym transporterem kwasów żółciowych lub ASBT, który przeprowadza kotransport cząsteczki kwasu żółciowego i dwóch jonów sodu.
Wewnątrz enterocytu uważa się, że kwasy żółciowe są transportowane przez cytozol do błony podstawnej przez białko wiążące kwasy żółciowe z jelita krętego lub IBABP. Przekraczają błonę podstawną przez organiczny transporter rozpuszczalników alfa-beta lub OSTα/OSTβ, przechodzą do krążenia wrotnego i, związane z albuminami, docierają do wątroby.
Należy zauważyć, że niewielki odsetek kwasów żółciowych dociera do wątroby przez tętnicę wątrobową.
Na poziomie wątrobowym ich ekstrakcja jest bardzo wydajna, z frakcją ekstrakcji pierwszego przejścia wahającą się od 50 do 90%, odsetek ten zależy od struktury kwasu żółciowego. Wchłanianie sprzężonych kwasów żółciowych jest głównie pośredniczone przez system aktywnego transportu zależny od Na+, to jest sodozależny kotransportujący polipeptyd taurocholanu lub NTCP. Jednakże może również wystąpić wychwyt niezależny od sodu, realizowany przez białka z rodziny polipeptydów transportujących aniony organiczne lub OATP, głównie OATP1B1 i OATP1B3.
Krokiem ograniczającym szybkość krążenia jelitowo-wątrobowego jest ich kanalikowe wydzielanie, w którym w dużej mierze pośredniczy pompa eksportu soli żółciowych lub BSEP, w procesie zależnym od ATP. Pompa ta przenosi monoanionowe sole żółci, których jest najwięcej. Kwasy żółciowe sprzężone z kwasem glukuronowym lub siarczanem, które są dianionowe, są transportowane przez różne nośniki, takie jak MRP2 i BCRP.
Uwaga: Stężenie kwasów żółciowych w surowicy zmienia się na podstawie szybkości ich reabsorpcji, a zatem jest wyższe podczas posiłków, kiedy krążenie jelitowo-wątrobowe jest bardziej aktywne.
Wewnętrzny metabolizm kwasów żółciowych
Kwasy żółciowe, które wymykają się wchłanianiu w jelicie krętym, przechodzą do okrężnicy, gdzie częściowo ulegają modyfikacjom przez mikrobiotę jelitową i są przekształcane do wtórnych kwasów żółciowych.
Główne reakcje wymieniono poniżej.
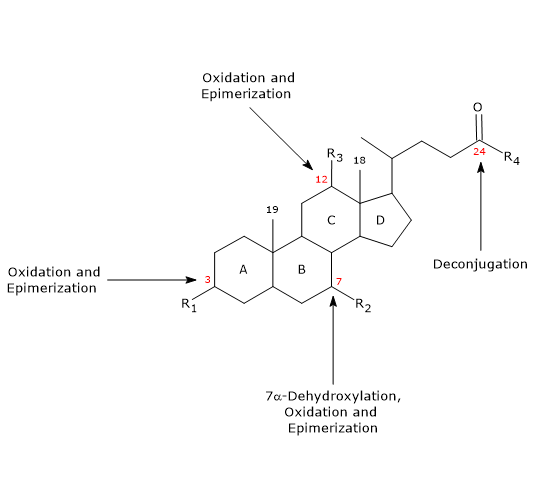
- Dekonjugacja
Na łańcuchu bocznym może zachodzić hydroliza wiązania amidowego C24 N-acylu, z uwolnieniem niesprzężonych kwasów żółciowych i glicyny lub tauryny. Reakcja ta jest katalizowana przez bakteryjne hydrolazy obecne zarówno w jelicie cienkim, jak i w okrężnicy. - 7α-Dehydroksylacja
Jakościowo jest to najważniejsza reakcja, przeprowadzana przez bakteryjne dehydratazę okrężnicy, które usuwają grupę hydroksylową w pozycji 7, tworząc 7-deoksykwasy żółciowe. W szczególności, kwas deoksycholowy powstaje z kwasu cholowego, a kwas litocholowy, toksyczny wtórny kwas żółciowy, z kwasu chenodeoksycholowego.
Należy zauważyć, że 7α-dehydroksylacja, w przeciwieństwie do utleniania i epimeryzacji (patrz poniżej), może zachodzić tylko w niesprzężonych kwasach żółciowych, dlatego dekoniugacja jest niezbędnym warunkiem wstępnym. - Oksydacja i epimeryzacja
Są to reakcje z udziałem grup hydroksylowych w pozycjach 3, 7 i 12, katalizowane przez bakteryjne dehydrogenazy hydroksysteroidowe. Na przykład kwas ursodezoksycholowy pochodzi z epimeryzacji kwasu chenodezoksycholowego.
Niektóre z drugorzędowych kwasów żółciowych są następnie ponownie wchłaniane z okrężnicy i wracają do wątroby. W hepatocytach są one ponownie sprzęgane, jeśli to konieczne, i ponownie wydzielane. Te, które nie są reabsorbowane, są wydalane z kałem.
Gdy utlenianie i dekoniugacja są przeprowadzane przez szerokie spektrum bakterii beztlenowych, 7α-dehydroksylacja jest przeprowadzana przez ograniczoną liczbę beztlenowców okrężnicy.
7α-dehydroksylacje i dekoniugacje zwiększają pKa kwasów żółciowych, a tym samym ich hydrofobowość, umożliwiając w pewnym stopniu bierne wchłanianie przez ścianę jelita grubego.
Zwiększenie hydrofobowości wiąże się również ze zwiększoną toksycznością tych cząsteczek. A wysokie stężenie wtórnych kwasów żółciowych w żółci, krwi i kału został powiązany z patogenezą raka jelita grubego.
Rozpuszczalne włókna i reabsorpcji soli żółciowych
Reabsorpcja soli żółciowych może być zmniejszona przez działanie chelatujące rozpuszczalnych włókien, takich jak te znajdujące się w świeżych owoców, roślin strączkowych, owsa i otrąb owsianych, które wiążą je, zmniejszając ich absorpcję. To z kolei zwiększa syntezę kwasów żółciowych de novo, zwiększając ekspresję 7α-hydroksylazy i 12α-hydroksylazy sterolowej (patrz poniżej), a tym samym zmniejsza stężenie cholesterolu w hepatocytach.
Zubożenie cholesterolu wątrobowego zwiększa ekspresję receptora LDL, a tym samym zmniejsza stężenie cholesterolu LDL w osoczu. Z drugiej strony, stymuluje również syntezę reduktazy HMG-CoA, kluczowego enzymu w biosyntezie cholesterolu.
Uwaga: Niektóre leki przeciwcholesterolowe działają poprzez wiązanie kwasów żółciowych w jelicie, zapobiegając w ten sposób ich reabsorpcji.
Synteza podstawowych kwasów żółciowych
Kwasy żółciowe są głównym produktem metabolizmu cholesterolu.
Jak wcześniej powiedziano, krążenie enterohepatyczne i ich synteza de novo utrzymują stałą wielkość puli kwasów żółciowych. W szczególności, synteza de novo pozwala na zastąpienie soli żółciowych wydalanych w twarzach, około 5-10% puli ciała, czyli ~ 0,5 g/dobę.
Poniżej opisano syntezę kwasu cholowego i kwasu chenodeoksycholowego oraz ich koniugację z aminokwasami tauryną i glicyną.
Istnieją dwa główne szlaki syntezy kwasów żółciowych: szlak klasyczny i szlak alternatywny. Ponadto opisane zostaną również niektóre inne pomniejsze szlaki.
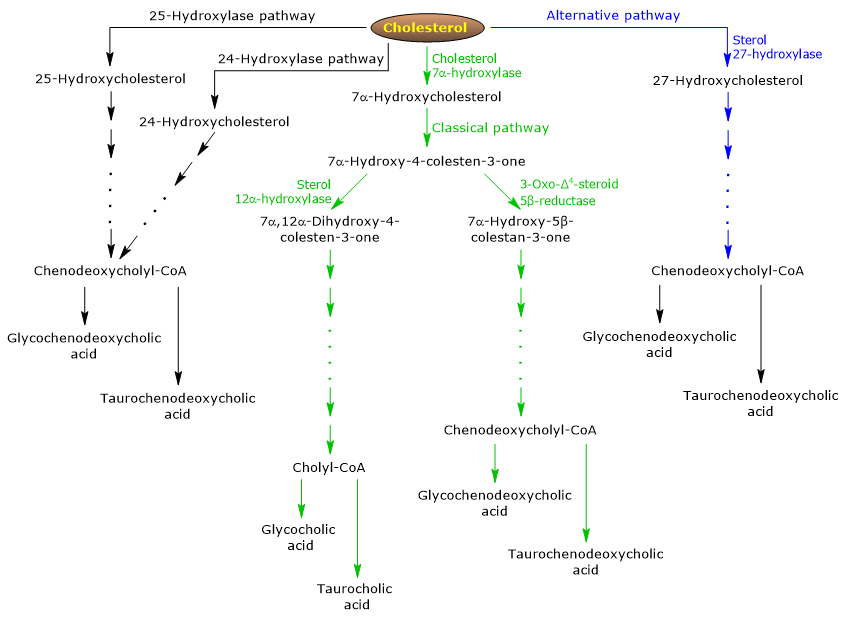
Scieżka klasyczna lub neutralna
W organizmie człowieka do 90% soli żółciowych jest wytwarzanych na drodze klasycznej (patrz ryc. 5), zwanej również „neutralną”, ponieważ produkty pośrednie są neutralnymi cząsteczkami.
- Pierwszą reakcją jest hydroksylacja w pozycji 7 cholesterolu, w celu utworzenia 7α-hydroksycholesterolu. Reakcja ta jest katalizowana przez 7α-hydroksylazę cholesterolową lub CYP7A1 (E.C. 1.14.14.23). Jest to enzym zlokalizowany w retikulum endoplazmatycznym i katalizuje etap ograniczający szybkość reakcji.
Cholesterol + NADPH + H+ + O2 → 7α-Hydroksycholesterol + NADP+ + H2O
- 7α-Hydroksycholesterol ulega utlenieniu grupy 3β-hydroksylowej i przesunięciu wiązania podwójnego z pozycji 5,6 do pozycji 4,5, tworząc 7α-hydroksy-4-cholesten-3-on. Reakcja jest katalizowana przez oksydoreduktazę 3β-hydroksy-Δ5-C27-steroidową lub HSD3B7 (E.C. 1.1.1.181), enzym zlokalizowany w retikulum endoplazmatycznym.
- 7α-hydroksy-4-cholesten-3-on może podążać dwoma drogami:
wejść na szlak prowadzący do syntezy kwasu cholowego, poprzez reakcję katalizowaną przez 7α-hydroksy-4-cholesten-3-on 12α-monooxygenase lub sterol 12α-hydroxylase lub CYP8B1 (E.C. 1.14.18.8), enzymu zlokalizowanego w retikulum endoplazmatycznym;
do wejścia na szlak prowadzący do syntezy kwasu chenodeoksycholowego, poprzez reakcję katalizowaną przez 5β-reduktazę 3-okso-Δ4-steroidową lub AKR1D1 (E.C. 1.3.1.3), enzym cytozolowy.
Należy podkreślić, że aktywność 12α-hydroksylazy sterolowej decyduje o stosunku kwasu cholowego do kwasu chenodeoksycholowego, a ostatecznie o zdolności detergentowej puli kwasów żółciowych. I w rzeczywistości, regulacja transkrypcji genu 12α-hydroksylazy sterolu jest jednym z głównych kroków regulacyjnych klasycznego pathway.
W związku z tym, jeśli 7α-hydroksy-4-cholesten-3-on przechodzi przez reakcję katalizowaną przez 12α-hydroksylazę sterolu, wystąpią następujące reakcje.
- 7α-hydroksy-4-cholesten-3-on jest hydroksylowany w pozycji 12 przez 12α-hydroksylazę sterolu, tworząc 7α,12α-dihydroksy-4-cholesten-3-on.
- 7α,12α-dihydroksy-4-cholesten-3-on ulega redukcji wiązania podwójnego w pozycji 4,5, w reakcji katalizowanej przez 3-okso-Δ4-steroidową 5β-reduktazę, tworząc 5β-cholestan-7α,12α-diol-3-on.
- 5β-Cholestan-7α,12α-diol-3-on ulega redukcji grupy hydroksylowej w pozycji 4, w reakcji katalizowanej przez dehydrogenazę 3α-hydroksysteroidową lub AKR1C4 (EC 1.1.1.1.213), enzym cytozolowy, tworząc 5β-cholestan-3α,7α,12α-triol.
- 5β-Cholestan-3α,7α,12α-triol ulega utlenieniu łańcucha bocznego w trzech reakcjach katalizowanych przez 27-hydroksylazę sterolową lub CYP27A1 (EC 1.14.15.15). Jest to enzym mitochondrialny, obecny również w tkankach pozawątrobowych i makrofagach, który wprowadza grupę hydroksylową w pozycji 27. Grupa hydroksylowa jest utleniana do aldehydu, a następnie do kwasu karboksylowego, tworząc kwas 3α,7α,12α-trihydroksy-5β-cholestanowy.
- Kwas 3α,7α,12α-trihydroksy-5β-cholestanowy jest aktywowany do jego estru koenzymu A, 3α,7α,12α-trihydroksy-5β-cholestanoyl-CoA, w reakcji katalizowanej przez syntetazy acylo-CoA o bardzo długim łańcuchu lub VLCS (EC 6.2.1.1.-) lub syntetazy kwasu żółciowego CoA lub BACS (EC 6.2.1.7), oba zlokalizowane w retikulum endoplazmatycznym.
- 3α,7α,12α-Trihydroksy-5β-cholestanoyl-CoA jest transportowany do peroksysomów, gdzie ulega pięciu kolejnym reakcjom, z których każda jest katalizowana przez inny enzym. W dwóch ostatnich reakcjach łańcuch boczny ulega skróceniu do czterech atomów węgla i ostatecznie powstaje choliloCoA.
- W ostatnim etapie dochodzi do sprzężenia, poprzez wiązanie amidowe, grupy kwasu karboksylowego łańcucha bocznego z aminokwasem glicyną lub tauryną. Reakcja ta jest katalizowana przez N-acylotransferazę kwas żółciowy-CoA:aminokwas lub BAAT (EC 2.3.1.65), która jest zlokalizowana głównie w peroksysomach.
Produktami reakcji są zatem sprzężone kwasy żółciowe: kwas glikocholowy i kwas taurocholowy.
Jeśli 7α-hydroksy-4-cholesten-3-on nie przechodzi przez reakcję katalizowaną przez 12α-hydroksylazę sterolową, wchodzi na szlak prowadzący do syntezy koniugatów kwasu chenodeoksycholowego, poprzez reakcje opisane poniżej.
- 7α-Hydroksy-4-cholesten-3-on jest przekształcany do 7α-hydroksy-5β-cholestan-3-onu w reakcji katalizowanej przez 5β-reduktazę 3-okso-Δ4-steroidową.
- 7α-Hydroksy-5β-cholestan-3-on jest przekształcany do 5β-cholestan-3α,7α-diolu w reakcji katalizowanej przez dehydrogenazę 3α-hydroksysteroidową.
Następnie, sprzężone kwasy żółciowe kwas glikochenodezoksycholowy i kwas taurochenodezoksycholowy są tworzone przez modyfikacje podobne do tych widzianych dla sprzężenia kwasu cholowego, i katalizowane głównie przez te same enzymy.
Uwaga: Nieskoniugowane kwasy żółciowe powstałe w jelicie muszą dotrzeć do wątroby, aby zostać ponownie sprzężone.
Scieżka alternatywna lub kwaśna
Przeważa u płodu i noworodka, natomiast u dorosłych prowadzi do syntezy mniej niż 10% soli żółciowych.
Scieżka ta (patrz rys. 5) różni się od szlaku klasycznego tym, że:
- produktami pośrednimi są cząsteczki kwasowe, od których pochodzi alternatywna nazwa „szlak kwasowy”;
- po utlenieniu łańcucha bocznego następują modyfikacje jądra steroidowego, a nie odwrotnie;
- produktami końcowymi są koniugaty kwasu chenodeoksycholowego.
Pierwszy etap obejmuje przekształcenie cholesterolu w 27-hydroksycholesterol w reakcji katalizowanej przez sterolową 27-hydroksylazę.
27-hydroksycholesterol może podążać dwiema drogami.
Trasa A
- 27-hydroksycholesterol jest przekształcany do kwasu 3β-hydroksy-5-cholestenowego w reakcji katalizowanej przez 27-hydroksylazę sterolową.
- Kwas 3β-hydroksy-5-cholestenowy jest hydroksylowany w pozycji 7 w reakcji katalizowanej przez 7α-hydroksylazę oksysterolową lub CYP7B1 (EC 1.14.13.100), enzym zlokalizowany w retikulum endoplazmatycznym, w celu utworzenia kwasu 3β-7α-dihydroksy-5-kolestenowego.
- Kwas 3β-7α-dihydroksy-5-cholestenowy jest przekształcany do kwasu 3-okso-7α-hydroksy-4-cholestenowego, w reakcji katalizowanej przez oksydoreduktazę 3β-hydroksy-Δ5-C27-steroidową.
- Kwas 3-okso-7α-hydroksy-4-cholestenowy, w wyniku modyfikacji łańcucha bocznego, tworzy kwas chenodeoksycholowy, a następnie jego koniugaty.
Droga B
- 27-Hydroksycholesterol jest przekształcany do 7α,27-dihydroksycholesterolu w reakcji katalizowanej przez 7α-hydroksylazę oksysterolową i 7α-hydroksylazę cholesterolową.
- 7α,27-dihydroksycholesterol jest przekształcany do 7α,26-dihydroksy-4-cholesten-3-onu w reakcji katalizowanej przez oksydoreduktazę 3β-hydroksy-Δ5-C27-steroidową;
7α, 26-dihydroksy-4-cholesten-3-on może być przekształcony bezpośrednio do koniugatów kwasu chenodeoksycholowego lub może być przekształcony do kwasu 3-okso-7α-hydroksy-4-kolestenowego, a następnie ulec modyfikacji łańcucha bocznego i innym reakcjom prowadzącym do syntezy koniugatów kwasu chenodeoksycholowego.
Pomniejsze szlaki
Istnieją również pomniejsze szlaki (patrz rys. 5), które przyczyniają się do syntezy soli żółciowych, chociaż w mniejszym stopniu niż szlaki klasyczne i alternatywne.
Na przykład:
- 25-hydroksylaza cholesterolu (EC 1.14.99.38) ulega ekspresji w wątrobie.
- A 24-hydroksylaza cholesterolowa lub CYP46A1 (EC 1.14.14.25) ulega ekspresji w mózgu, a zatem, chociaż narząd ten nie może eksportować cholesterolu, eksportuje oksysterole.
- Odkryto również niespecyficzną 7α-hydroksylazę. Ulega ona ekspresji we wszystkich tkankach i wydaje się być zaangażowana w wytwarzanie oksysteroli, które mogą być transportowane do hepatocytów w celu przekształcenia w kwas chenodeoksycholowy.
Dodatkowo 27-hydroksylaza sterolowa ulega ekspresji w różnych tkankach, dlatego produkty jej reakcji muszą być transportowane do wątroby w celu przekształcenia w sole żółciowe.
Sole żółciowe: regulacja syntezy
Regulacja syntezy kwasów żółciowych zachodzi poprzez mechanizm ujemnego sprzężenia zwrotnego, w szczególności na ekspresję 7α-hydroksylazy cholesterolowej i 12α-hydroksylazy sterolowej.
Gdy występuje nadmiar kwasów żółciowych, zarówno wolnych, jak i sprzężonych, cząsteczki te wiążą się z receptorem jądrowym receptora farnezoidowego X lub FRX, aktywując go: najbardziej skutecznym kwasem żółciowym jest kwas chenodeoksycholowy, podczas gdy inne, takie jak kwas ursodeoksycholowy, nie aktywują go.
FRX indukuje ekspresję represora transkrypcji – małego partnera heterodimeru lub SHP, który z kolei oddziałuje z innymi czynnikami transkrypcyjnymi, takimi jak homolog receptora wątrobowego-1 lub LRH-1 i hepatocytowy czynnik jądrowy-4α lub HNF-4α. Te czynniki transkrypcyjne wiążą się z sekwencją w regionie promotorowym genów 7α-hydroksylazy i 12α-hydroksylazy, region nazywany elementami odpowiedzi na kwasy żółciowe lub BARE, hamując ich transkrypcję.
Jednym z powodów, dla których synteza soli żółciowych jest ściśle regulowana, jest fakt, że wiele ich metabolitów jest toksycznych.
Chiang J.Y.L. Bile acids: regulation of synthesis. J Lipid Res 2009;50(10):1955-66. doi:10.1194/jlr.R900010-JLR200
Gropper S.S., Smith J.L. Zaawansowane żywienie i metabolizm człowieka. 6h Edition. Cengage Learning, 2012
Moghimipour E., Ameri A., and Handali S. Absorption-enhancing effects of bile salts. Molecules 2015;20(8); 14451-73. doi:10.3390/molecules200814451
Monte M.J., Marin J.J.G., Antelo A., Vazquez-Tato J. Bile acids: Chemistry, physiology, and pathophysiology. World J Gastroenterol 2009;15(7):804-16. doi:10.3748/wjg.15.804
Rawn J.D. Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990
Rosenthal M.D., Glew R.H. Medical biochemistry – Human metabolism in health and disease. John Wiley J. & Sons, Inc, Publication, 2009
Sundaram S.S., Bove K.E., Lovell M.A. and Sokol R.J. Mechanisms of Disease: inborn errors of bile acid synthesis. Nat Clin Pract Gastroenterol Hepatol 2008;5(8):456-68. doi:10.1038/ncpgasthep1179
.