Pierwiastek chemiczny chlor jest klasyfikowany jako halogen i niemetal. Został odkryty w 1774 roku przez Carla Wilhelma Scheele.

Strefa danych
| Klasyfikacja: | Chlor jest halogenem i niemetalem |
| Kolor: | zielonkawo-żółty |
| Waga atomowa: | 35.453 |
| Stan: | gaz |
| Temperatura topnienia: | -101 oC , 172 K |
| Temperatura wrzenia: | -34 oC , 239 K |
| Elektrony: | 17 |
| Protony: | 17 |
| Neutrony w najobficiej występującym izotopie: | 18 |
| Powłoki elektronowe: | 2,8,7 |
| Konfiguracja elektronowa: | 1s2 2s2 2p6 3s2 3p5 |
| Gęstość @ 20oC: | 0.003214 g/cm3 |
Pokaż więcej, w tym: Ciepła, Energie, Utlenianie, Reakcje,
Związki, Promienie, Przewodnictwo
| Objętość atomowa: | 22,7 cm3/mol |
| Struktura: | warstwy Cl2 w ciele stałym |
| Twardość: | |
| Ciepło właściwe | 0,48 J g-1 K-1 |
| Ciepło topnienia | 6.406 kJ mol-1 Cl2 |
| Ciepło atomizacji | 122 kJ mol-1 |
| Ciepło parowania | 20.41 kJ mol-1 Cl2 |
| 1. energia jonizacji | 1251.1 kJ mol-1 |
| 2. energia jonizacji | 2297.3 kJ mol-1 |
| 3-cia energia jonizacji | 3821.8 kJ mol-1 |
| Przywiązanie elektronów | 349 kJ mol-1 |
| Minimalna liczba utlenienia | -1 |
| Min. wspólna liczba utlenienia | -1 |
| Maksymalna liczba utlenienia | 7 |
| Maks. wspólna liczba utlenienia | 7 |
| Elektroujemność (skala Paulinga) | 3,16 |
| Objętość polaryzacji | 2.2 Å3 |
| Reakcja z powietrzem | brak |
| Reakcja z 15 M HNO3 | łagodna, ⇒ HClOx, NOxCl, NOx |
| Reakcja z 6 M HCl | łagodna, ⇒ HOCl, Cl- |
| Reakcja z 6 M NaOH | łagodna, ⇒ OCl-, Cl- |
| Tlenek(i) | Cl2O, ClO2, Cl2O7 |
| Wodorek(s) | HCl |
| Chlorek(s) | Cl2 |
| Promień atomowy | 100 pm |
| Promień jonowy Radius (1+ jon) | – |
| Ionic radius (2+ jon) | – |
| Ionic radius (3+ jon) | – |
| Ionic radius (1- jon) | 167 pm |
| Promień jonowy (2- jon) | – |
| Promień jonowy (3- jon) | – |
| Przewodność cieplna | 0.0089 W m-1 K-1 |
| Przewodność elektryczna | – |
| Temperatura zamarzania/topnienia: | -101 oC , 172 K |

Chlor In Test Tube (Photo: Ben Mills)
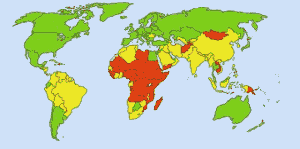
Bezpieczna woda pitna: Obraz: Ionut_Cojocaru. W zielonych obszarach każdy może uzyskać bezpieczną wodę. Na obszarach czerwonych, co najmniej 25 procent ludzi nie może uzyskać uzdatnionej wody. Obszary żółte są pośrednie. Zanim zaczęto rutynowo stosować chlor w amerykańskich wodociągach, tyfus brzuszny powodował 25 000 ofiar śmiertelnych każdego roku. Obecnie 98% publicznych źródeł wody jest uzdatnianych chlorem lub związkami chloru. Tyfus brzuszny pochłania obecnie średnio około jednej ofiary rocznie. (4)

Carl Wilhelm Scheele, który odkrył chlor w 1774 r.
Odkrycie chloru
Chlor został po raz pierwszy wyprodukowany w 1774 r. przez Carla Wilhelma Scheele w Szwecji. Scheele zebrał gaz uwolniony w wyniku reakcji piroluzytu z spiritus salis – termin alchemiczny oznaczający ducha/oddech soli. Nowy gaz miał, według Scheelego, „bardzo wyczuwalny duszący zapach, który był najbardziej uciążliwy dla płuc… i nadaje wodzie lekko kwaśny smak… powietrze w nim nabiera żółtego koloru…” (1)
Scheele zauważył również wysoką reaktywność i właściwości wybielające nowego gazu, który wytworzył: „…wszystkie metale zostały zaatakowane… stała zasada została zamieniona na zwykłą sól… wszystkie kwiaty roślinne – czerwone, niebieskie i żółte – stały się białe w krótkim czasie; to samo stało się z roślinami zielonymi… owady natychmiast zginęły”. (1)
Pomimo dokładności swoich obserwacji Scheele błędnie sądził, że nowy gaz był zdephlostignifikowaną formą kwasu muriatowego.
Słynny francuski chemik Antoine Lavoisier uważał, że nowy gaz powinien być nazwany kwasem oksymuriatowym na podstawie nieodkrytego jeszcze pierwiastka muru. (2)
* Zamieszanie wokół prawdziwej tożsamości chloru było spowodowane teorią flogistonu; flogiston był akceptowany przez chemików przez większość lat 1700 – do czasu, gdy Lavoisier sam ją obalił. Flogiston był „substancją” używaną do wyjaśniania niewytłumaczalnych wówczas zjawisk. Wygodnie, miał ujemną wagę, kiedy trzeba, i „wyjaśnił” reakcje, takie jak rdzewienie i spalanie.
Lavoisier był architektem upadku flogistonu, pokazując, że chemia tlenu była lepszym wyjaśnieniem w reakcjach chemicznych niż flogiston. (3)
Do 1810 roku konsensus naukowy był taki, że element, który teraz nazywamy chlorem, był w rzeczywistości związkiem, który zawierał tlen. Angielski chemik Sir Humphry Davy odkrył, że konsensus był błędny; nie mógł uzyskać nowego żółto-zielonego gazu do reakcji z elektrodą węglową, co sprawiło, że uwierzył, że może on nie zawierać tlenu. W reakcjach z fosforem i amoniakiem wykazał, że nowy gaz nie zawiera tlenu. Użył ogromnego, 2000 płytowego stosu woltaicznego, aby sprawdzić, czy może wyodrębnić tlen ze związków fosforu i siarki zawartych w tym gazie, ale ponownie nie znalazł tlenu. (1a)
W 1811 roku Davy doszedł do wniosku, że nowy gaz jest w rzeczywistości nowym pierwiastkiem. (1b) Nazwał go chlorem, od greckiego słowa „chloros”, oznaczającego bladozielony lub żółto-zielony.
Interesting Facts about Chlorine
- Pierwsza odkryta reakcja łańcuchowa nie była reakcją jądrową; była to chemiczna reakcja łańcuchowa. Została odkryta w 1913 r. przez Maxa Bodensteina, który zaobserwował, że mieszanina chloru i wodoru eksploduje pod wpływem światła. Mechanizm reakcji łańcuchowej został w pełni wyjaśniony w 1918 roku przez Walthera Nernsta.
- Ziemskie oceany zawierają duże ilości chloru. Gdyby ten chlor został uwolniony jako gaz, jego masa byłaby 5x większa niż całkowita obecna atmosfera Ziemi. (Nasze oceany zawierają około 2,6 x 1016 ton metrycznych chloru, głównie w postaci chlorku sodu.)
- Chlor jest nie tylko obfity w naszych oceanach; jest szóstym najbardziej obfitym pierwiastkiem w skorupie ziemskiej.
- Narażenie na małe ilości chloru, nawet przez krótki czas, może być śmiertelne. Oczekiwane są przypadki śmiertelne przy stężeniu chloru w powietrzu wynoszącym 1 część na tysiąc (lub czasami przy jeszcze niższych stężeniach). (5)
- Chlor jest cięższy od powietrza. Po uwolnieniu tworzy trujący koc, który dryfuje z wiatrem. Chlor był używany jako broń chemiczna podczas I wojny światowej, najpierw w 1915 r. przez armię niemiecką, a następnie przez aliantów zachodnich. Nie była ona tak „skuteczna”, jak się spodziewano, ponieważ chlor jest łatwo wykrywalny przez swój silny zapach. Jest również rozpuszczalny w wodzie, dlatego żołnierze mogli chronić się przed najgorszymi skutkami jego działania, oddychając przez wilgotne szmaty.

Wygląd i właściwości
Szkodliwe skutki działania:
Chlor jest gazem toksycznym, drażniącym skórę, oczy i układ oddechowy.
Właściwości:
Chlor jest zielonkawo-żółtym, dwuatomowym, gęstym gazem o ostrym zapachu (zapach wybielacza).
Nie występuje w przyrodzie w stanie wolnym, gdyż łatwo łączy się z prawie wszystkimi innymi pierwiastkami.
Chlor występuje w przyrodzie głównie w postaci soli kuchennej (NaCl), karnalitu i sylwinitu (KCl).
W postaci ciekłej i stałej jest silnym środkiem wybielającym, utleniającym i dezynfekującym.
Zastosowanie chloru
Chlor jest wykorzystywany do produkcji bezpiecznej wody pitnej.
Związki chlorowe są stosowane głównie do celów sanitarnych, bielenia masy celulozowej, środków dezynfekujących i w przetwórstwie włókienniczym.
Chlor jest również używany do produkcji chloranów i jest ważny w chemii organicznej, tworząc związki takie jak chloroform, czterochlorek węgla, polichlorek winylu i kauczuk syntetyczny.
Inne zastosowania związków chloru obejmują barwniki, produkty naftowe, leki, środki antyseptyczne, środki owadobójcze, środki spożywcze, rozpuszczalniki, farby i tworzywa sztuczne.
Abundance and Isotopes
Abundance earth’s crust: 145 parts per million by weight, 85 parts per million by moles
Abundance solar system: 8 parts per million by weight, 0.3 parts per million by moles
Cost, pure: $0.15 per 100g
Cost, bulk: $ per 100g
Source: Chlor gazowy jest produkowany komercyjnie przez elektrolizę chlorku sodu (NaCl) z wody morskiej lub solanki z kopalni soli.
Izotopy: Chlor ma 16 izotopów, których okresy półtrwania są znane, o liczbach masowych od 31 do 46. Naturalnie występujący chlor jest mieszaniną jego dwóch stabilnych izotopów 35Cl i 37Cl, których naturalne stężenie wynosi odpowiednio 75,8% i 24,3%.

- Henry M. Leicester, Herbert S. Klickstein, A Source Book in Chemistry, 1400-1900., (1969) Harvard University Press. str111; 1a. str241.; 1b. str257.
- J.W. Mellor, A Comprehensive Treatise on Inorganic and Theoretical Chemistry., 1922, vol 2, Longmans, Green and Co., p21.
- Antoine Lavoisier, Memoires de l’ Academie royale des sciences 1783., 1786, p505-538.
- Drzewo chloru.
- OSHA, Occupational Safety and Health Guideline for Chlorine.
Cite this Page
W celu umieszczenia odnośnika online, proszę skopiować i wkleić jeden z następujących elementów:
<a href="https://www.chemicool.com/elements/chlorine.html">Chlorine</a>
lub
<a href="https://www.chemicool.com/elements/chlorine.html">Chlorine Element Facts</a>
Aby zacytować tę stronę w dokumencie akademickim, proszę użyć następującego cytatu zgodnego ze standardem MLA:
"Chlorine." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/chlorine.html>.
.