

Teoria atomowa Johna Daltona stworzyła podstawy nowoczesnej chemii.
Wczesne życie i edukacja Johna Daltona
John Dalton urodził się 6 września 1766 roku w Eaglesfield, w Anglii, w Wielkiej Brytanii.
Oboje jego rodzice byli kwakrami. Chociaż kwakrzy byli chrześcijanami, byli postrzegani jako innowiercy przez ustanowiony Kościół Anglii. W wyniku tego, wyższe możliwości edukacyjne Johna Daltona były ograniczone do dysydenckich miejsc edukacji.
Jego ojciec był tkaczem, który posiadał dom i niewielką ilość ziemi.
John Dalton był inteligentnym dzieckiem, które interesowało się otaczającym go światem i próbowało dowiedzieć się jak najwięcej o wszystkim.
Uczęszczał do swojej wiejskiej szkoły do 11 roku życia, a następnie zaczął pomagać jako nauczyciel.
W wieku 15 lat zaczął pomagać swojemu starszemu bratu Johnowi w prowadzeniu szkoły z internatem kwakrów w mieście Kendal, 40 mil od jego domu. Przez cały czas uczył się nauk ścisłych, matematyki, łaciny, greki i francuskiego. W wieku 19 lat został dyrektorem szkoły, pełniąc tę funkcję do 26 roku życia.
Wydaje się, że uczniowie szkoły cieszyli się z nauczania Daltona, jeden z nich wspomina:
„Chłopcy (byli) wszyscy zadowoleni, że uczy ich John Dalton, ponieważ miał łagodniejsze usposobienie; a poza tym jego umysł był tak zajęty matematyką, że ich błędy umknęły jego uwadze.”
Becoming a Scientist
W pierwszej połowie 1793 roku, w wieku 26 lat, Dalton objął stanowisko nauczyciela matematyki i filozofii naturalnej w Manchester’s New College, kolegium dysydenckim.
W 1794 roku napisał swoją pierwszą pracę naukową, którą zatytułował: Extraordinary Facts Relating to the Vision of Colours.
To był pierwszy w historii papier do dyskusji ślepota kolorów. Dalton zdał sobie sprawę, że warunek ten był dziedziczny, ponieważ on i inni członkowie jego rodziny mieli to. Ostatecznie, Dalton teorii ślepoty kolorów było źle, ale jak był pierwszą osobą w historii do badania go, warunek stał się znany jako Daltonism.
Po tym, opublikował więcej prac badawczych w naukach fizycznych patrząc na przewodzenie ciepła, ekspansji gazu przez ciepło, właściwości światła, zorza polarna, i meteorologii.
W 1800 roku Dalton zrezygnował z pracy w New College, który miał problemy finansowe, i zaczął pracować jako prywatny korepetytor nauk ścisłych i matematyki.
Teoria atomowa
Zachowanie gazów
W 1801 roku Dalton wygłosił w Manchesterze serię wykładów, których treść została opublikowana w 1802 roku. W wykładach tych przedstawił badania, które prowadził nad gazami i cieczami. Badania te były przełomowe, oferując nowe spojrzenie na naturę gazów.
Po pierwsze, Dalton stwierdził poprawnie, że nie ma wątpliwości, iż wszystkie gazy mogą być skroplone, pod warunkiem, że ich temperatura jest wystarczająco niska, a ciśnienie wystarczająco wysokie.
To było pierwsze publiczne stwierdzenie tego, co ostatecznie stało się znane jako Prawo Gay-Lussaca, nazwane tak na cześć Josepha Gay-Lussaca, który opublikował je w 1809 roku.
W 1803 roku Dalton opublikował swoje Prawo ciśnień cząstkowych, wciąż używane przez każdego studenta chemii na uniwersytecie, które stwierdza, że w mieszaninie niereagujących gazów całkowite ciśnienie gazu jest równe sumie ciśnień cząstkowych poszczególnych gazów.
Praca Daltona wyróżniała go jako naukowca pierwszej rangi i był on zapraszany do wygłaszania wykładów w Royal Institution w Londynie.
Dalton i atomy
Badanie gazów doprowadziło Daltona do zastanowienia się, z czego tak naprawdę zbudowane są te niewidzialne substancje.
Pomysł atomów został po raz pierwszy zaproponowany ponad 2000 lat wcześniej przez Demokryta w starożytnej Grecji. Demokryt wierzył, że wszystko jest zrobione z maleńkich cząsteczek zwanych atomami i że te atomy nie mogą być podzielone na mniejsze cząsteczki. Czy Demokryt miał rację? Nikt nie wiedział!
Dalton zamierzał teraz rozwiązać tę 2000-letnią zagadkę.
Przeprowadził niezliczone reakcje chemiczne i w 1808 r. opublikował w książce „A New System of Chemical Philosophy” to, co dziś nazywamy prawem Daltona:
Jeśli dwa pierwiastki tworzą między sobą więcej niż jeden związek, to stosunki mas drugiego pierwiastka, które łączą się ze stałą masą pierwszego pierwiastka, będą stosunkami małych liczb całkowitych.
Na przykład Dalton stwierdził, że 12 gramów węgla może reagować z 16 gramami tlenu, tworząc związek, który obecnie nazywamy tlenkiem węgla.
Stwierdził również, że 12 gramów węgla może reagować z 32 gramami tlenu, tworząc dwutlenek węgla.
Ten stosunek 32:16, który upraszcza się do 2:1, zaintrygował Daltona.
Analizując wszystkie zebrane przez siebie dane, Dalton wyraził przekonanie, że materia istnieje jako atomy. Posunął się dalej niż Demokryt, stwierdzając, że atomy różnych pierwiastków mają różną masę. Opublikował również diagramy pokazujące na przykład:
1. Jak atomy łączą się, tworząc cząsteczki
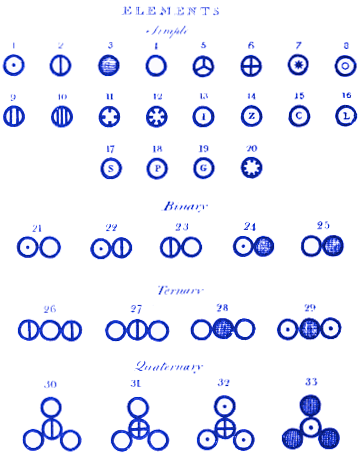

Na górze swojego diagramu Dalton przypisuje atomowi 1 rolę wodoru, 2 azotu, 3 węgla, 4 tlenu, 5 fosforu itd.
Następnie pokazuje, jak mogą wyglądać cząsteczki, gdy atomy łączą się, tworząc związki. Na przykład, cząsteczka 21 to woda (OH), 22 to amoniak (NH), a 23 to tlenek azotu (NO). Współczesny czytelnik zauważy, że Dalton pomylił cząsteczki 21 i 22. Jest to mniej istotne niż fakt, że system atomów i cząsteczek Daltona jest niemal identyczny z tym, jak możemy je przedstawić dzisiaj. Na przykład, cząsteczka 28 Daltona to dwutlenek węgla. Dziś nadal rysowalibyśmy dwutlenek węgla w ten sposób.
Amedeo Avogadro wkrótce opublikował pracę, która opierała się na systemie Daltona i poprawiała niektóre z jego błędów – na przykład Avogadro stwierdził, że woda powinna być zapisywana jako H20. Niestety prace Avogadro były ignorowane przez wiele lat, częściowo dlatego, że nie zgadzały się z pracami Daltona.
2. Jak cząsteczki wody mogą wyglądać w lodzie
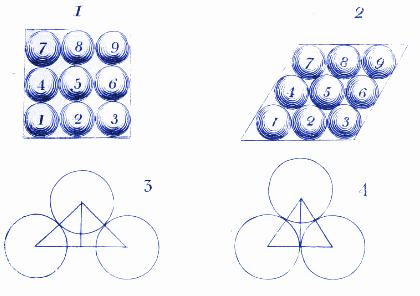

Tutaj Dalton pokazuje, jak cząsteczki wody mogą się ułożyć, gdy są zamrożone w lodzie. Dziś używamy podobnych diagramów, aby pokazać, jak atomy i cząsteczki układają się w kryształach.
Teoria atomowa Daltona stwierdza, że:
1. Pierwiastki zbudowane są z atomów, które są maleńkimi cząsteczkami, zbyt małymi, aby je zobaczyć.
2. Wszystkie atomy danego pierwiastka są identyczne.
3. Atomy różnych pierwiastków mają różne właściwości: ich masy są różne, a ich reakcje chemiczne są różne.
4. Atomy nie mogą być tworzone, niszczone ani rozszczepiane.
5. W reakcji chemicznej atomy łączą się ze sobą lub oddzielają od siebie.
6. Atomy łączą się ze sobą w prostych proporcjach liczb całkowitych, tworząc związki.
Choć dowiedzieliśmy się, że atomy tego samego pierwiastka mogą mieć różne masy (izotopy) i mogą się rozszczepiać w reakcjach jądrowych, większość teorii atomowej Daltona obowiązuje do dziś, ponad 200 lat po tym, jak ją opisał. Jest to fundament, na którym zbudowano nowoczesną chemię.
 „Trwała reputacja pana Daltona spocznie na tym, że odkrył prostą zasadę, powszechnie stosowaną w chemii – w ustalaniu proporcji, w jakich łączą się ciała, i w ten sposób stworzył podstawy dla przyszłych prac… jego zasługi w tym względzie przypominają zasługi Keplera w astronomii.”
„Trwała reputacja pana Daltona spocznie na tym, że odkrył prostą zasadę, powszechnie stosowaną w chemii – w ustalaniu proporcji, w jakich łączą się ciała, i w ten sposób stworzył podstawy dla przyszłych prac… jego zasługi w tym względzie przypominają zasługi Keplera w astronomii.”
Honory
Dalton nie ożenił się i nie miał dzieci. Pozostał wiernym kwakrem przez całe życie, żyjąc skromnie.
W 1810 roku odrzucił zaproszenie do członkostwa w Royal Society. W 1822 roku, został wybrany bez jego wiedzy. W 1826 r. otrzymał Medal Królewski Towarzystwa za teorię atomu.
W 1833 r. Francuska Akademia Nauk wybrała go na jednego z ośmiu zagranicznych członków. W 1834 roku Amerykańska Akademia Sztuk i Nauk wybrała go na członka zagranicznego.
Koniec
Kiedy miał 71 lat, Dalton doznał niewielkiego udaru – lub paraliżu, jak to wtedy nazywano. Rok później, poważniejszy udar sprawił, że nie mógł już mówić tak wyraźnie jak kiedyś. W 1844 roku, gdy miał 77 lat, doznał kolejnego udaru. Zmarł w wieku 77 lat 27 lipca 1844 roku.
Jego reputacja naukowa była tak wielka, że kiedy jego ciało zostało umieszczone w ratuszu w Manchesterze, odwiedziło je ponad 40 000 osób składających wyrazy szacunku. John Dalton został pochowany w Manchesterze na cmentarzu Ardwick.
.