Michael D. Ober, MD
Christina M. Klais, MD
Emmett T. Cunningham Jr, MD, PhD, MPH
Nowy Jork
Obrzęk plamki stanowi patologiczne nagromadzenie płynu pozakomórkowego w obrębie siatkówki, głównie w zewnętrznej warstwie splotowatej i wewnętrznej warstwie jądrowej, jako nieswoistą odpowiedź na przerwanie bariery krew-siatkówka. ME jest częstą przyczyną utraty wzroku u pacjentów z cukrzycą, niedrożnością żył siatkówki, zapaleniem błony naczyniowej oka oraz po operacjach wewnątrzgałkowych. Rzadziej występuje w przypadku trakcji witreoretinalnej, neowaskularyzacji naczyniówkowej i wielu innych schorzeń. W leczeniu ME stosowano wiele strategii z różnym powodzeniem. W tym artykule dokonano przeglądu dostępnych opcji leczenia tego częstego schorzenia.
 |
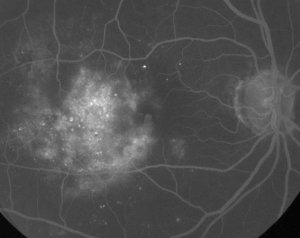 |
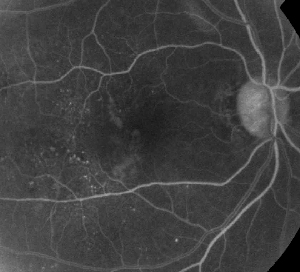
| Rycina 1. A. Angiografia fluoresceinowa wczesnej fazy u pacjenta z nieproliferacyjną retinopatią cukrzycową. Mikrotętniaki są widoczne najwyraźniej w części skroniowej do fovea, oprócz wycieku fluoresceiny w strefie awaskularnej fovea. | B. Późna faza FA u tego samego pacjenta, pokazująca rozproszony przeciek doczesny i w obrębie strefy awaskularnej siatkówki odpowiadający cukrzycowemu obrzękowi plamki. |
Diagnostyka
Kliniczne rozpoznanie ME najlepiej postawić przy użyciu soczewki kontaktowej i stereoskopowej biomikroskopii dna oka z lampą szczelinową. ME zazwyczaj objawia się jako nieregularne uniesienie w obrębie siatkówki, często sąsiadujące z lipidem śródsiatkówkowym, mikrotętniakami i/lub krwotokami w przypadkach wtórnych do cukrzycy, okluzji naczyniowej lub niedokrwienia. Płyn śródsiatkówkowy może również gromadzić się w torbielowatych przestrzeniach zlokalizowanych w siatkówce parafovealnej z lub bez przyległych nieprawidłowości naczyniowych. Torbielowaty obrzęk plamki (cystoid macular edema, CME) jest najczęściej wynikiem zapalenia, zlokalizowanej trakcji lub następstwem zabiegu chirurgicznego.
Angiografia fluoresceinowa jest podstawowym narzędziem w diagnostyce ME. W normalnym oku fluoresceina nie może przedostać się do siatkówki dzięki barierze krew-siatkówka. W ME jednak cząsteczki fluoresceiny opuszczają przestrzeń wewnątrznaczyniową i przedostają się do siatkówki. Miejsca zmienione chorobowo wykazują hiperfluorescencję we wczesnych i środkowych klatkach, która zwiększa swój obszar i intensywność w późniejszych klatkach (patrz Rycina 1). FA nie tylko uwidacznia obrzęk, ułatwiając wizualizację i lokalizację leczenia, ale także tworzy trwały zapis dla przyszłych porównań. Dla ME opracowano czterostopniową skalę ilościową, gdzie stopień 0 oznacza brak hiperfluorescencji okołooczodołowej, stopień 1 to niepełna hiperfluorescencja okołooczodołowa, stopień 2 to łagodna hiperfluorescencja 360 stopni, stopień 3 to umiarkowana hiperfluorescencja 360 stopni z obszarem hiperfluorescencji o średnicy około 1 dysku, a stopień 4 to ciężka hiperfluorescencja 360 stopni z obszarem hiperfluorescencji o średnicy około 1,5 dysku.1,2 Chociaż FA jest czułym sposobem identyfikacji obecności ME, dostarcza stosunkowo niewiele informacji na temat anatomicznego rozmieszczenia płynu, tj. rozproszony vs. torbielowaty vs. podsiatkówkowy, oraz nasilenia przecieku w czasie. FA nie dostarcza ilościowych informacji na temat pogrubienia siatkówki. Nie jest zatem zaskakujące, że ogólnie ten dwuwymiarowy system klasyfikacji oparty na FA słabo koreluje z widzeniem.3,4
Optyczna koherentna tomografia (OCT III, Carl Zeiss) jest bezkontaktową, nieinwazyjną techniką obrazowania, która stanowi użyteczne uzupełnienie diagnostyki ME. Skierowuje ona wiązkę światła bliskiej podczerwieni (830-nm) prostopadle do powierzchni siatkówki i analizuje właściwości odbić. W ciągu 1,5 sekundy powstaje pojedynczy liniowy obraz przekrojowy o wysokiej rozdzielczości. Na obrazach tych można uwidocznić, a nawet zmierzyć pogrubioną, torbielowatą siatkówkę występującą w obszarach obrzękowych. Jest to również użyteczne w wizualizacji właściwości interfejsu szklistkowo-siatkówkowego i skutecznie demonstruje, kiedy trakcja szklistki odgrywa rolę w powstawaniu ME (Zobacz Rysunek 2).
Jedno z badań wykorzystało OCT do zbadania 84 oczu z ME wtórnym do zapalenia błony naczyniowej, co przyniosło dodatkową korzyść w postaci ujawnienia lub potwierdzenia obecności błon epiretinalnych i surowiczego odwarstwienia siatkówki odpowiednio w 41 i 20 procentach przypadków.5 W badaniu stwierdzono umiarkowaną korelację między grubością siatkówki a obniżeniem ostrości wzroku, chociaż stopień korelacji był różny w różnych badaniach, a inni badacze zgłaszali słabe,6 umiarkowane,7 i silne8,9,10 korelacje przy użyciu różnych metod statystycznych w różnych populacjach pacjentów, w tym u pacjentów z retinopatią cukrzycową, zapaleniem błony naczyniowej i CME.
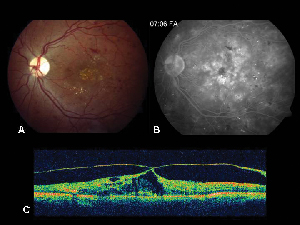
Ryc. 2. A. Kolorowe zdjęcie dna oka lewego u pacjenta z nieproliferacyjną retinopatią cukrzycową i wysiękiem lipidowym w i wokół fovea. B. FA późnej fazy ujawnia obrzęk plamki w centralnej plamce. C. Optyczna koherentna tomografia pokazuje nieprawidłowy interfejs szklistkowo-siatkówkowy, jak również obrzęk plamki.
Inna grupa doniosła, że OCT jest równie skuteczna jak FA w wykrywaniu ME i lepsza od FA w opisywaniu osiowego rozmieszczenia płynu.6 OCT jest również w stanie zidentyfikować niektórych pacjentów z ME nie uwidocznionym w FA, tak jak w niektórych przypadkach przewlekłego CME, gdzie rodzaj aktywnego przecieku najlepiej uwidocznionego w FA jest minimalny lub nawet nieobecny, lub gdy badanie dna oka jest utrudnione przez obecność zmętnień w mediach, tak jak u pacjentów z asteroid hyalosis.11
Analizator grubości siatkówki (RTA, Talia Technology, Izrael) jest podobną bezkontaktową techniką obrazowania, która pozwala na ilościowe określenie grubości siatkówki. Wykonuje on 16 równoległych skanów przekrojowych na obszarze siatkówki o wymiarach 3×3 mm kwadratowych, analizując odbicia od skośnie skierowanego impulsu światła zielonego (540 nm), dostarczanego przez 0,3 sekundy. Zarówno OCT jak i RTA wykazały doskonałą precyzję w indywidualnych pomiarach grubości siatkówki, a bezpośrednie porównanie tych technologii wykazało statystycznie istotną korelację pomiędzy ich pomiarami. Podczas gdy RTA ma zaletę szybkiej akwizycji z być może mniejszą ilością artefaktów, wydaje się być mniej skuteczna w pomiarze grubości siatkówki niż OCT w obecności zmętnień w mediach.12
Inne badanie porównało grubość foveal z RTA i OCT w 30 zdrowych oczach. Średnia grubość bruzdy w prawidłowych oczach wynosiła 181 µm i 153 µm, odpowiednio dla RTA i OCT. Autorzy doszli do wniosku, że RTA czasami daje fałszywie wysokie wartości, a zatem ma mniejszą wiarygodność w porównaniu z OCT.13 Z kolei w analizie pacjentów z łagodną nieproliferacyjną retinopatią cukrzycową stwierdzono, że RTA była bardziej czuła niż OCT w identyfikacji obszarów pogrubienia siatkówki w początkowych stadiach ME.14
 |
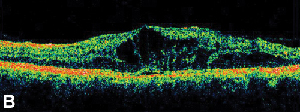 |
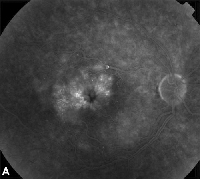
| Ryc. 3. A. Angiogram fluoresceinowy późnej fazy u pacjenta z torbielowatym obrzękiem plamki. | B. Optyczna koherentna tomografia komputerowa ukazująca duże przestrzenie torbielowate w obrębie fovea. |
Leczenie -medyczne
Topowe niesteroidowe leki przeciwzapalne są najczęstszym sposobem leczenia ME po operacji zaćmy (patrz ryc. 3). Środki te są ukierunkowane na obniżenie wewnątrzgałkowego stężenia prostaglandyn, które zostały włączone w patogenezę ME. W podwójnie maskowanych, randomizowanych, aktywnych i kontrolowanych placebo badaniach z udziałem pacjentów poddanych operacji zaćmy odnotowano działanie przeciwzapalne miejscowo stosowanych preparatów okulistycznych zawierających 1% indometacyny, 0,03% flurbiprofenu, 0,5% ketorolaku i 0,1% diklofenaku.15,16 Roztwory okulistyczne zawierające 0,1% diklofenaku i 0,5% ketorolaku są jednak jedynymi miejscowo stosowanymi NLPZ zatwierdzonymi przez Food and Drug Administration do stosowania w tym wskazaniu. Wykazano, że terapia łącząca miejscowo stosowane krople kortykosteroidów i NLPZ jest bardziej skuteczna w leczeniu ME niż leczenie każdym z tych leków osobno.16 Chociaż nie jest to lek zatwierdzony przez FDA, miejscowo stosowane NLPZ są często stosowane przed operacją zaćmy w celu zapobiegania pooperacyjnemu ME.
Oralny acetazolamid jest sporadycznie stosowany w leczeniu ME wtórnego do stanów zapalnych i retinitis pigmentosa, zwłaszcza gdy zawodzą miejscowe NLPZ i kortykosteroidy. Przeprowadzono kilka prospektywnych, zamaskowanych, krzyżowych badań porównujących acetazolamid i placebo u pacjentów z ME spowodowanym różnymi przyczynami. W pięciocyklowym badaniu krzyżowym z udziałem 41 pacjentów stwierdzono powtarzalną odpowiedź, charakteryzującą się częściowym lub całkowitym ustąpieniem ME, u ponad połowy pacjentów z dziedziczną lub zapalną chorobą siatkówki, ale bez odpowiedzi ze strony pacjentów z pierwotnymi chorobami naczyniowymi siatkówki.17 Stwierdzono, że acetazolamid podawany doustnie w dawce 500 mg/dobę jest skuteczniejszy niż 250 mg/dobę w leczeniu ME u pacjentów z ME wtórnym do RP.18 W badaniu tym poprawę zaobserwowano u 10 z 12 leczonych pacjentów.
Inna grupa stwierdziła, że pacjenci w wieku poniżej 55 lat z ME przypisywanym przewlekłemu zapaleniu tęczówki częściej reagowali na acetazolamid w dawce 500 mg doustnie niż starsi pacjenci.19 W jednym z ostatnich badań sugerowano, że acetazolamid może być również skuteczny w leczeniu ME wywołanego cukrzycą.20
Kortykosteroidy są silnymi lekami przeciwzapalnymi, często stosowanymi w leczeniu ME. Mają one wiele mechanizmów działania, w tym stabilizację bariery krew-siatkówka i hamowanie mediatorów prozapalnych. Sposoby podawania obejmują podawanie miejscowe, iniekcje okołogałkowe, iniekcje dożylne oraz podawanie doustne i dożylne. Kortykosteroidy podawane doustnie i dożylnie z pewnością osiągają poziom terapeutyczny w ciele szklistym, jednak narażają pacjentów na dodatkowe ryzyko powikłań ogólnoustrojowych i dlatego są zwykle zarezerwowane dla pacjentów z zagrażającym wzrokowi zapaleniem błony naczyniowej w przebiegu choroby ogólnoustrojowej. Miejscowe krople kortykosteroidowe znajdują się na drugim końcu spektrum bezpieczeństwa, ale ich zdolność do dotarcia do tylnego odcinka jest ograniczona.
Wstrzyknięcia podtorebkowe stanowią alternatywę dla dostarczania stosunkowo dużych dawek kortykosteroidów do oka przy mniejszym ryzyku powikłań ogólnoustrojowych.21 Chociaż nie przeprowadzono randomizowanych, kontrolowanych badań, wstrzyknięcia podtorebkowe kortykosteroidów są od wielu lat skutecznie stosowane w leczeniu obrzęku plamki. Najczęściej stosuje się krótką 25-ga. igłę wprowadzaną przez spojówkę nadtwardówkową do przestrzeni podtwardówkowej, podczas gdy pacjent patrzy w kierunku dolnym. Igła jest przesuwana ku tyłowi wzdłuż globusa, wykonując ruch wymiatający na boki, aby zapobiec przypadkowej penetracji globusa, aż do momentu, gdy piasta osiągnie miejsce wejścia do spojówki, gdzie podawany jest lek. Jeden z raportów obejmował 20 kolejnych pacjentów z pośrednim zapaleniem błony naczyniowej związanym z utratą wzroku, którzy byli leczeni podtorebkowym wstrzyknięciem 40 mg acetonidu triamcynolonu.22 Chociaż nie wszyscy pacjenci wykazali ME na FA, 67 procent poprawiło się o dwie linie widzenia po jednym leczeniu. Ryzyko związane z tą procedurą obejmuje między innymi utrzymujące się podwyższone ciśnienie wewnątrzgałkowe, zaćmę, ptozę i penetrację wewnątrzgałkową.
Ostatnio wzrosło zastosowanie dożylnego wstrzykiwania acetonidu triamcynolonu (Kenalog, 4,0 mg) ze względu na jego silną zdolność do łagodzenia opornego na leczenie ME wtórnego do cukrzycy (patrz rycina 4), okluzji żył siatkówki, zapalenia i innych idiopatycznych przyczyn.23-26 Wstępne badania wykazują znaczną redukcję zgrubienia siatkówki, zmniejszenie przecieku fluoresceiny i poprawę widzenia, która może być wyraźna u niektórych pacjentów. Chociaż efekt jest przejściowy i zwykle utrzymuje się przez trzy do sześciu miesięcy lub krócej, ME zwykle reaguje na ponowne wstrzyknięcie. Stosowanie kortykosteroidów dożylnych wiąże się z 30-40-procentowym ryzykiem utrzymywania się podwyższonego ciśnienia wewnątrzgałkowego i około 10-procentowym ryzykiem wystąpienia zaćmy wymagającej operacji. Narodowy Instytut Oka prowadzi obecnie rekrutację pacjentów do badania SCORE (Standard Care vs. Corticosteroid for Retinal Vein Occlusion), w którym porównuje się dożylne wstrzyknięcia triamcynolonu (dawki 1 i 4 mg) ze standardowym leczeniem (obserwacja i/lub leczenie laserem siatkówki) u pacjentów z ME wtórnym do okluzji żyły. W badaniu weźmie udział łącznie 1260 pacjentów, a leczenie będzie kontynuowane przez 36 miesięcy.
ME występuje również w przypadku zwyrodnienia plamki związanego z wiekiem (patrz rysunek 5). Dożylne wstrzykiwanie acetonidu triamcynolonu jest obecnie badane pod kątem łącznego stosowania z terapią fotodynamiczną w leczeniu neowaskularnego AMD (Visudyne with intravitreal Triamcinolone Acetonide, VisTA). W jednym z badań podkreślono znaczenie dożylnego podania triamcynolonu przed zastosowaniem PDT u chorych z obrzękiem plamki i CNV.27 Autorzy teoretyzują, że werteporfina może przedostawać się do torbielowatych przestrzeni wewnątrzsiatkówkowych, co po fotoaktywacji leku może prowadzić do uszkodzenia fotoreceptorów w sąsiedniej, prawidłowej siatkówce, natomiast wcześniejsze ustąpienie obrzęku siatkówki może zapobiec temu powikłaniu. Wstępne podanie kortykosteroidu może również służyć do stłumienia wywołanego przez PDT wzrostu wewnątrzgałkowego stężenia VEGF.
Wstrzyknięcia doszklistkowe same w sobie wiążą się z niewielkim, ale pewnym ryzykiem poważnych, potencjalnie oślepiających działań niepożądanych, w tym zakaźnego zapalenia wewnątrzgałkowego, odwarstwienia siatkówki, krwotoku, nadciśnienia ocznego, zaćmy i hipotonii.28 Ostatnio opublikowane wytyczne dotyczące wstrzyknięć doszklistkowych są próbą ustalenia najlepszych praktyk w tej coraz częściej stosowanej technice. Zalecenia panelu konsensusu dotyczyły kwestii przed iniekcją, w tym antybiotyków, oceny jaskry, stosowania rękawiczek i leczenia istniejących wcześniej nieprawidłowości powiek, a także znaczenia unikania nadmiernej manipulacji powiekami przed i w trakcie zabiegu. Zalecany schemat postępowania okołoinwazyjnego obejmował stosowanie miejscowego i/lub podspojówkowego znieczulenia, miejscowej powidonowej jodyny oraz wziernika powiekowego. Autorzy podkreślili znaczenie monitorowania IOP i bezpośredniej wizualizacji dna oka po iniekcji w celu weryfikacji perfuzji nerwu wzrokowego, wewnątrzgałkowej lokalizacji triamcynolonu i braku krwotoku związanego z iniekcją lub odwarstwienia siatkówki. Podkreślili również znaczenie edukacji pacjentów w zakresie wczesnych objawów potencjalnych powikłań i dokładnej obserwacji.29
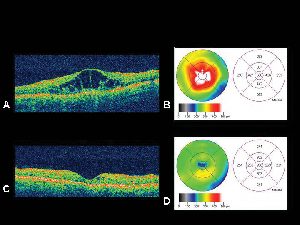
Ryc. 4. A. Obraz optycznej koherentnej tomografii oka z cukrzycowym obrzękiem plamki z odpowiadającą mu mapą grubości siatkówkiB. wygenerowaną przez OCT. C. OCT tego samego pacjenta miesiąc po dożylnym podaniu acetonidu triamcynolonu z odpowiadającą mu mapą grubości siatkówki. D. Ustąpienie obrzęku plamki. Ostrość wzroku poprawiła się z 20/200 do 20/80 po leczeniu.
Wiele badań bada alternatywne urządzenia do długoterminowego podawania kortykosteroidów do stosowania wewnątrz oka. Jedno z badań obejmuje chirurgiczne umieszczenie peletki acetonidu fluocinolonu osadzonej na plastikowym pręcie z kontrolowanym uwalnianiem steroidów przez trzy lata. Znany jako implant wewnątrzgałkowy Envision, firmy Bausch & Lomb i Control Delivery Systems, jest on umieszczany przez pars plana i przyszyty do twardówki. W badaniu II/III fazy z randomizacją i maską porównano implant Envision TD u 80 pacjentów randomizowanych do podawania 0,5 vs. 2,0-mg acetonidu fluocinolonu vs. standardowe leczenie polegające na fotokoagulacji laserowej lub obserwacji. Po sześciu miesiącach zaobserwowano statystycznie istotne zmniejszenie ME i ciężkości retinopatii cukrzycowej w przypadku implantu 0,5-mg w porównaniu ze standardową opieką. Ponadto nie stwierdzono różnic w częstości występowania poważnych działań niepożądanych. Badanie w ramieniu 2,0 mg zostało wcześnie przerwane z powodu wyników zaobserwowanych w drugim badaniu, w którym nie stwierdzono przewagi nad dawką 0,5 mg. W drugim badaniu wzięło udział 278 pacjentów z nieinfekcyjnym zapaleniem tylnej części błony naczyniowej, randomizowanych do otrzymania implantu Retisert 0,59 mg lub 2,1 mg w chore oko lub, w przypadkach obustronnych, w oko bardziej dotknięte chorobą. Po dwóch dawkach i 34 tygodniach stwierdzono istotnie niższy odsetek nawrotów w oczach z implantem (10 vs. 55,7 procent, p<0,0001), przy jednoczesnym zmniejszeniu stosowania kortykosteroidów systemowych/leczenia immunosupresyjnego (59,0 procent na początku vs. 13,7 procent w 34 tygodniu), jak również stosowania steroidów pod-Tenonowych i miejscowych. Stwierdzono istotną poprawę ostrości wzroku (p<0,05). Najczęstsze działania niepożądane obejmowały progresję zaćmy i wzrost ciśnienia wewnątrzgałkowego, które wymagało zabiegu filtracyjnego u 8,6 procent. (Jaffe G. Invest Ophthalmol Vis Sci. 2004; 44 ARVO E-Abstract #3369.)
Inne badanie obejmuje Posurdex firmy Allergan, bioerodowalną pastylkę deksametazonu wstrzykiwaną do przestrzeni szklistej, która uwalnia lek przez 50 do 160 dni. Wyniki badania II fazy wykazały, że zarówno peletka 350 µg, jak i 700 µg znacząco poprawiły odsetek pacjentów z poprawą widzenia o dwie linie lub więcej (27,2 procent i 35,7 procent, odpowiednio dla dawek 350 µg i 700 µg), jak również z poprawą widzenia o trzy linie lub więcej (13 procent i 19,4 procent, odpowiednio dla dawek 350 µg i 700 µg) po 180 dniach w porównaniu z placebo. Jak dotąd nie odnotowano zwiększonej częstości występowania zaćmy, chociaż wzrost ciśnienia wewnątrzgałkowego zaobserwowano u około 15 procent pacjentów.
Terapie – laser
Ostatnio Macugen firmy Eyetech i Pfizer był badany w randomizowanym, podwójnie zamaskowanym, wieloośrodkowym, zróżnicowanym pod względem dawki, kontrolowanym badaniu II fazy z udziałem 172 pacjentów z cukrzycowym ME. W badaniu analizowano trzy dawki (0,3 mg, 1,0 mg, 3,0 mg) w porównaniu do wstrzyknięć pozorowanych, podawanych co sześć tygodni przez trzy wstrzyknięcia. Podczas gdy przed zastosowaniem lasera ogniskowego/siatkowego badacze zostali poproszeni o zapisanie do badania tylko tych pacjentów, u których czuli się komfortowo odraczając laser ogniskowy/siatkowy na co najmniej 12 tygodni. Dodatkowe iniekcje i/lub fotokoagulacja ogniskowa/siatkowa były podawane według uznania badacza od 18 do 30 tygodnia. Ocenę końcową przeprowadzono w tygodniu 36, sześć tygodni po ostatnim planowanym wstrzyknięciu. Ogólnie rzecz biorąc, pacjenci, którym podawano preparat Macugen, mieli lepsze wyniki w zakresie widzenia, częściej wykazywali zmniejszenie centralnej grubości siatkówki i rzadziej wymagali dodatkowej laseroterapii w porównaniu z pacjentami, u których nie stosowano preparatu Macugen.31 Obecnie planowane jest przeprowadzenie potwierdzającego badania III fazy.
Ogniskowa/siatkowa fotokoagulacja laserowa pozostaje standardem postępowania w leczeniu cukrzycowego ME. W badaniu Early Treatment Diabetic Retinopathy Study wykazano, że pacjenci leczeni laserem siatkowym mieli 50-procentową redukcję umiarkowanej utraty wzroku, definiowanej jako podwojenie kąta widzenia lub zmniejszenie widzenia o trzy linie, w porównaniu z obserwacją.30 Chociaż dokładny mechanizm, za pomocą którego laser zmniejsza ME, nie jest znany, uważa się, że promuje on tworzenie ścisłych połączeń między komórkami RPE, a także zmniejsza zapotrzebowanie fotoreceptorów na tlen i zwiększa perfuzję tlenu z naczyniówki.31 W badaniu EDTRS zidentyfikowano pacjentów kwalifikujących się do ogniskowej fotokoagulacji laserowej jako osoby z klinicznie istotnym ME. Definiowano to jako spełnienie jednego z trzech następujących kryteriów: 1) zgrubienie siatkówki zlokalizowane w odległości 500 µm od fovea; 2) twarde wysięki w odległości mniejszej niż 500 µm od fovea związane z przyległym zgrubieniem siatkówki; lub 3) obszar obrzęku o średnicy 1 dysku lub większej, którego dowolna część znajduje się w odległości mniejszej niż 1 średnica dysku od fovea. EDTRS nie rozróżnia jednak pomiędzy ME ogniskowym, który odpowiada miejscowemu zgrubieniu siatkówki przylegającemu do mikrotętniaków, a ME rozsianym, który odnosi się do uogólnionego zgrubienia tylnego bieguna. Anegdotyczne dowody wskazują, że ogniskowe cukrzycowe ME dobrze reaguje na laser ogniskowy/siatkówkowy, natomiast odmiana rozproszona częściej nie poddaje się leczeniu laserowemu i wymaga alternatywnego postępowania.
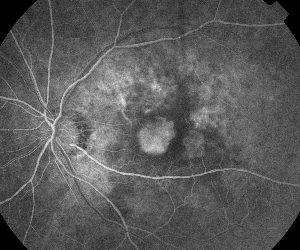 |
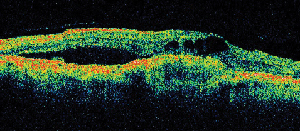 |
| Ryc. 5. A. Wczesny angiogram fluoresceinowy ukazujący klasyczną neowaskularyzację podtwardówkową. | B. Odpowiednia optyczna koherentna tomografia ujawnia obszary gromadzenia się płynu podsiatkówkowego i śródsiatkówkowego oraz neowaskularyzację (strzałka). |
Leczenie -operacja
Pierwsza grupa, która przedstawiła korzyści z witrektomii i oddzielenia tylnej hialoidy u pacjentów z cukrzycowym ME, zasugerowała, że istnieje podgrupa pacjentów, u których trakcja ciała szklistego i płytkie odwarstwienia plamki przyczyniają się do pogrubienia siatkówki.32. Potwierdzono to później za pomocą OCT, co doprowadziło do udoskonalenia wskazań do tej techniki.33,34 W trzech największych seriach35,36,37 pacjentów poddanych witrektomii z powodu cukrzycowego ME niereagującego na mniej inwazyjne metody leczenia przeanalizowano odpowiednio 59, 58 i 65 pacjentów. Zgłaszali oni odpowiednio 47 procent, 53 procent i 45 procent pacjentów, u których nastąpiła poprawa widzenia o dwie linie lub więcej. Ostatni z nich zgłosił poważne powikłania pooperacyjne rozwinięte u mniejszości pacjentów, w tym odwarstwienie siatkówki (1,5 procent), rubeosis iridis (4,6 procent), błona nasiatkówkowa (13,8 procent), nawracający krwotok do ciała szklistego (1,5 procent) i twarde depozyty wysiękowe (4,6 procent), podczas gdy powikłania ujawnione w drugiej grupie obejmowały błony nasiatkówkowe w 10,2 procent i zaćmę w 63,2 procentach oczu phakic. Kilka innych serii przypadków wykazało podobne wyniki, jednak wszystkie były nierandomizowane, bez kontroli placebo i przy użyciu różnych kryteriów włączenia i wyłączenia. Co więcej, techniki chirurgiczne również się różniły, pozostawiając dokładne wskazania do witrektomii u pacjentów z CME otwarte na interpretację.
ME pozostaje główną przyczyną utraty wzroku pomimo różnorodności dostępnych metod leczenia. Fotokoagulacja laserowa pozostaje integralną częścią postępowania w ME spowodowanym cukrzycą, niedokrwieniem i okluzją naczyniową. Miejscowe NLPZ i kortykosteroidy są obecnie podstawową metodą kontroli pooperacyjnego ME, podczas gdy acetazolamid pozostaje skuteczną metodą leczenia u wybranych pacjentów z ME wtórnym do zapalenia błony naczyniowej i retinitis pigmentosa. Rola dożylnych glikokortykosteroidów w terapii ME rozszerza się, ale pozostaje ograniczona przez działania niepożądane i czas trwania efektu. Udoskonalenia w technikach chirurgicznych będą nadal nadawać nowy wymiar ME nie reagując na mniej inwazyjne leczenie, podczas gdy postępy w farmakoterapii i dostarczaniu leków do oka obiecują odegrać rolę w zapobieganiu i zarządzaniu wszystkimi przyczynami i typami ME.
Dr Ober jest pracownikiem chirurgii witreoretinalnej w Edward S. Harkness Eye Institute w Columbia University College of Physicians and Surgeons oraz w LuEsther T. Mertz Retinal Research Center w Manhattan Eye, Ear, and Throat Hospital. Kontakt z nim: 210 East 64th St., 8th Fl, New York, NY 10021; e-mail: [email protected]; lub (212) 605 3777 lub faks (212) 605 3795.
Dr Klais jest stypendystą w dziedzinie siatkówki w LuEsther T. Mertz Retinal Research Center. LuEsther T. Mertz Retinal Research Center. Skontaktuj się z nią pod tym samym adresem, numerem telefonu lub faksu, lub przez e-mail: [email protected].
Dr Cunningham jest profesorem klinicznym okulistyki i dyrektorem Uveitis Service na New York University, School of Medicine. Jest również pracownikiem Eyetech Pharmaceuticals Inc.Skontaktuj się z nim w Vitreous-Retina-Macula Consultants of New York, 460 Park Ave., New York, N.Y. 10022, przez e-mail [email protected], lub telefonicznie/faksem pod numerem (212) 861 9797.
1. Spaide RF, Yannuzzi LA, Sisco LJ. Chronic cystoid macular edema and predictors of visual acuity. Ophthalmic Surg 1993;24:262-267.
2. Yannuzzi LA. A perspective on the treatment of aphakic cystoid macular edema. Surv Ophthalmol 1984;28:540-553
3. Chang A, Spaide RF, Yannuzzi LA. Post-surgical cystoid macular edema. In: Guyer DR, Yannuzzi LA, Chang S, et al. Retina, Vitreous, Macula. Saunders. Philadelphia. 1999;1:239-255.
4. Nussenblatt RB, Kaufman SC, Palestine AG, et al. Macular thickening and visual acuity. Measurement in patients with cystoid macular edema. Ophthalmology 1987;94:1134-9.
5. Markomichelakis NN, Halkiadakis I, Pantelia E, et al. Patterns of macular edema in patients with uveitis: qualitative and quantitative assessment using optical coherence tomography. Ophthalmology 2004;111:946-53.
6. Antcliff RJ, Stanford MR, Chauhan DS, et al. Comparison between optical coherence tomography and fundus fluorescein angiography for the detection of cystoid macular edema in patients with uveitis. Ophthalmology 2000; 107:593-9.
7. Otani T, Kishi S, Maruyama Y. Patterns of diabetic macular edema with optical coherence tomography. Am J Ophthalmol 1999;127:688-93.
8. Hee MR, Puliafito CA, Wong C, et al. Quantitative assessment of macular edema with optical coherence tomography. Arch Ophthalmol 1995;113:1019-29.
9. Nussenblatt RB, Kaufman SC, Palestine AG, et al. Macular thickening and visual acuity. Measurement in patients with cystoid macular edema. Ophthalmology 1987;94:1134-9.
10. Ozdek SC, Erdinc MA, Gurelik G, et al. Optical coherence tomographic assessment of diabetic macular edema: comparison with fluorescein angiographic and clinical findings. Ophthalmologica 2005;219:86-92.
11. Browning DJ, Fraser CM. Optical coherence tomography to detect macular edema in the presence of asteroid hyalosis. Am J Ophthalmol 2004;137:959-961.
12. Polito A, Shah SM, Haller JA et al. Comparison between retinal thickness analyzer and optical coherence tomography for assessment of foveal thickness in eyes with macular disease. Am J Ophthalmol 2002;134:240-51.
13. Neubauer AS, Priglinger S, Ullrich S, et al. Comparison of foveal thickness measured with the retinal thickness analyzer and optical coherence tomography. Retina 2001;21:596-601.
14. Pires I, Bernardes RC, Lobo CL, Soares MA, Cunha-Vaz JG. Retinal thickness in eyes with mild nonproliferative retinopathy in patients with type 2 diabetes mellitus: comparison of measurements obtained by retinal thickness analysis and optical coherence tomography. Arch Ophthalmol 2002 Oct;120(10):1301-6.
15. Flach AJ. Inhibitory cyklo-oksygenazy w okulistyce. Surv Ophthalmol 1992;36:259-284.
16. Heier JS, Topping TM, Baumann W, Dirks MS, Chern S. Ketorolac versus prednisolone versus combination therapy in the treatment of acute pseudophakic cystoid macular edema. Ophthalmology 2000;107:2034-8.
17. Cox SN, Hay E, Bird AC. Treatment of chronic macular edema with acetazolamide. Arch Ophthalmol 1988;106:1190-5.
18. Fishman GA, Gilbert LD, Fiscella RG, Kimura AE, Jampol LM. Acetazolamide for treatment of chronic macular edema in retinitis pigmentosa. Arch Ophthalmol 1989;107:1445-52.
19. Farber MD, Lam S, Tessler HH, Jennings TJ, Cross A, Rusin MM. Reduction of macular oedema by acetazolamide in patients with chronic iridocyclitis: a randomised prospective crossover study. Br J Ophthalmol 1994;78:4-7.
20. Giusti C, Forte R, Vingolo EM, Gargiulo P. Is acetazolamide effective in the treatment of diabetic macular edema? A pilot study. Int Ophthalmol 2001;24:79-88.
21. Jennings T, Rusin MM, Tessler HH, Cunha-Vaz JG. Posterior sub-Tenon’s injections of corticosteroids in uveitis patients with cystoid macular edema. Jpn J Ophthalmol 1988;32:385-91.
22. Helm CJ, Holland GN. The effects of posterior subtenon injection of triamcinolone acetonide in patients with intermediate uveitis. Am J Ophthalmol 1995;120:55-64.
23. Benhamou N, Massin P, Haouchine B, Audren F, et al. Intravitreal triamcinolone for refractory pseudophakic macular edema. Am J Ophthalmol 2003;135:246-9.
24. Jonas JB, Kreissig I, Degenring RF. Intravitreal triamcinolone acetonide as treatment of macular edema in central retinal vein occlusion. Graefes Arch Clin Exp Ophthalmol. 2002;240:782-3.
25. 25. Martidis A, Duker JS, Greenberg PB, Rogers AH, et al. Intravitreal triamcinolone for refractory diabetic macular edema. Ophthalmology 2002; 109: 920-7.
26. 26. Scott IU, Flynn HW Jr, Rosenfeld PJ. Intravitreal triamcinolone acetonide for idiopathic cystoid macular edema. Am J Ophthalmol 2003;136:737-9.
27. 27. Freund KB, Klais CM, Eandi CM, et al. Sequenced Combined Intravitreal Triamcinolone and Indocyanine Green Angiography Guided Photodynamic Therapy for Retinal Angiomatous Proliferation. Arch Ophthalmol, In Press.
28. 28. Jager RD, Aiello LP, Patel SC, Cunningham ET Jr. Risks of intravitreal injection: a comprehensive review. Retina. 2004 Oct;24(5):676-98.
29. 29. Aiello LP, Brucker AJ, Chang S, et al. Evolving guidelines for intravitreal injections. Retina 2004 Oct;24(5 Suppl):S3-19.
30. .G.Jaffe, Fluocinolone Acetonide Uveitis Study Group. Fluocinolone Acetonide Intravitreal Implant for Uveitis Affecting the Posterior Segment of the Eye. ARVO 2004, poster #3369.
31. Grupa badająca retinopatię cukrzycową Macugen. A phase II randomized, double-masked trial of pegaptanib, an anti-vascular endothelial growth factor aptamer, for diabetic macular edema. Ophthalmology, In press.
32. 30. Fotokoagulacja w przypadku cukrzycowego obrzęku plamki. Early Treatment Diabetic Retinopathy Study report number 1. Arch Ophthalmol 1985;103:1796-806.
33. Christoforidis JB, D’Amico DJ. Surgical and other treatments of diabetic macular edema: an update. Int Ophthalmol Clin 2004;44:139-60.
34. Lewis H, Abrams GW, Blumenkranz MS, Campo RV. Vitrectomy for diabetic macular traction and edema associated with posterior hyaloidal traction. Ophthalmology 1992;99:753-9.
35. Kaiser PK, Riemann CD, Sears JE, Lewis H. Macular traction detachment and diabetic macular edema associated with posterior hyaloidal traction. Am J Ophthalmol 2001;131:44-9.
36. Lewis H. The role of vitrectomy in the treatment of diabetic macular edema. Am J Ophthalmol 2001;131:123-5.
37. Pendergast SD. Vitrectomy for diabetic macular edema associated with a taut premacular posterior hyaloid. Curr Opin Ophthalmol 1998;9:71-5.
38. Tachi N, Ogino N. Vitrectomy for diffuse macular edema in cases of diabetic retinopathy. Am J Ophthalmol 1996;122:258-60.
39. Yamamoto T, Hitani K, Tsukahara I, Yamamoto S, et al. Early postoperative retinal thickness changes and complications after vitrectomy for diabetic macular edema. Am J Ophthalmol 2003;135:14-9.
.