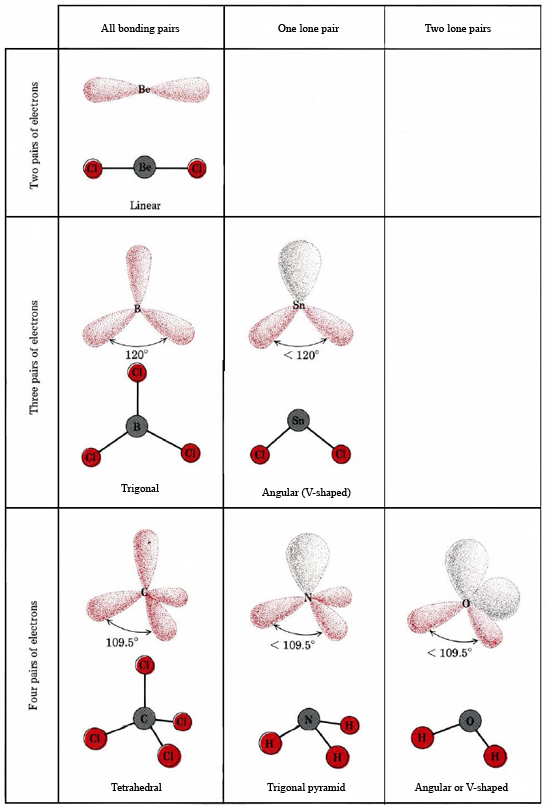
A teoria VSEPR é capaz de explicar e prever as formas das moléculas que contêm pares solitários. Neste caso os pares solitários, bem como os pares de ligação, são considerados como repelindo e evitando um ao outro. Por exemplo, como existem duas ligações na molécula SnCl2, pode-se esperar que ela seja linear como BeCl2. Se desenharmos o diagrama de Lewis, no entanto, encontramos um par solitário assim como dois pares de ligação na casca de valência do átomo de Sn:
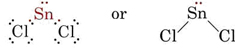_Chloride.jpg?revision=1&size=bestfit&width=235&height=48)
Um par solitário também afecta a estrutura do amoníaco, NH3. Como esta molécula obedece à regra do octeto, o átomo N é rodeado por quatro pares de electrões:
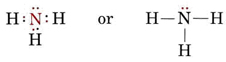
Se estes pares fossem todos equivalentes, esperaríamos que o ângulo entre eles fosse o ângulo tetraédrico regular de 109,5°. Experimentalmente, o ângulo é encontrado para ele um pouco menos, a saber, 107°. Novamente isto é porque o par solitário é “mais gordo” que os pares de ligação e capaz de apertá-los mais juntos.
A estrutura eletrônica da molécula H2O é semelhante à de NH3 exceto que um par de ligação foi substituído por um par solitário:
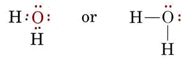
Exemplo \PageIndex{1}} : Geometria Molecular
Esboçar e descrever a geometria das seguintes moléculas: (a) GaCl3, (b) AsCl3, e (c) AsOCl3.
Solução
a) Como o elemento gálio pertence ao grupo III, ele tem três valências elétricas. O diagrama de Lewis para GaCl3 é assim
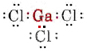
Desde que existem três pares de ligação e nenhum par solitário em torno do átomo de Ga, concluímos que os três átomos de Cl estão dispostos trigonalmente e que os quatro átomos estão no mesmo plano.
b) O arsénico pertence ao grupo V e portanto tem cinco electrões de valência. A estrutura de Lewis para AsCl3 é assim
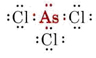
Desde que um par solitário esteja presente, a forma desta molécula é uma pirâmide trigonal, com o núcleo As um pouco acima de um triângulo equilátero de núcleos de Cl.
c) O diagrama de Lewis para AsOCl3 é semelhante ao de AsCl3.

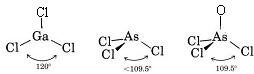
A teoria VSEPR também pode ser aplicada a moléculas que contêm cinco e seis pares de elétrons de valência, alguns dos quais são pares solitários. Não incluímos tais espécies aqui porque a maioria dos compostos se enquadram nas categorias que descrevemos.
Contribuidores
-
Ed Vitz (Universidade de Kutztown), John W. Moore (UW-Madison), Justin Shorb (Faculdade da Esperança), Xavier Prat-Resina (Universidade de Minnesota Rochester), Tim Wendorff, e Adam Hahn.