O elemento químico cloro é classificado como halogéneo e um não metálico. Foi descoberto em 1774 por Carl Wilhelm Scheele.

Zona de dados
| Classificação: | Cloro é um halogéneo e um não-metal | |
| Cor: | Amarelo esverdeado | |
| Peso atómico: | 35.453 | |
| Estado: | Gás: | |
| Ponto de fusão: | -101 oC , 172 K | |
| Ponto de enchimento: | -34 oC , 239 K | |
| Electrões: | 17 | |
| Protões: | 17 | |
| Neutrons no isótopo mais abundante: | 18 | |
| Neutrons no isótopo mais abundante: | Electrões: | 2,8,7 |
| Configuração electrónica: | 1s2 2s2 2p6 3s2 3p5 | |
| Densidade @ 20oC: | 0.003214 g/cm3 |
Mostrar mais, incluindo: Aquecimento, energias, oxidação, reações,
Compostos, raios, condutividades
| Volume atômico: | 22,7 cm3/mol |
| Estrutura: | Camadas de Cl2 em sólido |
| Dureza: | |
| Capacidade térmica específica | 0,48 J g-1 K-1 |
| Calor de fusão | 6.406 kJ mol-1 de Cl2 |
| Calor de atomização | 122 kJ mol-1 |
| Calor de vaporização | 20.41 kJ mol-1 de Cl2 |
| 1ª energia de ionização | 1251,1 kJ mol-1 |
| 2ª energia de ionização | 2297.3 kJ mol-1 |
| 3ª energia de ionização | 3821.8 kJ mol-1 |
| Afinidade electrónica | 349 kJ mol-1 |
| Número mínimo de oxidação | -1 |
| Mín. oxidação comum no. | -1 |
| Número máximo de oxidação | 7 |
| Número máximo de oxidação comum. | 7 |
| Electronegatividade (Escala de Paulagem) | 3.16 |
| Volume de polarização | 2.2 Å3 |
| Reacção com ar | nenhum |
| Reacção com 15 M HNO3 | suave, ⇒ HClOx, NOxCl, NOx |
| Reacção com 6 M HCl | suave, ⇒ HOCl, Cl- |
| Reacção com NaOH 6 M | suave, ⇒ OCl-, Cl- |
| Óxido(s) | Cl2O, ClO2, Cl2O7 |
| Hidreto(s) | HCl |
| Cloreto(s) | Cl2 |
| Raio atómico | 100 pm |
| Iónico raio (1+ião) | – |
| Raio iónico (2+ião) | – |
| Raio iónico (3+ião) | – |
| Raio iónico (1- ião) | 167 pm |
| Raio iónico (2-ião) | – |
| Raio iónico (3-ião) | – |
| Condutividade térmica | 0.0089 W m-1 K-1 |
| Condutividade eléctrica | – |
| Ponto de congelação/congelação: | -101 oC , 172 K |

Cloro em tubo de ensaio (Foto: Ben Mills)
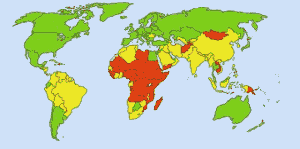
Água potável segura: Imagem: Ionut_Cojocaru. Em áreas verdes, todos podem obter água segura. Nas áreas vermelhas, pelo menos 25% das pessoas não podem obter água tratada. As áreas amarelas são intermediárias. Antes do uso rotineiro de cloro no abastecimento de água dos EUA, a febre tifóide provocava 25.000 mortes por ano. Hoje 98% das reservas públicas de água são tratadas com cloro ou um composto de cloro. A febre tifóide agora alega cerca de uma vítima por ano, em média. (4)

Carl Wilhelm Scheele, que descobriu cloro em 1774.
Descoberta de Cloro
Cloro foi produzido pela primeira vez em 1774 por Carl Wilhelm Scheele na Suécia. Scheele coletou o gás liberado pela reação de pirolusite com spiritus salis – um termo alquímico que significa espírito/respiro de sal. O novo gás tinha, segundo Scheele, “um cheiro sufocante muito perceptível, que era mais opressivo para os pulmões… e dá à água um sabor ligeiramente ácido… o ar nela contido adquire uma cor amarela…”. (1)
Scheele também notou a alta reatividade e as qualidades de clareamento do novo gás que ele tinha feito: “…todos os metais foram atacados… o álcali fixo foi convertido em sal comum… todas as flores vegetais – vermelho, azul e amarelo – ficaram brancas em pouco tempo; o mesmo aconteceu com as plantas verdes… os insectos morreram imediatamente. (1)
Apesar da precisão das suas observações, Scheele pensou erroneamente que o novo gás era uma forma deshlostiganada de ácido muriático.
O famoso químico francês Antoine Lavoisier acreditava que o novo gás deveria ser chamado ácido oxymuriatico baseado no elemento murium ainda não descoberto. (2)
* A confusão sobre a verdadeira identidade do cloro foi causada pela teoria do clogistão; o clogistão tinha sido aceite pelos químicos durante a maior parte do século XVII – até que o próprio Lavoisier o desmascarou. O clogistão era uma ‘substância’ usada para explicar o então inexplicável. Convenientemente, ele tinha peso negativo quando necessário, e ‘explicava’ reações como ferrugem e queimadura.
Lavoisier foi o arquiteto da queda do phlogiston, mostrando que a química do oxigênio era uma melhor explicação nas reações químicas do que o phlogiston era. (3)
Em 1810 o consenso científico era que o elemento que agora chamamos cloro era na verdade um composto que continha oxigênio. O químico inglês Sir Humphry Davy descobriu que o consenso estava errado; ele não conseguia que o novo gás verde-amarelado reagisse com um eletrodo de carvão, o que o fez acreditar que ele poderia não conter oxigênio. Nas reações com fósforo e amônia, ele demonstrou que o novo gás não continha oxigênio. Ele usou uma enorme pilha de 2000 placas voltaicas para ver se ele poderia extrair oxigênio do fósforo e compostos de enxofre do gás, mas novamente ele não encontrou oxigênio. (1a)
Em 1811, Davy concluiu que o novo gás era de fato um novo elemento. (1b) Ele o chamou de cloro, da palavra grega ‘chloros’, que significa verde-pálido ou verde-amarelado.
Fatos interessantes sobre o cloro
- A primeira reação em cadeia descoberta não foi uma reação nuclear; foi uma reação química em cadeia. Ela foi descoberta em 1913 por Max Bodenstein, que viu uma mistura de cloro e gases de hidrogênio explodir quando acionada pela luz. O mecanismo da reação em cadeia foi totalmente explicado em 1918 por Walther Nernst.
- Os oceanos da Terra contêm uma grande quantidade de cloro. Se este cloro fosse liberado como um gás, seu peso seria 5x maior do que a atmosfera de corrente total da Terra. (Nossos oceanos contêm cerca de 2,6 x 1016 toneladas métricas de cloro, principalmente como cloreto de sódio.)
- Cloro não é apenas abundante em nossos oceanos; é o sexto elemento mais abundante na crosta terrestre.
- Exposição a pequenas quantidades de cloro, mesmo por um curto período de tempo, pode ser mortal. São esperadas fatalidades em 1 parte em mil cloro no ar (ou às vezes em concentrações ainda mais baixas). (5)
- O cloro é mais pesado que o ar. Quando liberado, ele forma uma manta venenosa que deriva junto com o vento. O cloro foi usado como arma química na Primeira Guerra Mundial, primeiro em 1915 pelo exército alemão e depois pelos Aliados Ocidentais. Não era tão “eficaz” como se esperava, porque o cloro é facilmente detectado pelo seu forte cheiro. Também é solúvel em água, e assim os soldados podiam se proteger do pior de seus efeitos respirando através de panos úmidos.
Aspecto e Características
Efeitos nocivos:
O cloro é um gás tóxico que irrita a pele, os olhos e o sistema respiratório.
Características:
O cloro é um gás amarelo esverdeado, diatómico, denso e com um cheiro intenso (o cheiro a lixívia).
Não é encontrado livre na natureza, pois combina facilmente com quase todos os outros elementos.
O cloro ocorre na natureza principalmente como sal comum (NaCl), carnalite e silvite (KCl).
Na sua forma líquida e sólida é um poderoso agente branqueador, oxidante e desinfectante.
Usos do cloro
O cloro é usado para produzir água potável segura.
Os compostos clorados são usados principalmente para saneamento, branqueamento de polpa, desinfectantes, e processamento têxtil.
O cloro também é usado para a fabricação de cloratos e é importante na química orgânica, formando compostos como clorofórmio, tetracloreto de carbono, cloreto de polivinila e borracha sintética.
Outros usos dos compostos de cloro incluem corantes, produtos petrolíferos, medicamentos, anti-sépticos, inseticidas, alimentos, solventes, tintas e plásticos.
Abundância e isótopos
Abundância da crosta terrestre: 145 partes por milhão em peso, 85 partes por milhão por moles
Abundância do sistema solar: 8 partes por milhão em peso, 0,3 partes por milhão por moles
Custo, puro: $0,15 por 100g
Custo, a granel: $ por 100g
Fonte: O gás cloro é produzido comercialmente pela eletrólise do cloreto de sódio (NaCl) a partir da água do mar ou salmoura de minas de sal.
Isótopos: O cloro tem 16 isótopos cujas meias-vidas são conhecidas, com números de massa de 31 a 46. O cloro natural é uma mistura dos seus dois isótopos estáveis 35Cl e 37Cl com abundâncias naturais de 75,8% e 24,3% respectivamente.

- Henry M. Leicester, Herbert S. Klickstein, A Source Book in Chemistry, 1400-1900., (1969) Harvard University Press. p111; 1a. p241.; 1b. p257.
- J.W. Mellor, A Comprehensive Treatise on Inorganic and Theoretical Chemistry., 1922, vol 2, Longmans, Green and Co., p21.
- Antoine Lavoisier, Memoires de l’ Academie royale des sciences 1783., 1786, p505-538.
- The Chlorine Tree.
- OSHA, Occupational Safety and Health Guideline for Chlorine.
Cite esta página
Para criar um link online, por favor copie e cole um dos seguintes:
<a href="https://www.chemicool.com/elements/chlorine.html">Chlorine</a>
>ou
<a href="https://www.chemicool.com/elements/chlorine.html">Chlorine Element Facts</a>
Para citar esta página num documento académico, por favor use a seguinte citação compatível com MLA:
"Chlorine." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/chlorine.html>.