Antibióticos erradicam infecções patogénicas e salvam vidas – mas ao fazê-lo, também perturbam a integridade do microbioma intestinal. Enquanto muitos médicos reconhecem a necessidade de restaurar o equilíbrio microbiano de um paciente após um curso de terapia antibiótica, muito menos entendem como fazer isso efetivamente.
De acordo com Amie Skilton, ND, restauração da flora intestinal é tanto arte quanto ciência. Feito bem, pode fazer um mundo de diferença para os pacientes. Em alguns casos, pode até ajudar os pacientes a superar as doenças para as quais os antibióticos foram inicialmente prescritos.
Mas é preciso mais do que apenas recomendar um probiótico de prateleira e esperar o melhor.
Os Centros de Controle de Doenças relataram na última primavera que, dos 154 milhões de prescrições de antibióticos escritas em consultórios médicos e departamentos de emergência a cada ano, 30% são desnecessárias. A maior parte das prescrições externas, o CDC descobriu, foram feitas para doenças respiratórias causadas por vírus como resfriados comuns, dores de garganta virais, bronquite, e infecções sinusais e dos ouvidos, que não respondem aos antibióticos. O uso desses medicamentos “colocam os pacientes em risco desnecessário de reações alérgicas ou a diarréia às vezes mortal, Clostridium difficile”
Outra complicação é a realidade de que os antibióticos não são apenas dispersos dos consultórios médicos; eles também são alimentados liberalmente ao gado e pulverizados extensivamente nos produtos, deixando traços minúsculos mas biologicamente ativos nos alimentos que os seres humanos consomem em seguida.
Dose, Tempo Determinar Impacto
As antibióticos matam microorganismos causadores de infecções, também destroem não selectivamente comunidades de bactérias intestinais benéficas, enfraquecendo a estabilidade do microbioma intestinal. Esta destruição maciça pode ser maciça; dados experimentais coletados de um estudo usando qPCR indicam uma redução de até 10 vezes nos isolados bacterianos imediatamente após o tratamento com antibióticos (Panda, S. et al. PLoS One. 2014; 9(4): e95476).
“É realmente um efeito decimal”, diz o Dr. Skilton, médico naturopata e herborista da Elysium Clinic of Natural Medicine, Sydney, NSW, Austrália.
Em um webinar patrocinado pela Holistic Primary Care and Bioceuticals, ela delineou os inúmeros impactos dos antibióticos no microbioma humano, observando que nem todos os antibióticos são igualmente destrutivos para as bactérias intestinais.
O grau em que esses medicamentos danificam a microbiota intestinal depende do tipo de medicamento, duração do tratamento e freqüência de uso, disse Skilton. Alguns antibióticos, por exemplo, provocam uma maior liberação de endotoxinas e citocinas do que outros. Doses diárias mais altas são mais impactantes. O uso prolongado de altas doses de antibióticos pode causar danos extremos ao microbioma que podem levar anos de terapia reparadora para reverter, se é que pode ser revertida.
E ao contrário do que se pensa, os antibióticos intravenosos podem ter o mesmo impacto negativo na flora intestinal que os medicamentos orais. “Durante muito tempo pensou-se que as drogas intravenosas ultrapassariam o intestino e não teriam o mesmo impacto. Agora sabemos que isto não é verdade”
O momento da administração de antibióticos também faz a diferença. Os indivíduos que usam antibióticos frequentemente no início da vida são mais vulneráveis a muitos tipos de doença à medida que envelhecem. Em um trabalho publicado no início deste ano, pesquisadores demonstraram uma associação entre o uso de antibióticos durante a infância e os conseqüentes maus resultados neurocognitivos, sugerindo que o consumo de antibióticos no primeiro ano de vida de um paciente foi associado a pequenas mas estatisticamente significativas diferenças nas medidas cognitivas, comportamentais e de humor durante a infância (Slykerman, R. et al. Acta Paediatr. 2017; 106(1): 87-94).
Outros relacionaram a exposição fetal e a antibióticos na primeira infância com o desenvolvimento subsequente da asma mais tarde na vida (Örtqvist, A. et al. Brit Med J. 2014; 349. doi: https://doi.org/10.1136/bmj.g6979). Os antibióticos também têm sido associados com obesidade e ganho de peso em crianças e adultos (Million, M. et al. Clin Microbiol & Infec. 2013; 19(4): 305-313). Pesquisadores atribuem essas alterações à composição microbiana intestinal alterada.
Antibióticos podem desencadear a liberação de lipopolissacarídeos tóxicos (LPS), moléculas grandes encontradas nas membranas externas de bactérias Gram-negativas patogênicas. Alguns sugerem que a liberação de LPS induzida por antibióticos pode contribuir para o desenvolvimento de choque séptico em pacientes tratados por infecções graves causadas por bactérias Gram-negativas. Outros demonstraram que o LPS desencadeia uma resposta imunológica ao liberar citocinas inflamatórias, um problema que se agrava após o tratamento com antibióticos, observou Skilton em seu webinar (Wu, T. et al. Toxicol Lett. 2009; 191(2-3): 195-202).
Do ponto de vista de um patógeno, a produção de LPS é uma estratégia de sobrevivência. Estas moléculas interagem na superfície celular para formar uma barreira, impedindo a entrada dos antibióticos e outros compostos hidrofóbicos e permitindo que as bactérias Gram-negativas vivam mesmo em ambientes agressivos (Zhang, G. et al. Curr Opin Opinião Microbiol. 2013; 16(6): 779-785).
Como restaurar a flora
Probióticos são um aspecto de uma estratégia abrangente para restaurar a flora intestinal após a administração de antibióticos. Dada a diversidade microbiana de um ecossistema intestinal saudável, Skilton recomenda o uso de produtos que contenham muitas espécies diferentes de micróbios benéficos em vez de “monoculturas” com uma ou duas cepas únicas.
Como regra geral, ela aconselha um mês de tratamento probiótico para cada semana em que um paciente estava tomando antibióticos. Aqueles que estiveram em regime de antibióticos contínuos prolongados, também necessitarão de restauração a longo prazo. Ela destacou que para a maioria das pessoas não existem riscos de saúde associados à suplementação probiótica prolongada.
As pacientes que recebem antibióticos intravenosos também devem tomar probióticos comensais. Alguns clínicos que estão conscientes deste problema começarão a tomar os probióticos tão cedo quanto quatro horas após uma dose de antibióticos intravenosos.
Construção da Glicocalyx
Pessoas que estiveram em cursos de antibióticos a longo prazo ou em cursos múltiplos normalmente apresentam uma erosão severa da glicocalyx que normalmente reveste a microbilíase intestinal. Isto geralmente é acompanhado por uma perda das bordas do pincel e uma redução acentuada na produção de IgA secretora.
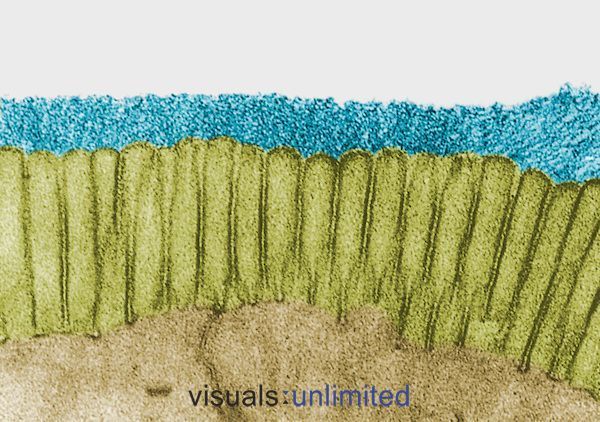 Em alguns casos, estas alterações são causadas pelos efeitos dos próprios antibióticos. Em outros, refletem o impacto da infecção para a qual os antibióticos foram prescritos. De qualquer forma, o efeito é o mesmo: estabelecimento de um microambiente que é hospitaleiro a patógenos oportunistas como Candida, mas cada vez mais difícil para bactérias comensal normais.
Em alguns casos, estas alterações são causadas pelos efeitos dos próprios antibióticos. Em outros, refletem o impacto da infecção para a qual os antibióticos foram prescritos. De qualquer forma, o efeito é o mesmo: estabelecimento de um microambiente que é hospitaleiro a patógenos oportunistas como Candida, mas cada vez mais difícil para bactérias comensal normais.
Infecções fúngicas são quase sempre acompanhadas de produção insuficiente de IgA, já que Candida consome tanto glicocalyx como sIgA como combustíveis. Torna-se um ciclo vicioso: baixa IgA gera a Candida, o que diminui ainda mais a IgA. Infecções crônicas do trato urinário, e infecções de mucosas como tordo são bandeiras vermelhas para baixa produção de sIgA, Skilton apontou.
Sem uma glicocalyx saudável, organismos como Lactobacilos e Bifidobacilos têm grande dificuldade em se estabelecer. Neste contexto, a suplementação com probióticos comuns normalmente falhará.
“Mesmo que você recomende os melhores probióticos do mundo, não há como eles colarem e colonizarem se a glicocalyx estiver erodida”, explicou o Dr. Skilton. “Você pode, de fato, exagerar os ginásios IG dando probióticos, se houver perda da capacidade de produzir glicocalyx”
Para restaurar um microambiente mais saudável nestes casos, você precisa aproveitar as características únicas da Saccharomyces boulardii, uma levedura probiótica resistente a antibióticos, originalmente isolada do fruto da lichia na Indochina. Embora não seja um verdadeiro organismo comensal, o S. boulardii é um potente indutor da produção de glicocalyx e da secreção de IgA. Ele também estimula as enzimas da borda da escova, e promove a produção de poliamina, que alimenta o microvelo intestinal e pode ser útil na cura de colite ulcerativa, doença de Crohn, e síndrome do intestino irritável.
S. boulardii é capaz de trabalhar no contexto de bactérias altamente patogênicas resistentes a antibióticos como Clostridium difficile e tem sido usado como terapia preventiva contra a diarréia associada a C. difficile (Goldstein, E. et al. Clin Infect Dis. 2015; 60 (suppl_2): S148-S158). S. boulardii pode reduzir alguns dos efeitos tóxicos da enterotoxina A, inibindo a ligação da toxina A e prevenindo a formação de enterotoxina B.
Mas o mais notável é a sua capacidade de colonizar rapidamente o endotélio danificado e deslocar leveduras patogénicas enquanto simutaneamente cria um microambiente mais saudável para as bactérias comensais. “S. boulardii na verdade força uma evacuação física da Candida”, disse o Dr. Skilton observando que ela é especificamente ativa contra 7 das 8 espécies patogênicas mais comuns de Candida. A única exceção é C. tropicalis.
“Pense na situação como o rescaldo de um furacão que atingiu uma vila”. Os antibióticos são o furacão. S. boulardii é como o empreiteiro que entra e repara os danos da aldeia. Você pode então repovoar o vilarejo com os comensais”
BioCeuticals, uma empresa australiana de nutracêutica, introduziu recentemente um produto chamado SB Floractiv, fornecendo 250 mg de S. boulardii (também chamado S. cereviciae) por cápsula.
Para pacientes que tenham tomado antibióticos a longo prazo, comece lentamente com uma cápsula (250 mg) por dia durante 3-4 dias, depois aumente para duas por dia durante mais 3-4 dias, e depois aumente num padrão semelhante em etapas até quatro por dia (1000 mg) que deve ser continuado durante o resto de um período de 4 semanas.
S. boulardii é muito seguro, e a única contra-indicação verdadeira é em pacientes com verdadeiras reacções mediadas por IgE a leveduras, manifestando-se como anafilaxia ou  hives. Dito isto, é importante estar ciente de que nos primeiros dias de tomar S. boulardii, alguns pacientes podem experimentar um notável “rubor intestinal”, já que a levedura probiótica desloca a espécie Candida. A morte dos candidatos também pode fazer com que as pessoas se sintam doentes. É melhor avisar os pacientes dessas possibilidades com antecedência, para que não se surpreendam se elas ocorrerem.
hives. Dito isto, é importante estar ciente de que nos primeiros dias de tomar S. boulardii, alguns pacientes podem experimentar um notável “rubor intestinal”, já que a levedura probiótica desloca a espécie Candida. A morte dos candidatos também pode fazer com que as pessoas se sintam doentes. É melhor avisar os pacientes dessas possibilidades com antecedência, para que não se surpreendam se elas ocorrerem.
De acordo com o Dr. Skelton, em 9 de cada 10 pacientes, quatro semanas de suplemento intensivo de S. boulardii é siffuciente para restaurar uma camada saudável de glicocalyx e induzir uma secreção adequada de IgA. Isto, então, prepara o estágio para uma restauração muito mais eficaz com um probiótico multi-tensão.
Bioceuticals projetou um produto especificamente para uso após antibióticos. Chamado BioFloractiv 500, contém 500 bilhões de CFUs, 12 espécies, e 14 cepas de bactérias benéficas. Dr. Skilton recomenda um máximo de 14 dias, embora uma semana de terapia diária seja suficiente para a maioria, de acordo com Skilton.
Patientes com síndrome do intestino irritável ou doença de Crohn, no entanto, podem precisar de apoio a longo prazo para reconstruir um microbioma saudável depois de tomar antibióticos.
Uma Abordagem Abrangente
Probióticos são apenas uma parte do quadro. E se um paciente não pode tolerar qualquer tipo de probiótico, é uma bandeira vermelha que o sistema imunológico de um paciente não está funcionando corretamente.
“Você primeiro precisa tratar de qualquer aspecto do sistema nervoso, especialmente o domínio simpático, que pode estar afetando o trato digestivo”, disse o Dr. Skilton. Ela encontrou óleo de peixe, zinco, vitamina A e colostro em muitos casos. Este último, “é realmente bom para restaurar o sIgA”. Faça isso por uma semana ou mais antes mesmo de tentar probióticos”. Olmos escorregadios e suplementos de glutamina também podem ser úteis em alguns casos.
Medicamentos à base de plantas como óleo de orégãos, óleo de árvore de chá, ou extrato de pau d’arco podem ser úteis para livrar o trato gastrointestinal de leveduras patogênicas. Mas o Dr. Skilton enfatizou que estes não farão nada para estimular a produção de sIgA, e as infecções crônicas por leveduras estão quase sempre associadas a baixa IgA. Estas leveduras naturais nunca devem ser usadas ao mesmo tempo que o S. boulardii; esta levedura “amigável” é tão vulnerável a coisas como orégãos e árvores de chá como as leveduras patogênicas.
Um número de alimentos probióticos e prebióticos pode ajudar no processo de restauração intestinal. Tom O’Bryan, DC, fundador do Gluten Summit e do programa de treinamento Certified Gluten Practitioner, recomenda vários alimentos para comer – e vários para evitar – ao reconstruir o intestino após o tratamento com antibióticos.
“Quando o seu intestino foi comprometido, você não quer tributar o seu intestino”, diz O’Bryan. Alimentos “tributários” incluem trigo, laticínios, açúcar, gorduras insalubres e itens fritos. Esses alimentos, ele observa, “jogam gasolina no fogo” de um sistema intestinal em recuperação.
Por outro lado, deve-se comer muitos alimentos que promovem o crescimento de organismos comensal saudáveis. O’Bryan recomenda maçãs estufadas orgânicas, cozidas até ficarem macias e cintilantes, como uma boa opção. Cozinhando maçãs, ele explica, libera pectina – uma fibra solúvel que fornece combustível para bactérias benéficas.
A pectina presente nas maçãs estufadas também pode ajudar a curar um revestimento intestinal danificado e selar as lágrimas em um intestino com vazamento, evitando que moléculas grandes de alimentos escorreguem.
Simplesmente, o colágeno ajuda a selar um intestino com vazamento. O’Bryan também encoraja os pacientes a recuperarem-se do tratamento antibiótico para comerem caldo de osso de frango, uma boa fonte de colagénio, que também actua como prebiótico natural, alimentando as bactérias saudáveis do intestino.
Butyrate – uma substância natural feita no intestino – é outro jogador importante na restauração das bactérias intestinais. O’Bryan explica que as células que revestem o interior do intestino se reproduzem rapidamente e que o butirato alimenta a reconstituição de novas células. A produção insuficiente de butirato e uma rotação lenta das células intestinais tornam o organismo mais vulnerável ao desenvolvimento de células cancerosas, resultando num risco mais elevado de cancro do cólon.
Uma variedade de frutas e vegetais prebióticos, incluindo bananas, batata doce e outros tubérculos ajudam a reconstruir o microbioma intestinal, fornecendo fibras insolúveis que alimentam boas – mas não prejudiciais – bactérias.
Vegetais fermentados, não pasteurizados como chucrute, kimchi e beterraba fermentada, são outra excelente fonte de probióticos naturais. Cada legume produz diferentes famílias de bactérias benéficas durante a fermentação, observa O’Bryan, encorajando os pacientes a comer um grato de legumes fermentados duas vezes por dia. “A chave para a saúde no seu intestino é a diversidade do seu microbioma”, argumenta ele, apontando que milhares de diferentes famílias de bactérias vivem e interagem no intestino com impactos abrangentes na nossa saúde.
END