Teoria VSEPR este capabilă să explice și să prezică formele moleculelor care conțin perechi singuratice. Într-un astfel de caz, se consideră că perechile singuratice, precum și perechile de legătură se resping și se evită reciproc. De exemplu, având în vedere că există două legături în molecula SnCl2, ne-am putea aștepta ca aceasta să fie liniară ca BeCl2. Totuși, dacă desenăm diagrama Lewis, găsim o pereche singuratică, precum și două perechi de legătură în învelișul de valență al atomului de Sn:
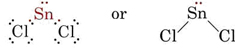_Chloride.jpg?revision=1&size=bestfit&width=235&height=48)
O pereche singuratică afectează, de asemenea, structura amoniacului, NH3. Deoarece această moleculă se supune regulii octetului, atomul de N este înconjurat de patru perechi de electroni:
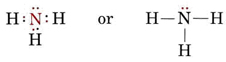
Dacă aceste perechi ar fi toate echivalente, ne-am aștepta ca unghiul dintre ele să fie unghiul tetraedric regulat de 109,5°. Experimental, se constată că unghiul este ceva mai mic, și anume, 107°. Din nou, acest lucru se datorează faptului că perechea singuratică este mai „grasă” decât perechile de legătură și este capabilă să le strângă mai aproape una de cealaltă.
Structura electronică a moleculei de H2O este similară cu cea a NH3, cu excepția faptului că o pereche de legătură a fost înlocuită cu o pereche solitară:
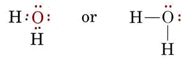
Exemplu \(\PageIndex{1}\) : Geometrie moleculară
Scrieți și descrieți geometria următoarelor molecule: (a) GaCl3, (b) AsCl3 și (c) AsOCl3.
Soluție
a) Deoarece elementul galiu aparține grupei III, acesta are trei electroni de valență. Diagrama Lewis pentru GaCl3 este astfel
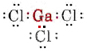
Din moment ce există trei perechi de legătură și nu există perechi solitare în jurul atomului de Ga, concluzionăm că cei trei atomi de Cl sunt dispuși trigonal și că toți cei patru atomi sunt în același plan.
b) Arsenicul aparține grupei V și, prin urmare, are cinci electroni de valență. Structura Lewis pentru AsCl3 este astfel
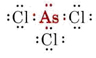
Din moment ce este prezentă o pereche singuratică, forma acestei molecule este o piramidă trigonală, cu nucleul de As puțin deasupra unui triunghi echilateral de nuclee de Cl.
c) Diagrama Lewis pentru AsOCl3 este similară cu cea a AsCl3.

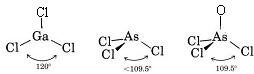
Teoria VSEPR poate fi aplicată și moleculelor care conțin cinci și șase perechi de electroni de valență, dintre care unele sunt perechi solitare. Nu am inclus astfel de specii aici, deoarece majoritatea compușilor se încadrează în categoriile pe care le-am descris.
Contribuitori
-
Ed Vitz (Universitatea Kutztown), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (Universitatea din Minnesota Rochester), Tim Wendorff și Adam Hahn.