Sărurile biliare și acizii biliari sunt derivați polari ai colesterolului și reprezintă principala cale de eliminare a steroidului din organism.
Sunt molecule cu structuri asemănătoare, dar nu identice, și cu caracteristici fizice și biologice diverse.
Sunt sintetizate în ficat, depozitate în vezica biliară, secretate în duoden și, în cele din urmă, în cea mai mare parte, reabsorbite în ileon.
Pentru că la pH-ul fiziologic aceste molecule sunt prezente sub formă de anioni, termenii de acid biliar și săruri biliare sunt folosiți în prezentul document ca sinonime.
CONȚINUTURI
- Structura chimică a sărurilor biliare
- Primare, săruri biliare conjugate și secundare
- Funcția acizilor biliari
- Circulația enterohepatică a sărurilor biliare
- Metabolismul intestinal al acizilor biliari
- Fibre solubile și reabsorbție a sărurilor biliare
- Sinteza acizilor biliari primari
- Calea clasică sau neutră
- Calea alternativă sau acidă
- Calea minoră
- Sărurile biliare: reglarea sintezei
- Structura chimică a sărurilor biliare
- Sărurile biliare primare, conjugate și secundare
- Funcția acizilor biliari
- Circulația enterohepatică a sărurilor biliare
- Metabolismul intestinal al acizilor biliari
- Fibrele solubile și reabsorbția sărurilor biliare
- Sinteza acizilor biliari primari
- Calea clasică sau neutră
- Calea alternativă sau acidă
- Caiunele minore
- Sărurile biliare: reglarea sintezei
Structura chimică a sărurilor biliare
Sărurile biliare au asemănări și deosebiri cu molecula de colesterol.
Ca și steroizii, au un nucleu compus din patru inele fuzionate: trei inele ciclohexanice, notate A, B și C, și un inel ciclopentanic, notat D. Această structură este perhidrociclopentanofenantrenul, mai cunoscut sub numele de nucleu steroidic.
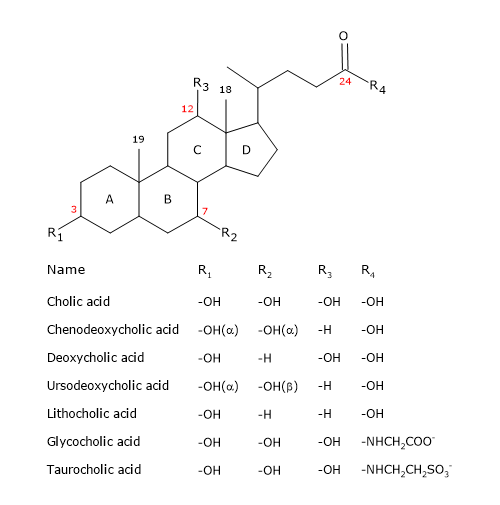
La vertebratele superioare, aceștia au 24 de atomi de carbon, deoarece lanțul lateral este cu trei atomi de carbon mai scurt decât cel original. La vertebratele inferioare, acizii biliari au 25, 26 sau 27 de atomi de carbon. Lanțul lateral se termină cu o grupare carboxil, ionizată la pH 7, care poate fi legată de aminoacidul glicină sau taurină (vezi mai jos).
În plus față de grupa hidroxil în poziția 3, au grupe hidroxil în pozițiile 7 și/sau 12.
Toate acestea îi fac mult mai polari decât colesterolul.
Din moment ce inelele A și B sunt fuzionate în configurație cis, structura plană a nucleului steroidului este curbată și este posibil să se identifice:
- o latură concavă, care este hidrofilă deoarece grupările hidroxil și gruparea carboxil a lanțului lateral, cu sau fără aminoacidul legat, sunt orientate spre ea;
- o latură convexă, care este hidrofobă deoarece grupările metil prezente în pozițiile 18 și 19 sunt orientate spre ea.
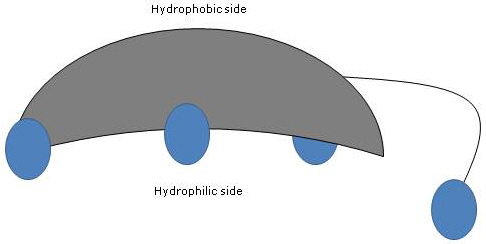
Prin urmare, având atât grupe polare cât și nepolare, sunt molecule amfifile și surfactanți excelenți. Cu toate acestea, structura lor chimică îi face diferiți de mulți alți agenți tensioactivi, fiind adesea compuși dintr-o regiune cap polară și o coadă nepolară.
Sărurile biliare primare, conjugate și secundare
Acizii biliari primari sunt cei sintetizați direct din colesterol în hepatocite. La om, cei mai importanți sunt acidul colic și acidul chenodeoxicolic, care reprezintă 80% din toți acizii biliari. Înainte de a fi secretați în arborele biliar, aceștia sunt aproape complet conjugați, până la 98%, cu glicina sau taurina, pentru a forma glicoconjugate și, respectiv, tauroconjugate. În special, aproximativ 75% din acidul cololic și acidul chenodeoxicolic sunt conjugate cu glicina, pentru a forma acidul glicocicolic și acidul glicocenodeoxicolic, iar restul de 25% cu taurina, pentru a forma acidul taurocolic și acidul taurochenodeoxicolic.
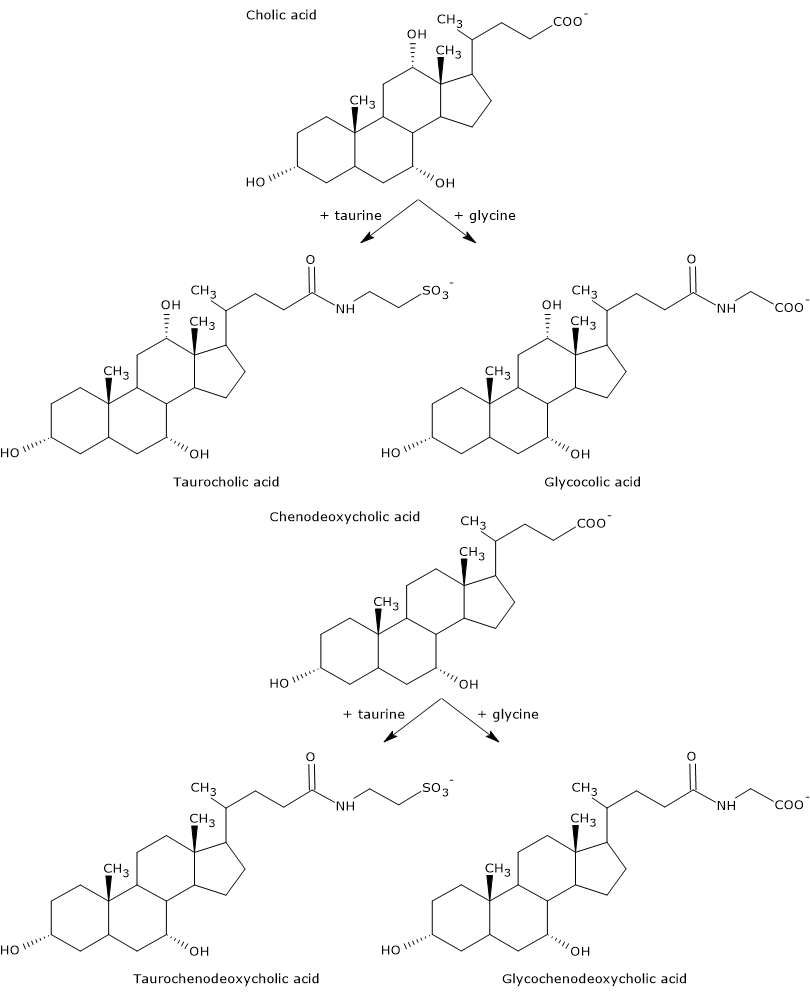
Acizii biliari conjugați sunt molecule cu mai multe grupe hidrofile decât acizii biliari neconjugați, deci cu o capacitate de emulsionare crescută. De fapt, conjugarea scade pKa acizilor biliari, de la aproximativ 6, o valoare tipică pentru moleculele neconjugate, la aproximativ 4 pentru acidul glicocolic și la aproximativ 2 pentru acidul taurocolic. Acest lucru face ca acizii biliari conjugați să fie ionizați într-un interval mai larg de pH pentru a forma sărurile corespunzătoare.
Hidrofilicitatea acizilor și a sărurilor biliare comune scade în următoarea ordine: glicină-conjugată < taurină-conjugată < acidul litocolic < acidul deoxicolic < acidul deoxicolic < acidul chenodeoxicolic < acidul cholic < acidulursodeoxicolic.
În cele din urmă, conjugarea scade, de asemenea, citotoxicitatea acizilor biliari primari.
Acizii biliari secundari se formează din acizii biliari primari care nu au fost reabsorbiți din intestinul subțire. Odată ajunși în colon, aceștia pot suferi mai multe modificări de către microbiota intestinală pentru a forma acizi biliari secundari (a se vedea mai jos). Aceștia alcătuiesc restul de 20% din rezerva de acizi biliari din organism.
O altă modalitate de clasificare a sărurilor biliare se bazează pe conjugarea lor cu glicina și taurina și pe gradul lor de hidroxilare. Pe această bază, se identifică trei categorii.
- Trihidroxi-conjugați, cum ar fi acidul taurocolic și acidul glicocolic.
- Dihidroxi-conjugați, cum ar fi acidul glicodeoxicolic, acidul glicocenodeoxicolic, acidul taurochenodeoxicolic și acidul taurodeoxicolic. Acestea reprezintă aproximativ 60% din sărurile biliare prezente în bilă.
- Forme neconjugate, cum ar fi acidul cholic, acidul deoxicolic, acidul chenodeoxicolic și acidul litocolic.
Funcția acizilor biliari
Toate funcțiile fiziologice ale acestora sunt îndeplinite în forma conjugată.
- Sunt principala cale de eliminare a colesterolului din organismul uman.
De fapt, oamenii nu au enzimele necesare pentru a desface inelele ciclohexanice sau ciclopentanice ale nucleului steroidului și nici pentru a oxida colesterolul în CO2 și apă.
Celălalt mecanism de eliminare a steroidului din organism este sub formă de colesterol ca atare în bilă. - Sărurile biliare sunt agenți tensioactivi puternici. Și, în special, di- și trihidroxi conjugatele sunt cei mai buni agenți tensioactivi dintre acizii biliari, mult mai eficienți decât omologii neconconjugați, deoarece au mai multe grupe polare.
După ce intră în contact cu lipidele apolare în lumenul intestinului subțire, suprafața apolară convexă interacționează cu lipidele apolare, cum ar fi trigliceridele, esterii de colesterol și esterii vitaminelor liposolubile, în timp ce suprafața polară concavă interacționează cu mediul apos din jur. Acest lucru mărește dispersia lipidelor apolare în mediul apos, deoarece permite formarea de mici picături lipidice, mărind suprafața pentru:
activitatea lipazei, în principal a lipazei pancreatice, (sărurile biliare joacă, de asemenea, un rol direct în activarea acestei enzime);
activitatea esterazei intestinale.
În consecință, facilitează absorbția produselor de digestie a lipidelor, precum și a vitaminelor liposolubile de către mucoasa intestinală, datorită formării de micelii mixte.
Acizii biliari îndeplinesc o funcție similară în vezica biliară unde, formând micelii mixte cu fosfolipidele, împiedică precipitarea colesterolului.
Nota: Ca o consecință a aranjamentului grupărilor polare și nepolare, acizii biliari formează micelii în soluție apoasă, alcătuite de obicei din mai puțin de 10 monomeri, atâta timp cât concentrația lor este peste așa-numita concentrație critică micelară sau CMC.
- La nivel intestinal, modulează secreția enzimelor pancreatice și a colecistochininei.
- În intestinul subțire și gros, au o puternică activitate antimicrobiană, în principal acidul deoxicolic, în special împotriva bacteriilor Gram-pozitive. Această activitate se poate datora deteriorării oxidative a ADN-ului, și/sau deteriorării membranei celulare. Prin urmare, ele joacă un rol important în prevenirea creșterii excesive a bacteriilor, dar și în reglarea compoziției microbiotei intestinale.
- În ultimii ani, devine evident rolul lor reglator în controlul metabolismului energetic și, în special, pentru manipularea hepatică a glucozei.
Circulația enterohepatică a sărurilor biliare
După ingestia de grăsimi, celulele enteroendocrine ale duodenului secretă colecistochinină în fluxul sanguin. Legarea hormonului de receptorii de pe celulele musculare netede ale vezicii biliare favorizează contracția acestora; hormonul determină, de asemenea, relaxarea sfincterului lui Oddi. Toate acestea au ca rezultat secreția bilei și, prin urmare, a acizilor biliari în duoden.
În condiții fiziologice, rezerva de săruri biliare umane este constantă și egală cu aproximativ 3-5 g. Acest lucru este posibil prin două procese:
- reabsorbția lor intestinală;
- sinteza lor de novo (vezi mai jos).
Până la 95% din sărurile biliare secretate sunt reabsorbite din intestin, nu împreună cu produsele de digestie a lipidelor, ci printr-un proces numit circulație enterohepatică.
Este un sistem de reciclare extrem de eficient, care pare să aibă loc de cel puțin două ori pentru fiecare masă, și care include ficatul, arborele biliar, intestinul subțire, colonul și circulația portală prin care moleculele reabsorbite se întorc la ficat. O astfel de recirculare este necesară deoarece capacitatea ficatului de a sintetiza acizi biliari este limitată și insuficientă pentru a satisface nevoile intestinale dacă sărurile biliare ar fi excretate în fecale în cantități mari.
Cele mai multe dintre sărurile biliare sunt reabsorbite în ileonul distal, partea inferioară a intestinului subțire, de către un transportor dependent de sodiu din cadrul marginii în perie a enterocitelor, numit transportor de acid biliar dependent de sodiu sau ASBT, care realizează cotransportul unei molecule de acid biliar și a doi ioni de sodiu.
În interiorul enterocitelor, se crede că acizii biliari sunt transportați prin citosol către membrana bazolaterală de către proteina de legare a acidului biliar ileal sau IBABP. Aceștia traversează membrana bazolaterală prin transportatorul de solut organic alfa-beta sau OSTα/OSTβ, trec în circulația portală și, legați de albumină, ajung în ficat.
Este de remarcat că un procent mic de acizi biliari ajung în ficat prin artera hepatică.
La nivel hepatic, extracția lor este foarte eficientă, cu o fracție de extracție de primă trecere cuprinsă între 50 și 90%, procent care depinde de structura acidului biliar. Absorbția acizilor biliari conjugați este mediată în principal de un sistem de transport activ dependent de Na+, adică de polipeptidul de cotransport al taurocolatului dependent de sodiu sau NTCP (sodium-dependent taurocholate cotransporting polypeptide). Cu toate acestea, poate avea loc, de asemenea, o absorbție independentă de sodiu, realizată de proteine din familia polipeptidelor de transport al anionilor organici sau OATP, în principal OATP1B1 și OATP1B3.
Etapa de limitare a vitezei în circulația enterohepatică este secreția canaliculară a acestora, mediată în mare parte de pompa de export a sărurilor biliare sau BSEP, într-un proces dependent de ATP. Această pompă transportă sărurile biliare monoanionice, care sunt cele mai abundente. Acizii biliari conjugați cu acid glucuronic sau sulfat, care sunt dianionici, sunt transportați de diferiți purtători, cum ar fi MRP2 și BCRP.
Nota: Nivelurile serice ale acizilor biliari variază pe baza ratei de reabsorbție a acestora și, prin urmare, sunt mai ridicate în timpul meselor, când circulația enterohepatică este mai activă.
Metabolismul intestinal al acizilor biliari
Acizii biliari care scapă absorbției ileale trec în colon, unde suferă parțial modificări de către microbiota intestinală și sunt transformați în acizi biliari secundari.
Reacțiile principale sunt enumerate mai jos.
- Deconjugare
Pe lanțul lateral, poate avea loc hidroliza legăturii N-acetil amidice C24, cu eliberare de acizi biliari neconjugați și glicină sau taurină. Această reacție este catalizată de hidrolaze bacteriene prezente atât în intestinul subțire, cât și în colon. - 7α-Dehidroxilarea
Cuantitativ, este cea mai importantă reacție, realizată de dehidratazele bacteriene colonice care elimină gruparea hidroxil din poziția 7 pentru a forma acizi biliari 7-deoxi. În special, acidul deoxicolic se formează din acidul cholic, iar acidul litocolic, un acid biliar secundar toxic, din acidul chenodeoxicolic.
Este de reținut că 7α-dehidroxilarea, spre deosebire de oxidare și epimerizare (vezi mai jos), poate avea loc numai pe acizii biliari neconjugați și, prin urmare, deconjugarea este o condiție prealabilă esențială. - Oxidarea și epimerizarea
Sunt reacții care implică grupările hidroxil în pozițiile 3, 7 și 12, catalizate de hidroxisteroid dehidrogenazele bacteriene. De exemplu, acidul ursodeoxicolic derivă din epimerizarea acidului chenodeoxicolic.
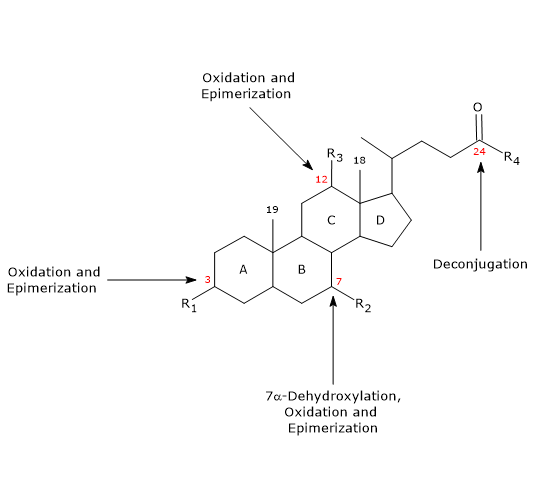
O parte din acizii biliari secundari sunt apoi reabsorbiți din colon și se întorc în ficat. În hepatocite, ei sunt reconjugați, dacă este necesar, și resecretați. Cei care nu sunt reabsorbiți, sunt excretați în fecale.
În timp ce oxidările și deconjugările sunt efectuate de un spectru larg de bacterii anaerobe, 7α-dehidroxilările sunt efectuate de un număr limitat de anaerobi colonici.
7α-Dehidroxilațiile și deconjugările cresc pKa acizilor biliari și, prin urmare, hidrofobicitatea lor, permițând un anumit grad de absorbție pasivă prin peretele colonic.
Creșterea hidrofobicității este, de asemenea, asociată cu o toxicitate crescută a acestor molecule. Iar o concentrație ridicată de acizi biliari secundari în bilă, sânge și fecale a fost asociată cu patogeneza cancerului de colon.
Fibrele solubile și reabsorbția sărurilor biliare
Reabsorbția sărurilor biliare poate fi redusă prin acțiunea chelantă a fibrelor solubile, cum sunt cele care se găsesc în fructele proaspete, leguminoase, ovăz și tărâțe de ovăz, care le leagă, diminuând absorbția lor. La rândul său, aceasta crește sinteza de novo a acizilor biliari, prin reglarea expresiei 7α-hidroxilazei și a sterolului 12α-hidroxilazei (vezi mai jos), și astfel se reduce concentrația de colesterol hepatocitar.
Epuizarea colesterolului hepatic crește expresia receptorului LDL, și astfel se reduce concentrația plasmatică a colesterolului LDL. Pe de altă parte, stimulează, de asemenea, sinteza HMG-CoA reductazei, enzima cheie în biosinteza colesterolului.
Nota: Unele medicamente anticolesterol acționează prin legarea acizilor biliari în intestin, împiedicând astfel reabsorbția acestora.
Sinteza acizilor biliari primari
Cuantitativ, acizii biliari sunt produsul major al metabolismului colesterolului.
Cum s-a spus anterior, circulația enterohepatică și sinteza lor de novo mențin o dimensiune constantă a pool-ului de acizi biliari. În special, sinteza de novo permite înlocuirea sărurilor biliare excretate pe fețe, aproximativ 5-10% din rezerva corporală, respectiv ~ 0,5 g/zi.
În continuare, este descrisă sinteza acidului colic și a acidului chenodeoxicolic, precum și conjugarea lor cu aminoacizii taurină și glicină.
Există două căi principale de sinteză a acizilor biliari: calea clasică și calea alternativă. În plus, vor fi descrise și alte câteva căi minore.
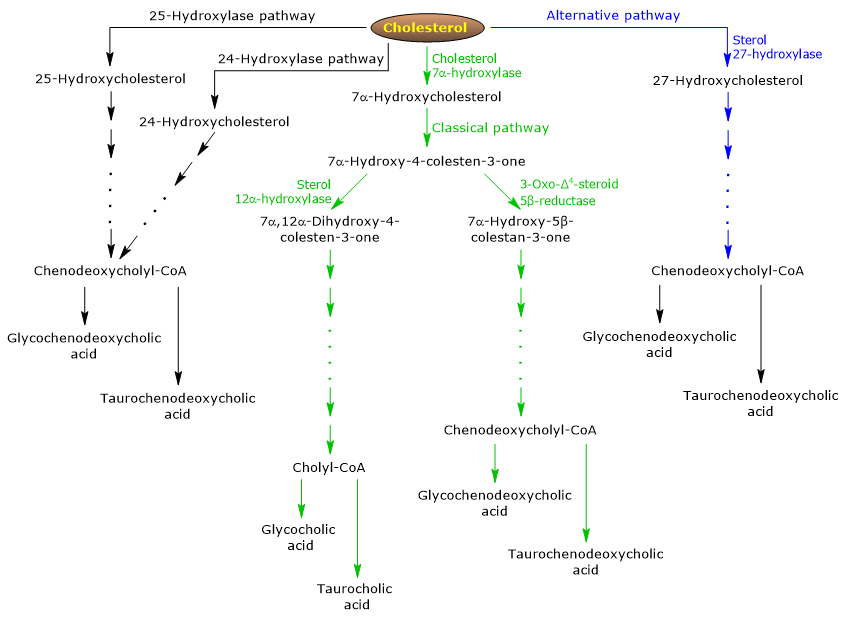
Calea clasică sau neutră
La om, până la 90% din sărurile biliare sunt produse prin calea clasică (vezi fig. 5), denumită și calea „neutră”, deoarece intermediarii sunt molecule neutre.
Este o cale metabolică prezentă numai în ficat, care constă în reacții catalizate de enzime localizate în citosol, reticul endoplasmatic, peroxizomi și mitocondrii, și ai cărei produși finali sunt conjugatele acidului colic și acidului chenodeoxicolic.
- Prima reacție este hidroxilarea în poziția 7 a colesterolului, pentru a forma 7α-hidroxicolesterol. Reacția este catalizată de colesterolul 7α-hidroxilază sau CYP7A1 (C.E. 1.14.14.14.23). Este o enzimă localizată în reticulul endoplasmatic și catalizează etapa limitatoare de viteză a căii.
Colesterol + NADPH + H+ + O2 → 7α-Hidroxicolesterol + NADP+ + H2O
- 7α-Hidroxicolesterolul suferă oxidarea grupei 3β-hidroxil și deplasarea dublei legături din poziția 5,6 în poziția 4,5, pentru a forma 7α-hidroxi-4-colesten-3-one. Reacția este catalizată de 3β-hidroxi-Δ5-C27-steroid oxidoreductaza sau HSD3B7 (E.C. 1.1.1.1.181), o enzimă localizată în reticulul endoplasmatic.
- 7α-Hidroxi-4-colesten-3-one poate urma două căi:
să intre în calea care duce la sinteza acidului cololic, prin reacția catalizată de 7α-hidroxi-4-colesten-3-one 12α-monooxigenază sau sterol 12α-hidroxilază sau CYP8B1 (E.C. 1.14.18.8), o enzimă localizată în reticulul endoplasmatic;
pentru a intra în calea care duce la sinteza acidului chenodeoxicolic, prin reacția catalizată de 3-oxo-Δ4-steroid 5β-reductaza sau AKR1D1 (E.C. 1.3.1.3), o enzimă citosolică.
Trebuie subliniat faptul că activitatea sterolului 12α-hidroxilază determină raportul dintre acidul colic și acidul chenodeoxicolic și, în cele din urmă, capacitatea detergentă a pool-ului de acizi biliari. Și, de fapt, reglarea transcripției genei sterol 12α-hidroxilazei este una dintre principalele etape de reglare a căii clasice.
Prin urmare, dacă 7α-hidroxi-4-colesten-3-one trece prin reacția catalizată de sterol 12α-hidroxilază, vor avea loc următoarele reacții.
- 7α-Hidroxi-4-colesten-3-one este hidroxilată în poziția 12 de către sterol 12α-hidroxilază, pentru a forma 7α,12α-dihidroxi-4-colesten-3-one.
- 7α,12α-Dihidroxi-4-colesten-3-one suferă reducerea dublei legături în poziția 4,5, în reacția catalizată de 3-oxo-Δ4-steroid 5β-reductaza, pentru a forma 5β-colestan-7α,12α-diol-3-one.
- 5β-Cholestan-7α,12α-diol-3-one suferă reducerea grupei hidroxil în poziția 4, în reacția catalizată de 3α-hidroxisteroid dehidrogenază sau AKR1C4 (EC 1.1.1.1.213), o enzimă citosolică, pentru a forma 5β-colestan-3α,7α,12α-triol.
- 5β-Cholestan-3α,7α,12α-triol suferă oxidarea lanțului lateral prin trei reacții catalizate de sterol 27-hidroxilază sau CYP27A1 (EC 1.14.15.15). Este o enzimă mitocondrială prezentă și în țesuturile extrahepatice și în macrofage, care introduce o grupare hidroxil în poziția 27. Grupa hidroxil este oxidată la aldehidă și apoi la acid carboxilic, pentru a forma acidul 3α,7α,12α-trihidroxi-5β-colestanoic.
- Acidul 3α,7α,12α-Trihidroxi-5β-colestanoic este activat în esterul său de coenzima A, 3α,7α,12α-trihidroxi-5β-colestanoil-CoA, în reacția catalizată fie de acil-CoA sintetaza cu lanț foarte lung sau VLCS (EC 6.2.2.1.-), fie acidul biliar CoA sintetază sau BACS (EC 6.2.1.7), ambele localizate în reticulul endoplasmatic.
- În ultima etapă are loc conjugarea, prin intermediul legăturii amidice, a grupei de acid carboxilic din lanțul lateral cu aminoacidul glicină sau taurină. Reacția este catalizată de acidul biliar-CoA:aminoacid N-acetiltransferaza sau BAAT (EC 2.3.1.65), care este localizată predominant în peroxizomi.
Produsele de reacție sunt astfel acizii biliari conjugați: acidul glicocolic și acidul taurocolic.
α,7α,7α,12α-Trihidroxi-5β-colestanoil-CoA este transportată în peroxizomi unde este supusă la cinci reacții succesive, fiecare catalizată de o enzimă diferită. În ultimele două reacții, lanțul lateral este scurtat la patru atomi de carbon și, în final, se formează colilCoA.
Dacă 7α-hidroxi-4-colesten-3-one nu trece prin reacția catalizată de sterol 12α-hidroxilaza, intră în calea care duce la sinteza conjugatelor de acid chenodeoxicolic, prin reacțiile descrise mai jos.
- 7α-Hidroxi-4-colesten-3-one se transformă în 7α-hidroxi-5β-colestan-3-one în reacția catalizată de 3-oxo-Δ4-steroid 5β-reductaza.
- 7α-Hidroxi-5β-colestan-3-one se transformă în 5β-colestan-3α,7α-diol în reacția catalizată de 3α-hidroxisteroid dehidrogenază.
Apoi, acizii biliari conjugați acidul glicocenodeoxicolic și acidul taurochenodeoxicolic se formează prin modificări similare celor observate pentru conjugarea acidului colic și catalizate în cea mai mare parte de aceleași enzime.
Nota: Acizii biliari neconjugați formați în intestin trebuie să ajungă la ficat pentru a fi reconjugați.
Calea alternativă sau acidă
Este predominantă la făt și la nou-născut, în timp ce la adulți duce la sinteza a mai puțin de 10% din sărurile biliare.
Această cale (v. fig. 5) se deosebește de calea clasică prin faptul că:
- produsele intermediare sunt molecule acide, de unde și denumirea alternativă de „cale acidă”;
- oxidarea catenei laterale este urmată de modificări ale nucleului steroidic, și nu invers;
- produsele finale sunt conjugate ale acidului chenodeoxicolic.
Prima etapă implică transformarea colesterolului în 27-hidroxicolesterol în reacția catalizată de sterol 27-hidroxilază.
27-hidroxicolesterolul poate urma două căi.
Ruta A
- 27-hidroxicolesterolul este transformat în acid 3β-hidroxi-5-colestenoic într-o reacție catalizată de sterol 27-hidroxilază.
- Acidul 3β-hidroxi-5-colestenoic este hidroxilat la poziția 7 în reacția catalizată de oxisterolul 7α-hidroxilază sau CYP7B1 (EC 1.14.13.100), o enzimă localizată în reticulul endoplasmatic, pentru a forma acidul 3β-7α-dihidroxi-5-colestenoic.
- Acidul 3β-7α-Dihidroxi-5-colestenoic este transformat în acid 3-oxo-7α-hidroxi-4-colestenoic, în reacția catalizată de 3β-hidroxi-Δ5-C27-steroid oxidoreductaza.
- Acidul 3-Oxo-7α-hidroxi-4-colestenoic, ca urmare a modificărilor lanțului lateral, formează acidul chenodeoxicolic și apoi conjugații săi.
Ruta B
- 27-Hidroxicolesterolul este transformat în 7α,27-dihidroxicolesterol în reacția catalizată de oxisterolul 7α-hidroxilază și colesterolul 7α-hidroxilază.
- 7α,27-Dihidroxicholesterol este transformat în 7α,26-dihidroxi-4-colesten-3-one în reacția catalizată de 3β-hidroxi-Δ5-C27-steroid oxidoreductaza;
7α,26-Dihidroxi-4-colesten-3-one poate fi transformată direct în conjugate ale acidului chenodeoxicolic sau poate fi transformată în acid 3-oxo-7α-hidroxi-4-colestenoic, iar apoi poate suferi modificări ale lanțului lateral și alte reacții care conduc la sinteza conjugatelor acidului chenodeoxicolic.
Caiunele minore
Există, de asemenea, căi minore (vezi fig. 5) care contribuie la sinteza sărurilor biliare, deși într-o măsură mai mică decât căile clasice și alternative.
De exemplu:
- O colesterol 25-hidroxilază (EC 1.14.99.38) este exprimată în ficat.
- O colesterol 24-hidroxilază sau CYP46A1 (EC 1.14.14.14.25) este exprimată în creier și, prin urmare, deși organul nu poate exporta colesterol, exportă oxisteroli.
- A fost descoperită, de asemenea, o 7α-hidroxilază nespecifică. Este exprimată în toate țesuturile și se pare că este implicată în generarea de oxisteroli, care pot fi transportați la hepatocite pentru a fi transformați în acid chenodeoxicolic.
În plus, sterolul 27-hidroxilaza este exprimată în diferite țesuturi și, prin urmare, produsele sale de reacție trebuie să fie transportate la ficat pentru a fi transformate în săruri biliare.
Sărurile biliare: reglarea sintezei
Reglarea sintezei acizilor biliari are loc printr-un mecanism de feedback negativ, în special asupra expresiei colesterolului 7α-hidroxilaza și a sterolului 12α-hidroxilaza.
Când apare un exces de acizi biliari, atât liberi cât și conjugați, aceste molecule se leagă de receptorul nuclear receptor farnesoid X sau FRX, activându-l: cel mai eficient acid biliar este acidul chenodeoxicolic, în timp ce altele, cum ar fi acidul ursodeoxicolic, nu îl activează.
FRX induce expresia reprimarului represor transcripțional small heterodimer partner sau SHP, care, la rândul său, interacționează cu alți factori de transcripție, cum ar fi receptorul hepatic omolog-1 sau LRH-1, și factorul nuclear hepatocitar-4α sau HNF-4α. Acești factori de transcripție se leagă de o secvență din regiunea promotoare a genelor 7α-hidroxilazei și 12α-hidroxilazei, regiune numită elemente de răspuns la acizii biliari sau BAREs, inhibând transcrierea acestora.
Unul dintre motivele pentru care sinteza sărurilor biliare este strâns reglată este că mulți dintre metaboliții lor sunt toxici.
Chiang J.Y.L. Acizii biliari: reglarea sintezei. J Lipid Res 2009;50(10):1955-66. doi:10.1194/jlr.R900010-JLR200
Gropper S.S., Smith J.L. Advanced nutrition and human metabolism. Ediția a 6-a. Cengage Learning, 2012
Moghimipour E., Ameri A., and Handali S. Absorption-enhancing effects of bile selts. Molecules 2015;20(8); 14451-73. doi:10.3390/molecules200814451
Monte M.J., Marin J.J.G., Antelo A., Vazquez-Tato J. Acizii biliari: Chimie, fiziologie și fiziopatologie. World J Gastroenterol 2009;15(7):804-16. doi:10.3748/wjg.15.804
Rawn J.D. Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990
Rosenthal M.D., Glew R.H. Medical biochemistry – Human metabolism in health and disease. John Wiley J. & Sons, Inc., Publicație, 2009
Sundaram S.S., Bove K.E., Lovell M.A. și Sokol R.J. Mecanisme de boală: erori înnăscute de sinteză a acizilor biliari. Nat Clin Pract Gastroenterol Hepatol 2008;5(8):456-68. doi:10.1038/ncpgasthep1179
.