Antibioticele eradică infecțiile patogene și salvează vieți – dar, în acest fel, ele perturbă și integritatea microbiomului intestinal. Deși mulți medici recunosc necesitatea de a restabili echilibrul microbian al unui pacient în urma unui tratament cu antibiotice, mult mai puțini înțeleg cum să facă acest lucru în mod eficient.
Potrivit lui Amie Skilton, ND, restaurarea florei intestinale este atât artă, cât și știință. Făcută bine, aceasta poate face o diferență enormă pentru pacienți. În unele cazuri, poate chiar să îi ajute pe pacienți să depășească bolile pentru care au fost prescrise inițial antibioticele.
Dar este nevoie de mai mult decât să recomanzi un probiotic din comerț și să speri la ce e mai bun.
Centrii pentru Controlul Bolilor au raportat în primăvara anului trecut că din cele 154 de milioane de rețete de antibiotice prescrise în cabinetele medicale și în departamentele de urgență în fiecare an, 30 la sută sunt inutile. Cele mai multe dintre prescripțiile străine, a constatat CDC, au fost distribuite pentru afecțiuni respiratorii cauzate de viruși, cum ar fi răcelile obișnuite, durerile de gât virale, bronșita și infecțiile sinusurilor și ale urechilor, care nu răspund la antibiotice. Utilizarea acestor medicamente „îi expune pe pacienți la un risc inutil de reacții alergice sau la o diaree uneori mortală, Clostridium difficile.”
Complică și mai mult situația realitatea faptul că antibioticele nu sunt împrăștiate doar din cabinetele medicilor; ele sunt, de asemenea, hrănite cu generozitate pentru animale și pulverizate pe scară largă pe produse, lăsând urme minuscule, dar biologic active, în alimentele pe care oamenii le consumă apoi.
Dosarea, sincronizarea determină impactul
Pe măsură ce antibioticele omoară microorganismele care cauzează infecții, ele distrug, de asemenea, în mod neselectiv, comunitățile de bacterii intestinale benefice, slăbind stabilitatea microbiomului intestinal. Această distrugere masivă poate fi masivă; datele experimentale colectate în cadrul unui studiu care utilizează qPCR indică o reducere de până la 10 ori a izolatelor bacteriene imediat după tratamentul cu antibiotice (Panda, S. et al. PLoS One. 2014; 9(4): e95476).
„Este cu adevărat un efect de decimare”, spune Dr. Skilton, medic naturopat și fitoterapeut la Elysium Clinic of Natural Medicine, Sydney, NSW, Australia.
În cadrul unui webinar sponsorizat de Holistic Primary Care and Bioceuticals, ea a subliniat nenumăratele efecte ale antibioticelor asupra microbiomului uman, menționând că nu toate antibioticele sunt la fel de distructive pentru bacteriile intestinale.
Gradul în care aceste medicamente dăunează microbiotei intestinale depinde de tipul de medicament, de durata tratamentului și de frecvența de utilizare, a spus Skilton. Anumite antibiotice, de exemplu, declanșează o eliberare mai mare de endotoxine și citokine decât altele. Dozele zilnice mai mari au un impact mai mare. Utilizarea prelungită a antibioticelor în doze mari poate provoca daune extreme microbiomului, care pot necesita ani de zile de terapie de refacere pentru a fi inversate, dacă pot fi inversate.
Și, contrar credinței comune, antibioticele intravenoase pot avea același impact negativ asupra florei intestinale ca și medicamentele orale. „Multă vreme s-a crezut că medicamentele intravenoase ar ocoli intestinul și nu ar avea același impact. Acum știm că acest lucru nu este adevărat.”
Momentul administrării antibioticelor face, de asemenea, o diferență. Persoanele care folosesc frecvent antibiotice la începutul vieții sunt mai vulnerabile la multe tipuri de boli pe măsură ce îmbătrânesc. Într-o lucrare publicată la începutul acestui an, cercetătorii au demonstrat o asociere între utilizarea antibioticelor în timpul copilăriei și rezultatele neurocognitive slabe ulterioare, sugerând că consumul de antibiotice în primul an de viață al unui pacient a fost asociat cu diferențe mici, dar semnificative din punct de vedere statistic, în ceea ce privește măsurile cognitive, comportamentale și de dispoziție în timpul copilăriei (Slykerman, R. et al. Acta Paediatr. 2017; 106(1): 87-94).
Alții au legat expunerea fetală și în copilăria timpurie la antibiotice de dezvoltarea ulterioară a astmului mai târziu în viață (Örtqvist, A. et al. Brit Med J. 2014; 349. doi: https://doi.org/10.1136/bmj.g6979). Antibioticele au fost, de asemenea, asociate cu obezitatea și creșterea în greutate atât la copii, cât și la adulți (Million, M. et al. Clin Microbiol & Infec. 2013; 19(4): 305-313). Cercetătorii atribuie aceste modificări compoziției microbiene intestinale modificate.
Antibioticele pot declanșa eliberarea de lipopolizaharide toxice (LPS), molecule mari care se găsesc în membranele externe ale bacteriilor Gram-negative patogene. Unii sugerează că eliberarea de LPS indusă de antibiotice poate contribui la apariția șocului septic la pacienții tratați pentru infecții severe cauzate de bacterii Gram-negative. Alții au demonstrat că LPS declanșează un răspuns imunitar prin eliberarea de citokine inflamatorii, o problemă care se agravează după tratamentul cu antibiotice, a notat Skilton în webinarul său (Wu, T. et al. Toxicol Lett. 2009; 191(2-3): 195-202).
Din punctul de vedere al unui agent patogen, producția de LPS este o strategie de supraviețuire. Aceste molecule interacționează pe suprafețele celulare pentru a forma o barieră, împiedicând pătrunderea antibioticelor și a altor compuși hidrofobi și permițând bacteriilor Gram-negative să trăiască chiar și în medii dificile (Zhang, G. et al. Curr Opin Microbiol. 2013; 16(6): 779-785).
Cum se restabilește flora
Probioticele sunt un aspect într-o strategie cuprinzătoare de restabilire a florei intestinale în urma administrării de antibiotice. Având în vedere diversitatea microbiană a unui ecosistem intestinal sănătos, Skilton recomandă utilizarea de produse care conțin multe specii diferite de microbi benefici, mai degrabă decât „monocultura” cu una sau două tulpini unice.
De regulă, ea recomandă o lună de tratament cu probiotice pentru fiecare săptămână în care un pacient a fost sub tratament cu antibiotice. Cei care au fost în regimuri antibiotice continue și prelungite, vor avea nevoie, de asemenea, de o restaurare pe termen lung. Ea a subliniat că, pentru majoritatea oamenilor, nu există riscuri pentru sănătate asociate cu suplimentarea prelungită cu probiotice.
Pacienții care primesc antibiotice intravenoase ar trebui să ia, de asemenea, probiotice comensale. Unii clinicieni care sunt conștienți de această problemă vor începe administrarea probioticelor încă de la patru ore după o doză de antibiotice intravenoase.
Reconstrucția glicocalixului
Persoanele care au urmat tratamente cu antibiotice pe termen lung sau multiple prezintă, de obicei, o eroziune severă a glicocalixului care în mod normal îmbracă microvilii intestinali. Aceasta este de obicei însoțită de o pierdere a marginilor în perie și de o reducere marcată a producției de IgA secretorie.
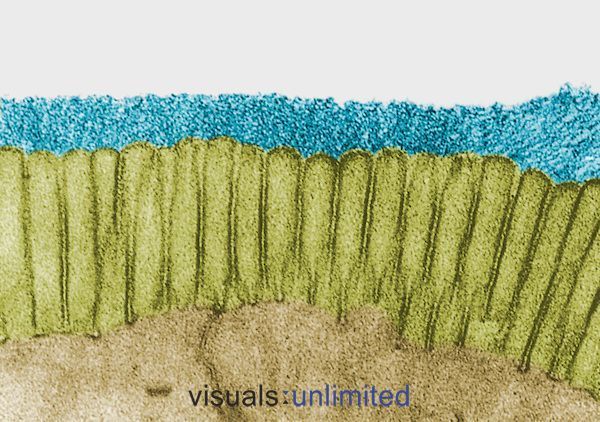 În unele cazuri, aceste modificări sunt cauzate de efectele antibioticelor în sine. În altele, ele reflectă impactul infecției pentru care au fost prescrise antibioticele. Oricum ar fi, efectul este același: stabilirea unui micro-mediu care este ospitalier pentru agenții patogeni oportuniști, cum ar fi Candida, dar din ce în ce mai dificil pentru bacteriile comensale normale.
În unele cazuri, aceste modificări sunt cauzate de efectele antibioticelor în sine. În altele, ele reflectă impactul infecției pentru care au fost prescrise antibioticele. Oricum ar fi, efectul este același: stabilirea unui micro-mediu care este ospitalier pentru agenții patogeni oportuniști, cum ar fi Candida, dar din ce în ce mai dificil pentru bacteriile comensale normale.
Infecțiile fungice sunt aproape întotdeauna însoțite de o producție insuficientă de IgA, deoarece Candida consumă atât glicocalixul, cât și sIgA ca și combustibili. Devine un cerc vicios: un nivel scăzut de IgA generează Candida, care epuizează și mai mult IgA. Infecțiile cronice ale tractului urinar și infecțiile mucoaselor, cum ar fi aftele, sunt semnale de alarmă pentru o producție scăzută de sIgA, a subliniat Skilton.
Fără un glicocalix sănătos, organisme precum Lactobacilii și Bifidobacilii au mari dificultăți în a se stabili. În acest context, suplimentarea cu probiotice obișnuite va eșua de obicei.
„Chiar dacă recomandați cele mai bune probiotice din lume, nu au cum să se lipească și să colonizeze dacă glicocalixul este erodat”, a explicat Dr. Skilton. „Puteți, de fapt, să exagerați simptomele gastrointestinale prin administrarea de probiotice, dacă există o pierdere a capacității de a produce glicocalix.”
Pentru a restabili un micro-mediu mai sănătos în aceste cazuri, trebuie să valorificați caracteristicile unice ale Saccharomyces boulardii, o drojdie probiotică rezistentă la antibiotice, izolată inițial din fructe de litchi din Indochina. Deși nu este un adevărat organism comensal, S. boulardii este un puternic inductor al producției de glicocalix și al secreției de IgA. De asemenea, stimulează enzimele de la marginea periei și promovează producția de poliamine, care alimentează microvilii intestinali și poate fi utilă pentru vindecarea colitei ulcerative, a bolii Crohn și a sindromului colonului iritabil.
S. boulardii este capabilă să acționeze în contextul bacteriilor extrem de patogene și rezistente la antibiotice, cum ar fi Clostridium difficile și, de fapt, a fost utilizată ca terapie preventivă împotriva diareei asociate cu C. difficile (Goldstein, E. et al. Clin Infect Dis. 2015; 60 (suppl_2): S148-S158). S. boulardii poate reduce unele dintre efectele toxice ale enterotoxinei A prin inhibarea legării receptorului de toxină A și prevenirea formării enterotoxinei B.
Dar cel mai remarcabil lucru este capacitatea sa de a coloniza rapid endoteliul deteriorat și de a deplasa drojdiile patogene, creând în același timp un micro-mediu mai sănătos pentru bacteriile comensale. „S. boulardii forțează, de fapt, o evacuare fizică a Candida”, a declarat Dr. Skilton menționând că este activ în mod specific împotriva a 7 din cele mai comune 8 specii patogene de Candida. Singura excepție este C. tropicalis.
„Gândiți-vă la această situație ca la urmările unui uragan care lovește un sat. Antibioticele sunt uraganul. S. boulardii este ca antreprenorul care vine și repară pagubele din sat. Apoi puteți repopula satul cu plante comensale.”
BioCeuticals, o companie australiană de nutraceutice destinată exclusiv practicienilor, a introdus recent un produs numit SB Floractiv, care oferă 250 mg de S. boulardii (numit și S. cereviciae) pe capsulă.
Pentru pacienții care au luat antibiotice pe termen lung, începeți încet cu o capsulă (250 mg) pe zi timp de 3-4 zile, apoi creșteți la două pe zi timp de alte 3-4 zile și apoi creșteți într-un model similar în trepte până la patru pe zi (1000 mg), care ar trebui să fie continuate pentru restul unei perioade de 4 săptămâni.
S. boulardii este foarte sigur, iar singura contraindicație reală este la pacienții cu reacții adevărate mediate de IgE la drojdii, care se manifestă prin anafilaxie sau 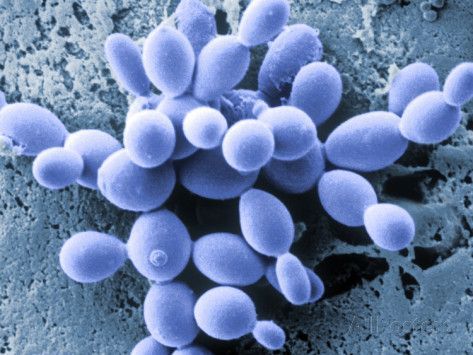 urticarie. Acestea fiind spuse, este important să fim conștienți de faptul că, în primele zile de administrare a S. boulardii, unii pacienți pot experimenta o „spălătură intestinală” vizibilă, pe măsură ce drojdia probiotică deplasează speciile de Candida. De asemenea, dispariția candidozei poate face ca oamenii să se simtă rău. Cel mai bine este să îi sfătuiți pe pacienți în prealabil cu privire la aceste posibilități, astfel încât să nu fie surprinși dacă acestea apar.
urticarie. Acestea fiind spuse, este important să fim conștienți de faptul că, în primele zile de administrare a S. boulardii, unii pacienți pot experimenta o „spălătură intestinală” vizibilă, pe măsură ce drojdia probiotică deplasează speciile de Candida. De asemenea, dispariția candidozei poate face ca oamenii să se simtă rău. Cel mai bine este să îi sfătuiți pe pacienți în prealabil cu privire la aceste posibilități, astfel încât să nu fie surprinși dacă acestea apar.
Potrivit Dr. Skelton, la 9 din 10 pacienți, patru săptămâni de suplimentarea intensivă cu S. boulardii este sifucientă pentru a restabili un strat glicocalix sănătos și a induce o secreție adecvată de IgA. Aceasta pregătește apoi terenul pentru o rundă de refacere mult mai eficientă cu un probiotic cu mai multe tulpini.
Bioceuticals a conceput un produs special pentru utilizarea după antibiotice. Denumit BioFloractiv 500, acesta conține 500 miliarde de UFC, 12 specii și 14 tulpini de bacterii benefice. Dr. Skilton recomandă o perioadă maximă de 14 zile, deși o săptămână de terapie zilnică este suficientă pentru majoritatea, potrivit lui Skilton.
Pacienții cu sindromul colonului iritabil sau boala Crohn, cu toate acestea, pot avea nevoie de un sprijin pe termen mai lung pentru a reconstrui un microbiom sănătos după administrarea de antibiotice.
O abordare cuprinzătoare
Probioticele sunt doar o parte a tabloului. Iar dacă un pacient nu poate tolera niciun tip de probiotic, este un semnal de alarmă că sistemul imunitar al pacientului nu funcționează corect.
„Trebuie mai întâi să abordați orice aspect al sistemului nervos, în special dominanța simpatică, care poate afecta tractul digestiv”, a spus Dr. Skilton. Ea a constatat că uleiul de pește, zincul, vitamina A și colostrul sunt de valoare în multe cazuri. Acesta din urmă, „este foarte bun pentru restabilirea sIgA. Faceți acest lucru timp de o săptămână sau cam așa ceva înainte de a încerca chiar și probioticele”. Suplimentele de ulm alunecos și glutamină pot fi, de asemenea, utile în unele cazuri.
Medicamentele pe bază de plante, cum ar fi uleiul de oregano, uleiul de arbore de ceai sau extractul de pau d’arco, pot fi utile pentru a scăpa tractul GI de drojdia patogenă. Dar Dr. Skilton a subliniat că acestea nu vor face nimic pentru a stimula producția de sIgA, iar infecțiile cronice cu drojdie sunt aproape întotdeauna asociate cu un nivel scăzut de IgA. Aceste distrugătoare naturale de drojdii nu trebuie folosite niciodată în același timp cu S. boulardii; această drojdie „prietenoasă” este la fel de vulnerabilă la lucruri precum oregano și arborele de ceai ca și drojdiile patogene.
O serie de alimente probiotice și prebiotice pot ajuta procesul de refacere a intestinului. Tom O’Bryan, DC, fondator al Gluten Summit și al programului de formare Certified Gluten Practitioner, recomandă mai multe alimente care trebuie consumate – și câteva care trebuie evitate – atunci când se reconstruiește intestinul după un tratament cu antibiotice.
„Când intestinul a fost compromis, nu doriți să îl supuneți la efort”, spune O’Bryan. Alimentele „solicitante” includ grâul, lactatele, zahărul, grăsimile nesănătoase și produsele prăjite. Aceste alimente, notează el, „aruncă benzină pe foc” unui sistem intestinal în curs de recuperare.
Pe de altă parte, ar trebui să se mănânce o mulțime de alimente care promovează creșterea organismelor comensale sănătoase. O’Bryan recomandă merele organice înăbușite, gătite până când sunt moi și strălucitoare, ca o opțiune bună. Gătitul merelor, explică el, eliberează pectină – o fibră solubilă care oferă combustibil pentru bacteriile benefice.
Pectina prezentă în merele înăbușite poate ajuta, de asemenea, la vindecarea unei mucoase intestinale deteriorate și la sigilarea rupturilor într-un intestin cu scurgeri, împiedicând moleculele mari de alimente să se strecoare prin el.
În mod similar, colagenul ajută la sigilarea unui intestin cu scurgeri. O’Bryan îi încurajează, de asemenea, pe pacienții care se recuperează în urma unui tratament cu antibiotice să consume bulion de oase de pui, o sursă bună de colagen, care acționează, de asemenea, ca un prebiotic natural, hrănind bacteriile sănătoase din intestin.
Butiratul – o substanță naturală produsă în intestin – este un alt jucător important în refacerea bacteriilor intestinale. O’Bryan explică faptul că celulele care căptușesc interiorul intestinului se reproduc rapid și că butiratul alimentează reconstrucția de noi celule. O producție insuficientă de butirat și o reînnoire lentă a celulelor intestinale fac organismul mai vulnerabil la dezvoltarea de celule canceroase, ceea ce duce la un risc mai mare de cancer de colon.
O serie de fructe și legume prebiotice, inclusiv alimente banane, cartofi dulci și alți tuberculi, ajută la reconstruirea microbiomului intestinal, oferind fibre insolubile care hrănesc bacteriile bune – dar nu și cele dăunătoare.
Legumele fermentate, nepasteurizate, cum ar fi varza murată, kimchi și sfecla fermentată, sunt o altă sursă excelentă de probiotice naturale. Fiecare legumă produce diferite familii de bacterii benefice în timpul fermentării, notează O’Bryan, încurajând pacienții să mănânce câte o furculiță de legume fermentate de două ori pe zi. „Cheia sănătății intestinului dumneavoastră este diversitatea microbiomului dumneavoastră”, susține el, subliniind că mii de familii diferite de bacterii trăiesc și interacționează în intestin, cu impacturi de amploare asupra sănătății noastre.
END