Michael D. Ober, MD
Christina M. Klais, MD
Emmett T. Cunningham Jr., MD, PhD, MPH
New York City
Makulärt ödem är en patologisk ansamling av extracellulär vätska i näthinnan, främst i de yttre plexiforma skikten och de inre nukleära skikten, som ett ospecifikt svar på ett sammanbrott i barriärerna mellan blod och näthinna. ME är en vanlig orsak till synförlust hos patienter med diabetes mellitus, retinal venös ocklusion, uveit och efter intraokulär kirurgi. Det förekommer mindre ofta i samband med vitreoretinal traktion, choroidal neovaskularisering och ett antal andra tillstånd. Många strategier har använts för att hantera ME med varierande framgång. I den här artikeln granskas de tillgängliga behandlingsalternativen för detta vanliga tillstånd.
 |
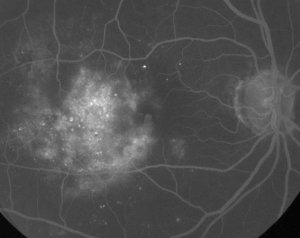 |
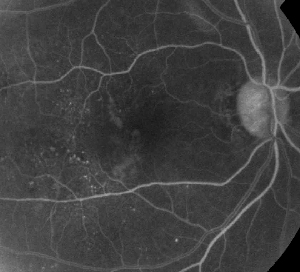
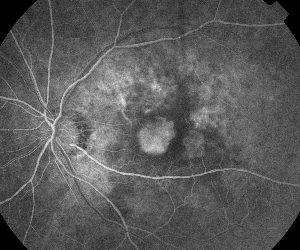
| Figur 1. A. Fluoresceinangiografi i tidig fas av en patient med icke-proliferativ diabetisk retinopati. Mikroaneurysm ses mest framträdande temporalt vid fovean utöver fluoresceinläckage i den foveala avaskulära zonen. | B. Sen fas FA av samma patient som visar diffust läckage temporalt till och inom den foveala avaskulära zonen som motsvarar diabetiskt makulaödem. |
Diagnos
Den kliniska diagnosen av ME ställs bäst med hjälp av en kontaktlins och stereoskopisk spaltlampa fundusbiomikroskopi. ME visar sig typiskt som en oregelbunden förhöjning i näthinnan, ofta i anslutning till intraretinala lipider, mikroaneurysm och/eller blödningar i fall som är sekundära till diabetes mellitus, vaskulär ocklusion eller ischemi. Intraretinell vätska kan också ansamlas i cystiska utrymmen lokaliserade till den parafoveala näthinnan med eller utan intilliggande vaskulära avvikelser. Detta cystoida makulaödem (CME) beror oftast på inflammation, lokaliserad dragning eller efter en operation.
Fluoresceinangiografi är ett viktigt verktyg vid diagnos av ME. I det normala ögat hindras fluorescein från att passera in i näthinnan av de blod-retinala barriärerna. Vid ME lämnar dock fluoresceinmolekylerna det intravaskulära utrymmet för att komma in i näthinnan. De drabbade områdena uppvisar hyperfluorescens i tidiga och mellersta bildrutor som ökar i yta och intensitet i senare bildrutor (se figur 1). FA framhäver inte bara ödem för enkel visualisering och lokalisering av behandling, utan skapar också en permanent registrering för framtida jämförelser. En kvantitativ skala med fyra grader har utvecklats för ME, där grad 0 är ingen perifoveal hyperfluorescens, grad 1 är ofullständig perifoveal hyperfluorescens, grad 2 är mild 360-graders hyperfluorescens, grad 3 är måttlig 360-graders hyperfluorescens med ett hyperfluorescerande område som är ungefär 1 skivdiameter tvärs över, och grad 4 är allvarlig 360-graders hyperfluorescens med ett hyperfluorescerande område som är ungefär 1,5 skivdiameter tvärs över.1,2 FA är ett känsligt sätt att identifiera förekomsten av ME, men det ger relativt lite information om den anatomiska fördelningen av vätskan, dvs. diffus vs. cystisk vs. subretinal, och läckans svårighetsgrad över tid. FA ger ingen kvantitativ information om förtjockning av näthinnan. Det är därför inte förvånande att detta tvådimensionella FA-baserade klassificeringssystem överlag korrelerar dåligt med synen.3,4
Optisk koherenstomografi (OCT III, Carl Zeiss) är en beröringsfri, icke-invasiv avbildningsteknik som utgör ett användbart komplement vid diagnostisering av ME. Den riktar en stråle av nära infrarött ljus (830 nm) vinkelrätt mot näthinnans yta och analyserar reflektionernas egenskaper. På 1,5 sekunder framställs en enda linjär tvärsnittsbild med hög upplösning. Dessa bilder kan visa och till och med mäta den förtjockade, cystiska näthinnan som finns i ödematösa områden. Den är också användbar för att visualisera egenskaperna hos det vitreoretinala gränssnittet och visar effektivt när dragning av glaskroppen spelar en roll i bildandet av ME (se figur 2).
En studie använde OCT för att undersöka 84 ögon med ME sekundärt till uveit, vilket gav den extra fördelen att det avslöjade eller bekräftade förekomsten av epiretinala membraner och serös näthinneavlossning i 41 respektive 20 procent av deras fall.5 Studien fann en måttlig korrelation mellan näthinnans tjocklek och minskad synskärpa, även om graden av korrelation har varierat mellan olika studier där andra undersökare rapporterat svaga,6 måttliga,7 och starka8,9,10 korrelationer med hjälp av olika statistiska metoder i olika patientpopulationer, inklusive patienter med diabetisk retinopati, uveit och CME.
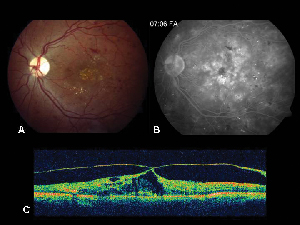
Figur 2. A. Färgfundusfotografi av vänster öga hos en patient med icke-proliferativ diabetisk retinopati och lipidexsudation i och runt fovean. B. FA i sen fas avslöjar makulaödem i den centrala makula. C. Optisk koherenstomografi visar det onormala vitreoretinala gränssnittet samt makulaödem.
En annan grupp rapporterade att OCT var lika effektiv som FA när det gäller att upptäcka ME och överlägsen FA när det gäller att beskriva den axiella fördelningen av vätska.6 OCT har också förmågan att identifiera vissa patienter med ME som inte visualiseras på FA, som i vissa fall av kronisk CME där den typ av aktivt läckage som bäst visualiseras med FA är minimal eller till och med frånvarande, eller när fundusundersökningen äventyras av närvaron av media opacitet, som hos patienter med asteroid hyalosis.11
Retinal thickness analyzer (RTA, Talia Technology, Israel) är en liknande beröringsfri avbildningsteknik som gör det möjligt att kvantifiera retinala tjocklek. Den producerar 16 parallella tvärsnittsskanningar över ett område på 3×3 kvadratmillimeter av näthinnan genom att analysera reflektioner från en snett riktad puls av grönt ljus (540 nm) som levereras under 0,3 sekunder. Både OCT och RTA har visat utmärkt precision i sina individuella mätningar av näthinnans tjocklek, och en direkt jämförelse av teknikerna har visat en statistiskt signifikant korrelation mellan deras mätningar. Medan RTA har fördelen av snabb förvärv med kanske färre artefakter, verkar den vara mindre effektiv vid mätning av näthinnans tjocklek än OCT i närvaro av media opaciteter.12
En annan studie jämförde foveal tjocklek med RTA och OCT i 30 friska ögon. Den genomsnittliga foveala tjockleken i de normala ögonen uppmättes till 181 µm och 153 µm för RTA respektive OCT. Författarna drog slutsatsen att RTA ibland ger falskt höga värden och därmed har minskad tillförlitlighet jämfört med OCT.13 Däremot visade en analys av patienter med mild icke-proliferativ diabetisk retinopati att RTA var känsligare än OCT när det gällde att identifiera områden med förtjockning av näthinnan under de inledande stadierna av diabetisk ME.14
 |
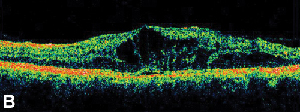 |
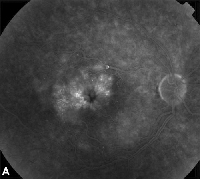
| Figur 3. A. Fluoresceinangiografi i sen fas av en patient med cystoidt makulaödem. | B. Optisk koherenstomografi som visar de stora cystiska utrymmena vid fovea. |
Behandlingar -Medicinska
Topiska icke-steroida antiinflammatoriska läkemedel är den vanligaste behandlingen för ME efter kataraktkirurgi (se figur 3). Dessa medel är inriktade på att minska de intraokulära prostaglandinnivåerna, som har involverats i ME:s patogenes. Dubbelmaskerade, randomiserade, aktiva och placebokontrollerade studier med patienter som genomgått kataraktkirurgi har rapporterat antiinflammatoriska effekter av lokalt applicerade 1 % indometacin, 0,03 % flurbiprofen, 0,5 % ketorolak och 0,1 % diklofenak oftalmiska preparat.15,16 Diklofenak 0,1 % och ketorolak 0,5 % oftalmiska lösningar är dock de enda lokalt applicerade NSAID-läkemedlen som är specifikt godkända av Food and Drug Administration för denna indikation. Terapi som kombinerar en topisk kortikosteroid och NSAID-droppar har visat sig ha större effekt vid behandling av ME än någon av de båda medicinerna ensamma.16 Även om de inte är FDA-godkända används topiska NSAID ofta före kataraktkirurgi för att förhindra postoperativ ME.
Oral acetazolamid används ibland vid behandling av ME sekundärt till inflammatoriska tillstånd och retinitis pigmentosa, särskilt när topiska NSAID och kortikosteroider inte fungerar. Flera prospektiva, maskerade, crossover-studier som jämför acetazolamid och placebo hos patienter med ME på grund av olika orsaker. I en crossover-studie med fem cykler på 41 patienter fann man ett reproducerbart svar, karakteriserat som antingen partiell eller fullständig upplösning av ME, hos mer än hälften av patienterna med ärftlig eller inflammatorisk näthinnesjukdom, men inget svar hos dem med primära kärlsjukdomar i näthinnan.17 Acetazolamid med 500 mg/dygn eller oralt visade sig vara effektivare än 250 mg/dygn vid behandling av ME hos patienter med ME sekundärt till RP.18 I denna studie observerades förbättring hos 10 av 12 behandlade patienter.
En annan grupp drog slutsatsen att patienter under 55 år med ME som tillskrivs kronisk iridocyklit var mer benägna att reagera på 500 mg acetazolamid b.i.d. än äldre patienter.19 I en nyligen genomförd studie har man föreslagit att acetazolamid också kan vara effektivt för behandling av diabetesinducerad ME.20
Cortikosteroider är potenta antiinflammatoriska medel som används ofta vid behandling av ME. De har flera verkningsmekanismer, bland annat stabilisering av den blod-retinala barriären och hämning av proinflammatoriska mediatorer. Tillförselformerna omfattar topisk, periokulär injektion, intravitreal injektion samt både oral och intravenös administrering. Även om orala och intravenösa kortikosteroider förvisso når terapeutiska nivåer i glaskroppen, utsätter de patienterna för en extra risk för systemiska komplikationer och är därför vanligen reserverade för patienter med synhotande uveit i samband med systemisk sjukdom. Topiska kortikosteroiddroppar befinner sig i andra änden av säkerhetsspektrumet, men deras förmåga att nå det bakre segmentet är begränsad.
Sub-Tenons injektioner erbjuder ett alternativ för att leverera relativt höga doser av kortikosteroider till ögat med lägre risker för systemiska komplikationer.21 Även om det inte har gjorts några randomiserade, kontrollerade studier har sub-Tenons kortikosteroidinjektion använts effektivt vid behandling av makulaödem i många år. Den vanligaste tekniken använder en kort 25-ga-nål som placeras genom den superotemporala bulbära konjunktivan i sub-Tenons utrymme medan patienten tittar inferonasalt. Nålen förs bakåt längs globen med en svepande rörelse från sida till sida för att förhindra oavsiktlig penetrering av globen, tills nålen når den konjunktivala ingångsstället, där läkemedlet ges. En rapport omfattade 20 konsekutiva patienter med intermediär uveit i samband med synförlust som behandlades med sub-Tenon-injektion av 40 mg triamcinolonacetonid.22 Även om inte alla patienter uppvisade ME på FA, förbättrades 67 procent med två synlinjer efter en behandling. Risker med detta förfarande är bland annat ihållande förhöjt intraokulärt tryck, katarakt, ptos och intraokulär penetration.
Nyligen har användningen av intravitreal injektion av triamcinolonacetonid (Kenalog, 4,0 mg) ökat på grund av dess potenta förmåga att förbättra refraktär ME sekundärt till diabetes mellitus (se figur 4), retinala venösa ocklusioner, inflammation och andra idiopatiska orsaker.23-26 Preliminära studier visar en dramatisk minskning av förtjockning av näthinnan, minskat fluoresceinläckage och visuell förbättring, som kan vara markant hos vissa patienter. Även om effekten är tillfällig och vanligtvis varar i tre till sex månader eller mindre, reagerar ME vanligtvis på återinjektion. Användningen av intravitreala kortikosteroider är dock förknippad med en 30-40-procentig risk för ihållande förhöjt intraokulärt tryck och en cirka 10-procentig risk för katarakt som kräver operation. National Eye Institute håller för närvarande på att rekrytera patienter till SCORE, studien Standard care vs. corticosteroid for retinal vein occlusion, som jämför intravitreala injektioner av triamcinolon (1- och 4-mg-doser) med standardbehandling (observation och/eller gridlaserbehandling) hos patienter med ME sekundärt till venerocklusion. Studien kommer att följa totalt 1 260 patienter och fortsätta behandlingen i 36 månader.
ME förekommer också i samband med åldersrelaterad makuladegeneration (se figur 5). Intravitreal injektion av triamcinolonacetonid undersöks för närvarande för kombinerad användning med fotodynamisk terapi för behandling av neovaskulär AMD (Visudyne med intravitreal triamcinolonacetonid, VisTA). En studie betonar vikten av intravitrealt triamcinolon före tillämpningen av PDT hos patienter med makulaödem och CNV.27 Författarna teoretiserar att verteporfin kan läcka in i cystiska intraretinala utrymmen vilket leder till fotoreceptorskador på intilliggande, normal näthinna när läkemedlet fotoaktiveras, medan föregående upplösning av näthinneödem kan förhindra denna komplikation. Förhandsadministrering av kortikosteroid kan också tjäna till att dämpa en PDT-inducerad förhöjning av intraokulära VEGF-nivåer.
Intravitreala injektioner i sig är förknippade med små, men bestämda risker för allvarliga, potentiellt bländande biverkningar, inklusive infektiös endoftalmit, näthinneavlossning, blödning, okulär hypertoni, grå starr och hypotoni.28 Nyligen publicerade riktlinjer för intravitreala injektioner försöker fastställa ett tillvägagångssätt med bästa praxis för denna alltmer använda teknik. Konsensuspanelens rekommendationer tog upp överväganden före injektion, inklusive antibiotika, glaukomutvärdering, användning av handskar och behandling av redan existerande ögonlockavvikelser, samt vikten av att undvika överdriven manipulation av ögonlocket före och under ingreppet. Den rekommenderade behandlingen före injektion omfattade användning av lokal och/eller subkonjunktival bedövning, lokal povidonjod och en ögonlocksspekulum. Författarna betonade vikten av att övervaka IOP och direkt fundusvisualisering efter injektionen för att verifiera perfusion av synnerven, intravitreal placering av triamcinolon och frånvaro av injektionsassocierad blödning eller näthinneavlossning. De betonade också vikten av patientutbildning gentemot tidiga symtom på potentiella komplikationer och noggrann uppföljning.29
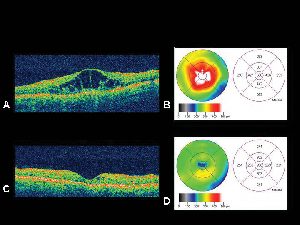
Figur 4. A. Optisk koherenstomografibild av ett öga med diabetiskt makulaödem med motsvarande näthinnetjocklekskartaB. som genereras av OCT. C. OCT av samma patient en månad efter intravitreal injektion av triamcinolonacetonid med motsvarande karta över näthinnans tjocklek. D. Upplösning av makulaödemet. Synskärpan förbättrades från 20/200 till 20/80 efter behandlingen.
I flera försök undersöks alternativa långtidstillförselanordningar för kortikosteroider för användning i ögat. En studie omfattar kirurgisk placering av en fluocinolonacetonidpellet inbäddad på en plaststrut med kontrollerad frisättning av steroider under tre år. Den kallas Envision intravitreal implantat, av Bausch & Lomb och Control Delivery Systems, och placeras genom pars plana och sys fast vid sklera. I en randomiserad, maskerad fas II/III-studie jämfördes Envision TD-implantatet hos 80 patienter som randomiserats till 0,5 vs 2,0 mg fluokinolonacetonid jämfört med standardbehandling bestående av laserfotokoagulering eller observation. Efter sex månader sågs en statistiskt signifikant minskning av ME och svårighetsgraden av diabetisk retinopati med 0,5-mg-implantatet jämfört med standardvård. Dessutom fanns det inga skillnader i förekomsten av allvarliga biverkningar. Studien med 2,0 mg-delen av studien stoppades i förtid på grund av de resultat som observerades i en andra studie där ingen fördel jämfört med 0,5 mg noterades. I en andra studie rekryterades 278 patienter med icke-infektiös bakre uveit som randomiserades för att få antingen ett Retisert-implantat på 0,59 mg eller 2,1 mg i det drabbade ögat eller, i bilaterala fall, i det hårdare drabbade ögat. Efter två doser och 34 veckor fanns det en signifikant lägre återfallsfrekvens i ögon med implantat (10 vs 55,7 procent, p<0,0001) med en minskad användning av systemisk kortikosteroid/immunosuppressiv behandling (59,0 procent vid baslinjen vs 13,7 procent vid 34 veckor) samt användning av subtennon och topiska steroider. Det fanns en signifikant förbättring av synskärpan (p<0,05). De vanligaste biverkningarna var kataraktprogression och ökat intraokulärt tryck som krävde ett filtreringsförfarande hos 8,6 procent. (Jaffe G. Invest Ophthalmol Vis Sci. 2004; 44 ARVO E-Abstract #3369.)
En annan prövning gäller Allergans Posurdex, en bioerodbar dexametasonpellets som injiceras i glaskroppsutrymmet och som släpper ut medicinen under 50 till 160 dagar. Resultaten av en fas II-studie visade att både en pellet på 350 µg och 700 µg signifikant förbättrade andelen patienter med två linjer eller mer i synförbättring (27,2 procent och 35,7 procent för 350 µg respektive 700 µg) samt tre linjer eller mer i synförbättring (13 procent och 19,4 procent för 350 µg respektive 700 µg) vid 180 dagar jämfört med placebo. Hittills har det inte rapporterats någon ökad förekomst av katarakt, även om IOP-ökningar sågs hos cirka15 procent av patienterna.
Behandlingar -Laser
Nast nyligen studerades Eyetechs och Pfizers Macugen i en randomiserad, dubbelmaskerad, multicenter, doseringsanpassad, kontrollerad fas II-studie på 172 patienter med diabetisk ME. I studien undersöktes tre doser (0,3 mg, 1,0 mg, 3,0 mg) mot skeninjektioner som gavs var sjätte vecka under tre injektioner. Medan tidigare utredare av fokal/gridlaser ombads att endast rekrytera patienter hos vilka de kände sig bekväma med att skjuta upp fokal/gridlaser i minst 12 veckor. Ytterligare injektioner och/eller fokal/grid-fotokoagulation gavs efter prövarens gottfinnande från vecka 18 till 30. Slutbedömningar genomfördes vid vecka 36, sex veckor efter den sista planerade injektionen. Sammantaget hade försökspersoner som tilldelats Macugen bättre synresultat, hade större sannolikhet att visa en minskning av den centrala näthinnetjockleken och bedömdes ha mindre sannolikhet att behöva ytterligare laserbehandling jämfört med skenpatienter.31 En bekräftande fas III-studie planeras för närvarande.
Fokal/gridlaserfotokoagulering förblir standardbehandlingen för behandling av diabetisk ME. Early Treatment Diabetic Retinopathy Study visade att patienter som behandlades med gridlaser hade en 50-procentig minskning av måttlig synförlust, definierad som en fördubbling av synvinkeln eller en minskning av synen med tre linjer, jämfört med observation.30 Även om den exakta mekanismen genom vilken laser minskar ME är okänd, tros den främja bildandet av tighta junctions mellan RPE-cellerna samt minska syrebehovet från fotoreceptorerna och öka syreperfusionen från aderhinnan.31 EDTRS identifierade patienter som är berättigade till fokal laserfotonokokulering som har kliniskt betydande ME. Detta definierades som att de uppfyllde ett av följande tre kriterier: 1) Förtjockning av näthinnan inom 500 µm från fovea, 2) hårda exudat mindre än 500 µm från fovea i samband med intilliggande förtjockning av näthinnan, eller 3) ett område med ödem med en diameter på minst 1 skivdiameter, där någon del är belägen mindre än 1 skivdiameter från fovea. EDTRS skiljer dock inte mellan fokal ME, som motsvarar en lokal förtjockning av näthinnan i anslutning till mikroaneurysm, och diffus ME, som avser en generaliserad förtjockning av den bakre polen. Anekdotiska bevis visar att fokal diabetisk ME svarar bra på fokal/grid laser medan den diffusa varianten oftare misslyckas med laserbehandling och kräver alternativ behandling.
 |
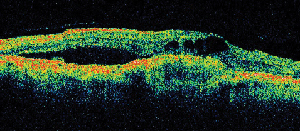 |
| Figur 5. A. Tidigt fluoresceinangiogram som visar klassisk subfoveal neovaskularisering. | B. Motsvarande optisk koherenstomografi avslöjar områden med subretinal och intraretinell vätskeansamling samt visar neovaskulariseringen (pil). |
Behandlingar -Kirurgi
Den första gruppen som rapporterade fördelarna med vitrektomi och separation av den bakre hyaloidmuskeln hos patienter med diabetes-ME antydde att det finns en undergrupp av patienter där glaskroppens dragning och ytliga makuladragningar bidrar till förtjockning av näthinnan.32 Detta har senare bekräftats med OCT, vilket har lett till att indikationerna för denna teknik har förfinats.33,34 De tre största serierna35,36,37 av patienter som genomgått vitrektomi för diabetisk ME som inte svarat på mindre invasiva behandlingar analyserade 59, 58 respektive 65 patienter. De rapporterade att 47 procent, 53 procent respektive 45 procent av deras patienter förbättrade sin syn med två linjer eller mer. Den sista av dessa rapporterade allvarliga postoperativa komplikationer utvecklades hos en minoritet av patienterna inklusive näthinneavlossning (1,5 procent), rubeosis iridis (4,6 procent) epiretinal membran (13,8 procent), återkommande glaskroppsblödning(1,5 procent) och foveala hårda exsudatavlagringar (4,6 procent) medan komplikationerna som avslöjades av den andra gruppen inkluderade epiretinal membran hos 10,2 procent och katarakt hos 63,2 procent av de phakaka ögon. Flera andra fallserier har visat liknande resultat, men alla var icke-randomiserade, utan placebokontroll och med olika inklusions- och exklusionskriterier. Vidare har de kirurgiska teknikerna också skiljt sig åt, vilket gör att de exakta indikationerna för vitrektomi hos patienter med CME är öppna för tolkning.
ME förblir en viktig orsak till synförlust trots de olika tillgängliga behandlingarna. Laserfotokoagulering förblir en integrerad del av behandlingen av ME på grund av diabetes, ischemi och vaskulära ocklusioner. Topiska NSAID och kortikosteroider är för närvarande den primära metoden för att kontrollera postoperativ ME, medan acetazolamid fortfarande är ett effektivt sätt att behandla hos utvalda patienter med ME sekundärt till uveit och retinitis pigmentosa. Intravitreala kortikosteroider spelar en allt viktigare roll i behandlingen av ME, men begränsas fortfarande av biverkningar och effekttid. Förfinade kirurgiska tekniker kommer att fortsätta att tillföra en ny dimension till ME som inte svarar på mindre invasiv behandling, medan framsteg inom läkemedelsbehandling och okulär läkemedelstillförsel lovar att spela en roll i förebyggande och behandling av alla orsaker och typer av ME.
Dr Ober är stipendiat i vitreoretinal kirurgi vid Edward S. Harkness Eye Institute vid Columbia University College of Physicians and Surgeons och LuEsther T. Mertz Retinal Research Center vid Manhattan Eye, Ear, and Throat Hospital. Kontakta honom på 210 East 64th St., 8th Fl, New York, NY 10021; e-post: [email protected]; eller (212) 605 3777 eller fax (212) 605 3795.
Dr Klais är retina fellow vid LuEsther T. Mertz Retinal Research Center. Kontakta henne på samma adress, telefon- eller faxnummer eller via e-post på [email protected].
Dr Cunningham är klinisk professor i oftalmologi och chef för Uveitis Service vid New York University, School of Medicine. Han är också anställd av Eyetech Pharmaceuticals Inc. Kontakta honom på Vitreous-Retina-Macula Consultants of New York, 460 Park Ave., New York, N.Y. 10022, via e-post [email protected], eller via telefon/fax på (212) 861 9797.
1. Spaide RF, Yannuzzi LA, Sisco LJ. Kroniskt cystoidt makulaödem och prediktorer för synskärpa. Ophthalmic Surg 1993;24:262-267.
2. Yannuzzi LA. Ett perspektiv på behandlingen av aphakiskt cystoidt makulaödem. Surv Ophthalmol 1984;28:540-553
3. Chang A, Spaide RF, Yannuzzi LA. Postoperativt cystoidt makulaödem. In: Guyer DR, Yannuzzi LA, Chang S, et al. Retina, Vitreous, Macula. Saunders. Philadelphia. 1999;1:239-255.
4. Nussenblatt RB, Kaufman SC, Palestine AG, et al. Macular thickening and visual acuity. Mätning hos patienter med cystoidt makulaödem. Ophthalmology 1987;94:1134-9.
5. Markomichelakis NN, Halkiadakis I, Pantelia E, et al. Mönster av makulaödem hos patienter med uveit: kvalitativ och kvantitativ bedömning med hjälp av optisk koherenstomografi. Ophthalmology 2004;111:946-53.
6. Antcliff RJ, Stanford MR, Chauhan DS, et al. Jämförelse mellan optisk koherenstomografi och fundus fluoresceinangiografi för upptäckt av cystoidt makulaödem hos patienter med uveit. Ophthalmology 2000; 107:593-9.
7. Otani T, Kishi S, Maruyama Y. Patterns of diabetic macular edema with optical coherence tomography. Am J Ophthalmol 1999;127:688-93.
8. Hee MR, Puliafito CA, Wong C, et al. Kvantitativ bedömning av makulaödem med optisk koherenstomografi. Arch Ophthalmol 1995;113:1019-29.
9. Nussenblatt RB, Kaufman SC, Palestine AG, et al. Macular thickening and visual acuity. Mätning hos patienter med cystoidt makulaödem. Ophthalmology 1987;94:1134-9.
10. Ozdek SC, Erdinc MA, Gurelik G, et al. Optical coherence tomographic assessment of diabetic macular edema: comparison with fluorescein angiographic and clinical findings. Ophthalmologica 2005;219:86-92.
11. Browning DJ, Fraser CM. Optisk koherenstomografi för att upptäcka makulaödem i närvaro av asteroid hyalos. Am J Ophthalmol 2004;137:959-961.
12. Polito A, Shah SM, Haller JA et al. Comparison between retinal thickness analyzer and optical coherence tomography for assessment of foveal thickness in eyes with macular disease. Am J Ophthalmol 2002;134:240-51.
13. Neubauer AS, Priglinger S, Ullrich S, et al. Comparison of foveal thickness measured with the retinal thickness analyzer and optical coherence tomography. Retina 2001;21:596-601.
14. Pires I, Bernardes RC, Lobo CL, Soares MA, Cunha-Vaz JG. Retinal tjocklek i ögon med mild icke-proliferativ retinopati hos patienter med typ 2-diabetes mellitus: jämförelse av mätningar som erhållits med retinal tjockleksanalys och optisk koherenstomografi. Arch Ophthalmol 2002 Oct;120(10):1301-6.
15. Flach AJ. Cyklooxygenashämmare inom oftalmologin. Surv Ophthalmol 1992;36:259-284.
16. Heier JS, Topping TM, Baumann W, Dirks MS, Chern S. Ketorolac kontra prednisolon kontra kombinationsbehandling vid behandling av akut pseudophakiskt cystoidt makulaödem. Ophthalmology 2000;107:2034-8.
17. Cox SN, Hay E, Bird AC. Behandling av kroniskt makulaödem med acetazolamid. Arch Ophthalmol 1988;106:1190-5.
18. Fishman GA, Gilbert LD, Fiscella RG, Kimura AE, Jampol LM. Acetazolamid för behandling av kroniskt makulaödem vid retinitis pigmentosa. Arch Ophthalmol 1989;107:1445-52.
19. Farber MD, Lam S, Tessler HH, Jennings TJ, Cross A, Rusin MM. Reduktion av makulaödem med acetazolamid hos patienter med kronisk iridocyklitis: en randomiserad prospektiv crossover-studie. Br J Ophthalmol 1994;78:4-7.
20. Giusti C, Forte R, Vingolo EM, Gargiulo P. Är acetazolamid effektivt vid behandling av diabetiskt makulaödem? En pilotstudie. Int Ophthalmol 2001;24:79-88.
21. Jennings T, Rusin MM, Tessler HH, Cunha-Vaz JG. Posteriora sub-Tenon-injektioner av kortikosteroider hos uveitpatienter med cystoidt makulaödem. Jpn J Ophthalmol 1988;32:385-91.
22. Helm CJ, Holland GN. Effekterna av posterior subtenoninjektion av triamcinolonacetonid hos patienter med intermediär uveit. Am J Ophthalmol 1995;120:55-64.
23. Benhamou N, Massin P, Haouchine B, Audren F, et al. Intravitrealt triamcinolon för refraktärt pseudophakiskt makulaödem. Am J Ophthalmol 2003;135:246-9.
24. Jonas JB, Kreissig I, Degenring RF. Intravitrealt triamcinolonacetonid som behandling av makulaödem vid central retinal veneocclusion. Graefes Arch Clin Exp Ophthalmol. 2002;240:782-3.
25. 25. Martidis A, Duker JS, Greenberg PB, Rogers AH, et al. Intravitreal triamcinolon för refraktärt diabetiskt makulaödem. Ophthalmology 2002; 109: 920-7.
26. 26. Scott IU, Flynn HW Jr., Rosenfeld PJ. Intravitreal triamcinolonacetonid för idiopatiskt cystoidt makulaödem. Am J Ophthalmol 2003;136:737-9.
27. 27. Freund KB, Klais CM, Eandi CM, et al. Sequenced Combined Intravitreal Triamcinolone and Indocyanine Green Angiography Guided Photodynamic Therapy for Retinal Angiomatous Proliferation. Arch Ophthalmol, In Press.
28. 28. Jager RD, Aiello LP, Patel SC, Cunningham ET Jr. Risker med intravitreal injektion: en omfattande genomgång. Retina. 2004 Oct;24(5):676-98.
29. 29. Aiello LP, Brucker AJ, Chang S, et al. Evolving guidelines for intravitreal injections. Retina 2004 Oct;24(5 Suppl):S3-19.
30. .G.Jaffe, Fluocinolonacetonid Uveitis Study Group. Fluocinolonacetonid intravitrealt implantat för uveit som påverkar ögats bakre segment. ARVO 2004, poster #3369.
31. Macugen Diabetic Retinopathy Study Group. En randomiserad, dubbelmaskerad fas II-studie av pegaptanib, en aptamer mot vaskulär endotelial tillväxtfaktor, för diabetiskt makulaödem. Ophthalmology, In press.
32. 30. Fotokoagulering vid diabetiskt makulaödem. Early Treatment Diabetic Retinopathy Study report number 1. Arch Ophthalmol 1985;103:1796-806.
33. Christoforidis JB, D’Amico DJ. Kirurgiska och andra behandlingar av diabetiskt makulaödem: en uppdatering. Int Ophthalmol Clin 2004;44:139-60.
34. Lewis H, Abrams GW, Blumenkranz MS, Campo RV. Vitrektomi vid diabetisk makuladragning och ödem i samband med bakre hyaloidal dragning. Ophthalmology 1992;99:753-9.
35. Kaiser PK, Riemann CD, Sears JE, Lewis H. Macular traction detachment and diabetic macular edema associated with posterior hyaloidal traction. Am J Ophthalmol 2001;131:44-9.
36. Lewis H. The role of vitrectomy in the treatment of diabetic macular edema. Am J Ophthalmol 2001;131:123-5.
37. Pendergast SD. Vitrektomi för diabetiskt makulaödem i samband med en stram premacular posterior hyaloid. Curr Opin Ophthalmol 1998;9:71-5.
38. Tachi N, Ogino N. Vitrectomy for diffuse macular edema in cases of diabetic retinopathy. Am J Ophthalmol 1996;122:258-60.
39. Yamamoto T, Hitani K, Tsukahara I, Yamamoto S, et al. Early postoperative retinal thickness changes and complications after vitrectomy for diabetic macular edema. Am J Ophthalmol 2003;135:14-9.