Så länge det finns substrat tillgängligt att binda till kommer en ökad enzymkoncentration att påskynda den enzymatiska reaktionen. När allt substrat är bundet kommer reaktionen inte längre att påskyndas med den ökande enzymkoncentrationen, eftersom det inte finns något för ytterligare enzymer att binda till.
Hur fungerar enzymer?
Enzym är ett katalytiskt protein som kan påskynda den kemiska reaktionen utan att förändras i reaktionsprocessen. I reaktionsprocessen bildas ingen bindning mellan enzymet och substratet, så enzymet återgår till sin ursprungliga form och kan användas igen. Enzymet binder till substratet genom den aktiva platsen för att bilda ett enzym-substratkomplex. De är mycket specifika i reaktionen och även för det substrat de binder sig till. När substratets form matchar enzymets aktiva plats är enzymets funktion korrekt, och deras funktion är beroende av dess tredimensionella struktur. De underlättar reaktionen genom att minska aktiveringsenergin och aktivera fler molekyler, vilket gör att katalysatorn utförs.
Effekt av enzymkoncentration
Enzymkoncentrationen är viktig i en kemisk reaktion eftersom den behövs för att reagera med substratet. Ofta kan en liten mängd enzym förbruka en stor mängd substrat. Men med ökningen av enzymkoncentrationen ökar också effektiviteten hos de aktiva platserna, så att dessa aktiva platser omvandlar substratmolekylerna till produkter. Detta innebär i princip att om enzymkoncentrationen ska ökas måste det finnas ett överskott av substrat, vilket med andra ord innebär att reaktionen måste vara oberoende av substratkoncentrationen.
Zero-orderreaktion
För att kunna studera effekten av att öka enzymkoncentrationen på reaktionshastigheten måste substratet finnas i en överskottsmängd, dvs. reaktionen måste vara oberoende av substratkoncentrationen. Varje förändring i mängden produkt som bildas under en bestämd tidsperiod kommer att vara beroende av mängden närvarande enzym. Grafiskt kan detta representeras på följande sätt:
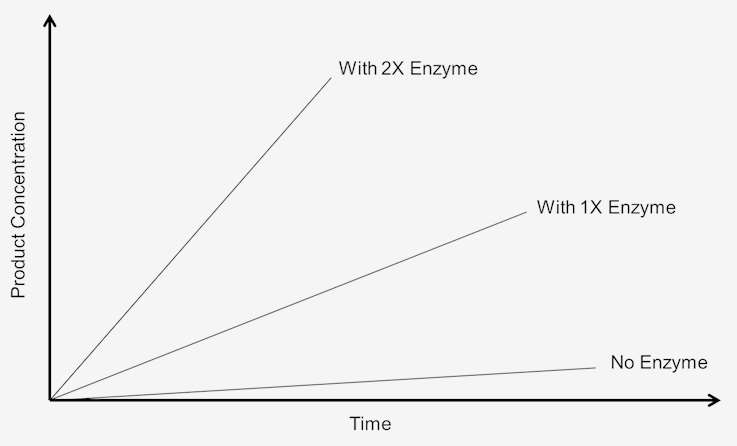 Figur 1. Reaktionshastigheten i nollordning är beroende av substratkoncentrationen.
Figur 1. Reaktionshastigheten i nollordning är beroende av substratkoncentrationen.
Dessa reaktioner sägs vara ”nollordningsreaktioner” eftersom hastigheterna är oberoende av substratkoncentrationen. Produktbildningen sker med en hastighet som är linjär med tiden. Tillsats av mer substrat tjänar inte till att öka hastigheten. Vid nollordningskinetik resulterar det faktum att man låter analysen löpa under dubbel tid i en dubbelt så stor mängd produkt.
Mängden enzym som finns i en reaktion mäts genom den aktivitet som den katalyserar. Förhållandet mellan aktivitet och koncentration påverkas av många faktorer som temperatur, pH, etc. En enzymanalys måste utformas så att den observerade aktiviteten är proportionell mot mängden närvarande enzym för att enzymkoncentrationen ska vara den enda begränsande faktorn. Det är endast uppfyllt när reaktionen är av nollordning.
Relaterade tjänster
Enzymkinetik
Enzymologiska analyser
För att diskutera fler detaljer om tjänsterna, vänligen kontakta oss genom att ringa 1-631-562-8517, eller skicka ett e-postmeddelande till oss på [email protected].