Los antibióticos erradican las infecciones patógenas y salvan vidas – pero al hacerlo, también alteran la integridad del microbioma intestinal. Aunque muchos médicos reconocen la necesidad de restablecer el equilibrio microbiano de un paciente tras un tratamiento con antibióticos, son muchos menos los que entienden cómo hacerlo de forma eficaz.
Según Amie Skilton, ND, el restablecimiento de la flora intestinal es tanto un arte como una ciencia. Si se hace bien, puede suponer una gran diferencia para los pacientes. En algunos casos, puede incluso ayudar a los pacientes a superar las enfermedades para las que se prescribieron inicialmente los antibióticos.
Pero hace falta algo más que recomendar un probiótico comercial y esperar lo mejor.
Los Centros para el Control de Enfermedades informaron la pasada primavera de que de los 154 millones de recetas de antibióticos que se hacen cada año en las consultas médicas y en los servicios de urgencias, el 30% son innecesarias. La mayor parte de las recetas innecesarias, según los CDC, se prescriben para afecciones respiratorias causadas por virus, como resfriados comunes, dolores de garganta virales, bronquitis e infecciones de los senos nasales y del oído, que no responden a los antibióticos. El uso de estos fármacos «expone a los pacientes a un riesgo innecesario de sufrir reacciones alérgicas o la diarrea, a veces mortal, de Clostridium difficile».
Para complicar aún más el panorama, los antibióticos no sólo se dispersan en las consultas de los médicos, sino que también se administran generosamente al ganado y se rocían ampliamente en los productos agrícolas, dejando rastros diminutos pero biológicamente activos en los alimentos que luego consumen los humanos.
La dosis y el momento determinan el impacto
Como los antibióticos eliminan los microorganismos que causan infecciones, también destruyen de forma no selectiva las comunidades de bacterias intestinales beneficiosas, debilitando la estabilidad del microbioma intestinal. Esta destrucción generalizada puede ser masiva; los datos experimentales recogidos en un estudio en el que se utilizó la qPCR indican una reducción de hasta 10 veces en los aislados bacterianos inmediatamente después del tratamiento con antibióticos (Panda, S. et al. PLoS One. 2014; 9(4): e95476).
«Es realmente un efecto diezmador», dice el doctor Skilton, médico naturista y herborista de la Clínica Elysium de Medicina Natural, en Sídney, Nueva Gales del Sur, Australia.
En un seminario web patrocinado por Holistic Primary Care and Bioceuticals, expuso los innumerables impactos de los antibióticos en el microbioma humano, señalando que no todos los antibióticos son igualmente destructivos para las bacterias intestinales.
El grado en que estos medicamentos dañan la microbiota intestinal depende del tipo de fármaco, la duración del tratamiento y la frecuencia de uso, dijo Skilton. Algunos antibióticos, por ejemplo, desencadenan una mayor liberación de endotoxinas y citoquinas que otros. Las dosis diarias más altas tienen un mayor impacto. El uso prolongado de altas dosis de antibióticos puede causar un daño extremo al microbioma que puede requerir años de terapia restauradora para revertirlo, si es que puede revertirse.
Y en contra de la creencia común, los antibióticos intravenosos pueden tener el mismo impacto negativo en la flora intestinal que los medicamentos orales. «Durante mucho tiempo se pensó que los fármacos intravenosos no pasaban por el intestino y no tenían el mismo impacto. Ahora sabemos que esto no es cierto»
El momento de la administración de los antibióticos también marca la diferencia. Las personas que utilizan frecuentemente antibióticos en los primeros años de vida son más vulnerables a muchos tipos de enfermedades a medida que envejecen. En un artículo publicado a principios de este año, los investigadores demostraron una asociación entre el uso de antibióticos durante la infancia y los posteriores malos resultados neurocognitivos, lo que sugiere que el consumo de antibióticos en el primer año de vida de un paciente se asoció con diferencias pequeñas pero estadísticamente significativas en las medidas cognitivas, de comportamiento y de estado de ánimo durante la infancia (Slykerman, R. et al. Acta Paediatr. 2017; 106(1): 87-94).
Otros han relacionado la exposición fetal y en la primera infancia a los antibióticos con el posterior desarrollo de asma más adelante en la vida (Örtqvist, A. et al. Brit Med J. 2014; 349. doi: https://doi.org/10.1136/bmj.g6979). Los antibióticos también se han asociado con la obesidad y el aumento de peso tanto en niños como en adultos (Million, M. et al. Clin Microbiol & Infec. 2013; 19(4): 305-313). Los investigadores atribuyen estos cambios a la alteración de la composición microbiana intestinal.
Los antibióticos pueden desencadenar la liberación de lipopolisacáridos tóxicos (LPS), grandes moléculas que se encuentran en las membranas externas de las bacterias Gram negativas patógenas. Algunos sugieren que la liberación de LPS inducida por los antibióticos puede contribuir al desarrollo de un shock séptico en pacientes tratados por infecciones graves causadas por bacterias Gram negativas. Otros han demostrado que el LPS desencadena una respuesta inmunitaria mediante la liberación de citoquinas inflamatorias, un problema que se agrava tras el tratamiento con antibióticos, señaló Skilton en su seminario web (Wu, T. et al. Toxicol Lett. 2009; 191(2-3): 195-202).
Desde el punto de vista de un patógeno, la producción de LPS es una estrategia de supervivencia. Estas moléculas interactúan en las superficies celulares para formar una barrera, impidiendo la entrada de los antibióticos y otros compuestos hidrofóbicos y permitiendo que las bacterias Gram negativas vivan incluso en entornos difíciles (Zhang, G. et al. Curr Opin Microbiol. 2013; 16(6): 779-785).
Cómo restaurar la flora
Los probióticos son un aspecto en una estrategia integral para restaurar la flora intestinal después de los antibióticos. Dada la diversidad microbiana de un ecosistema intestinal sano, Skilton recomienda utilizar productos que contengan muchas especies diferentes de microbios beneficiosos en lugar de hacer un «monocultivo» con una o dos cepas únicas.
Como regla general, aconseja un mes de tratamiento probiótico por cada semana que el paciente haya tomado antibióticos. Aquellos que han estado en regímenes prolongados de antibióticos continuos, también necesitarán una restauración a largo plazo. Subrayó que, para la mayoría de las personas, no existen riesgos para la salud asociados a la suplementación probiótica prolongada.
Los pacientes que reciben antibióticos por vía intravenosa también deberían tomar probióticos comensales. Algunos médicos que son conscientes de este problema comenzarán a tomar probióticos tan pronto como cuatro horas después de una dosis de antibióticos por vía intravenosa.
Reconstrucción del glicocálix
Las personas que han estado en cursos de antibióticos a largo plazo o múltiples suelen mostrar una erosión severa del glicocálix que normalmente recubre las microvellosidades intestinales. Esto suele ir acompañado de una pérdida de los bordes en cepillo y una marcada reducción de la producción de IgA secretora.
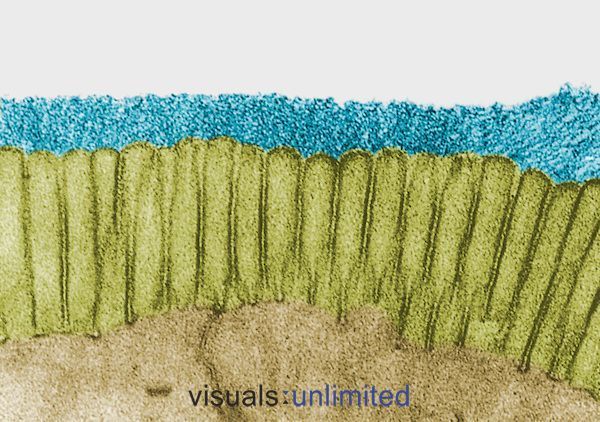 En algunos casos, estos cambios son causados por los efectos de los propios antibióticos. En otros, reflejan el impacto de la infección para la que se prescribieron los antibióticos. De cualquier manera, el efecto es el mismo: el establecimiento de un microambiente que es hospitalario para los patógenos oportunistas como Candida, pero cada vez más difícil para las bacterias comensales normales.
En algunos casos, estos cambios son causados por los efectos de los propios antibióticos. En otros, reflejan el impacto de la infección para la que se prescribieron los antibióticos. De cualquier manera, el efecto es el mismo: el establecimiento de un microambiente que es hospitalario para los patógenos oportunistas como Candida, pero cada vez más difícil para las bacterias comensales normales.
Las infecciones fúngicas casi siempre van acompañadas de una producción insuficiente de IgA, ya que Candida consume tanto el glicocálix como la sIgA como combustibles. Se convierte en un círculo vicioso: la baja IgA engendra a la Cándida, que agota aún más la IgA. Las infecciones crónicas del tracto urinario y las infecciones de la mucosa, como la candidiasis, son señales de alarma de una baja producción de sIgA, señaló Skilton.
Sin un glicocáliz sano, organismos como los lactobacilos y los bifidobacilos tienen grandes dificultades para establecerse. En este contexto, la suplementación con probióticos ordinarios suele fracasar.
«Incluso si se recomiendan los mejores probióticos del mundo, no hay forma de que se adhieran y colonicen si el glicocálix está erosionado», explicó el Dr. Skilton. «De hecho, se pueden exagerar los síntomas gastrointestinales con la administración de probióticos si se pierde la capacidad de producir glicocálix».
Para restablecer un microambiente más saludable en estos casos, hay que aprovechar las características únicas de Saccharomyces boulardii, una levadura probiótica resistente a los antibióticos que se aisló originalmente de la fruta del lichi en Indochina. Aunque no es un verdadero organismo comensal, S. boulardii es un potente inductor de la producción de glicocálix y de la secreción de IgA. También estimula las enzimas del borde en cepillo y promueve la producción de poliaminas, lo que alimenta las microvellosidades intestinales y puede ser útil para la curación de la colitis ulcerosa, la enfermedad de Crohn y el síndrome del intestino irritable.
S. boulardii es capaz de actuar en el contexto de bacterias altamente patógenas resistentes a los antibióticos como Clostridium difficile y, de hecho, se ha utilizado como terapia preventiva contra la diarrea asociada a C. difficile (Goldstein, E. et al. Clin Infect Dis. 2015; 60 (suppl_2): S148-S158). S. boulardii puede reducir algunos de los efectos tóxicos de la enterotoxina A al inhibir la unión del receptor de la toxina A y prevenir la formación de la enterotoxina B.
Pero lo más destacable es su capacidad para colonizar rápidamente el endotelio dañado y desplazar a las levaduras patógenas al tiempo que crea un microambiente más saludable para las bacterias comensales. «S. boulardii fuerza realmente una evacuación física de la cándida», dijo el Dr. Skilton, señalando que es específicamente activo contra 7 de las 8 especies de cándida patógenas más comunes. La única excepción es la C. tropicalis.
«Piense en la situación como las consecuencias de un huracán que golpea un pueblo. Los antibióticos son el huracán. S. boulardii es como el contratista que llega y repara los daños del pueblo. Entonces se puede repoblar la aldea con comensales».
BioCeuticals, una empresa australiana de nutracéuticos sólo para profesionales, ha presentado recientemente un producto llamado SB Floractiv, que proporciona 250 mg de S. boulardii (también llamado S. cereviciae) por cápsula.
Para los pacientes que han estado tomando antibióticos a largo plazo, hay que empezar lentamente con una cápsula (250 mg) al día durante 3 ó 4 días, luego aumentar a dos al día durante otros 3 ó 4 días, y luego aumentar en un patrón gradual similar hasta cuatro al día (1.000 mg) que debe continuarse durante el resto de un período de 4 semanas.
S. boulardii es muy seguro, y la única contraindicación real es en pacientes con verdaderas reacciones mediadas por IgE a las levaduras, que se manifiestan como anafilaxia o  urticaria. Dicho esto, es importante tener en cuenta que en los primeros días de toma de S. boulardii, algunos pacientes pueden experimentar un notable «lavado intestinal» a medida que la levadura probiótica desplaza a las especies de Candida. La muerte de la cándida también puede hacer que las personas se sientan mal. Es mejor avisar a los pacientes de estas posibilidades de antemano, para que no se sorprendan si se producen.
urticaria. Dicho esto, es importante tener en cuenta que en los primeros días de toma de S. boulardii, algunos pacientes pueden experimentar un notable «lavado intestinal» a medida que la levadura probiótica desplaza a las especies de Candida. La muerte de la cándida también puede hacer que las personas se sientan mal. Es mejor avisar a los pacientes de estas posibilidades de antemano, para que no se sorprendan si se producen.
Según el Dr. Skelton, en 9 de cada 10 pacientes, cuatro semanas de suplementación intensiva con S. boulardii son suficientes para restaurar una capa de glicocálix saludable e inducir una secreción adecuada de IgA. Esto prepara el terreno para una ronda de restauración mucho más eficaz con un probiótico de múltiples cepas.
Bioceuticals ha diseñado un producto específicamente para su uso después de los antibióticos. Llamado BioFloractiv 500, contiene 500 mil millones de UFC, 12 especies y 14 cepas de bacterias beneficiosas. El Dr. Skilton recomienda un máximo de 14 días, aunque una semana de terapia diaria es suficiente para la mayoría, según Skilton.
Los pacientes con síndrome de intestino irritable o enfermedad de Crohn, sin embargo, pueden necesitar un apoyo a más largo plazo para reconstruir un microbioma saludable después de tomar antibióticos.
Un enfoque integral
Los probióticos son sólo una parte del cuadro. Y si un paciente no puede tolerar ningún tipo de probiótico, es una señal de alarma de que el sistema inmunitario del paciente no está funcionando correctamente.
«Primero hay que abordar cualquier aspecto del sistema nervioso, especialmente la dominancia simpática, que pueda estar afectando al tracto digestivo», dijo la doctora Skilton. Ha descubierto que el aceite de pescado, el zinc, la vitamina A y el calostro son útiles en muchos casos. Este último, «es realmente bueno para restaurar la sIgA. Hazlo durante una semana más o menos antes de probar los probióticos». Los suplementos de olmo resbaladizo y glutamina también pueden ser útiles en algunos casos.
Las medicinas a base de plantas como el aceite de orégano, el aceite de árbol de té o el extracto de pau d’arco pueden ser útiles para librar al tracto gastrointestinal de la levadura patógena. Pero el Dr. Skilton subrayó que estos no harán nada para estimular la producción de IgA, y las infecciones crónicas por hongos están casi siempre asociadas a una baja IgA. Estos destructores naturales de la levadura nunca deben usarse al mismo tiempo que el S. boulardii; esta levadura «amistosa» es tan vulnerable a cosas como el orégano y el árbol del té como las levaduras patógenas.
Una serie de alimentos probióticos y prebióticos pueden ayudar al proceso de restauración del intestino. Tom O’Bryan, DC, fundador de la Cumbre del Gluten y del programa de formación Certified Gluten Practitioner, recomienda varios alimentos para comer – y varios para evitar – cuando se reconstruye el intestino después del tratamiento con antibióticos.
«Cuando su intestino se ha visto comprometido, usted no quiere gravar su intestino», dice O’Bryan. Entre los alimentos «agotadores» se encuentran el trigo, los lácteos, el azúcar, las grasas no saludables y los fritos. Estos alimentos, señala, «echan gasolina al fuego» de un sistema intestinal en recuperación.
Por otro lado, hay que comer muchos alimentos que promuevan el crecimiento de organismos comensales sanos. O’Bryan recomienda las manzanas estofadas orgánicas, cocinadas hasta que estén blandas y brillantes, como una buena opción. Según explica, la cocción de las manzanas libera pectina, una fibra soluble que proporciona combustible a las bacterias beneficiosas.
La pectina presente en las manzanas guisadas también puede ayudar a curar un revestimiento intestinal dañado y a sellar los desgarros de un intestino permeable, impidiendo que se cuelen grandes moléculas de alimentos.
De forma similar, el colágeno ayuda a sellar un intestino permeable. O’Bryan también anima a los pacientes que se recuperan de un tratamiento con antibióticos a comer caldo de huesos de pollo, una buena fuente de colágeno, que también actúa como prebiótico natural, alimentando a las bacterias sanas del intestino.
El butirato -una sustancia natural que se produce en el intestino- es otro actor importante en la restauración de las bacterias intestinales. O’Bryan explica que las células que recubren el interior del intestino se reproducen rápidamente y que el butirato alimenta la reconstrucción de nuevas células. Una producción insuficiente de butirato y una lenta renovación de las células intestinales hacen que el organismo sea más vulnerable al desarrollo de células cancerosas, lo que se traduce en un mayor riesgo de cáncer de colon.
Una serie de frutas y verduras prebióticas, entre las que se encuentran los plátanos, los boniatos y otros tubérculos, ayudan a reconstruir el microbioma intestinal, proporcionando fibra insoluble que alimenta a las bacterias buenas, pero no a las dañinas.
Las verduras fermentadas, sin pasteurizar, como el chucrut, el kimchi y la remolacha fermentada, son otra excelente fuente de probióticos naturales. Cada verdura produce diferentes familias de bacterias beneficiosas durante la fermentación, señala O’Bryan, que anima a los pacientes a comer un tenedor de verduras fermentadas dos veces al día. «La clave de la salud en tu intestino es la diversidad de tu microbioma», argumenta, señalando que miles de familias diferentes de bacterias viven e interactúan en el intestino con impactos de gran alcance en nuestra salud.
END