Cíle výuky
- Rozpoznat alkany, alkeny, alkyny a aromatické sloučeniny.
- Vyjmenovat některé vlastnosti uhlovodíků.
Nejjednodušší organické sloučeniny jsou sloučeniny složené pouze ze dvou prvků: uhlíku a vodíku. Tyto sloučeniny se nazývají uhlovodíky. Samotné uhlovodíky se dělí na dva typy: alifatické uhlovodíky a aromatické uhlovodíky. Alifatické uhlovodíky jsou uhlovodíky, jejichž základem jsou řetězce atomů C. Existují tři typy alifatických uhlovodíků. Alkany jsou alifatické uhlovodíky s pouze jednoduchými kovalentními vazbami. Alkeny jsou alifatické uhlovodíky, které obsahují alespoň jednu dvojnou vazbu C-C, a alkyny jsou alifatické uhlovodíky, které obsahují trojnou vazbu C-C. Alkeny jsou alkyny. Občas se setkáme s alifatickým uhlovodíkem s kruhem z atomů C; tyto uhlovodíky se nazývají cykloalkany (nebo cykloalkeny či cykloalkyny).
Aromatické uhlovodíky, jako je benzen, jsou systémy s plochým kruhem, které obsahují souvisle se překrývající orbitaly p. Elektrony v benzenovém kruhu mají zvláštní energetické vlastnosti, které dávají benzenu fyzikální a chemické vlastnosti výrazně odlišné od alkanů. Původně se pro tuto třídu sloučenin používal termín aromatické, protože byly obzvláště voňavé. V moderní chemii však termín aromatický označuje přítomnost velmi stabilního kruhu, který molekule propůjčuje odlišné a jedinečné vlastnosti.
Nejjednodušší alkany mají své atomy C vázané v přímém řetězci; ty se nazývají normální alkany. Jsou pojmenovány podle počtu atomů C v řetězci. Nejmenším alkanem je metan:
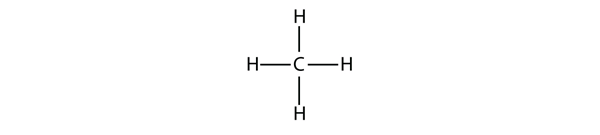
Obrázek 16.1 Trojrozměrné zobrazení metanu

Pro vytvoření čtyř kovalentních vazeb se atom C váže na čtyři atomy H, čímž vzniká molekulový vzorec metanu CH4. Dvourozměrný diagram pro methan je však zavádějící; čtyři kovalentní vazby, které vytváří atom C, jsou orientovány trojrozměrně k rohům čtyřstěnu. Lepší znázornění molekuly metanu je na obrázku 16.1 „Trojrozměrné znázornění metanu“
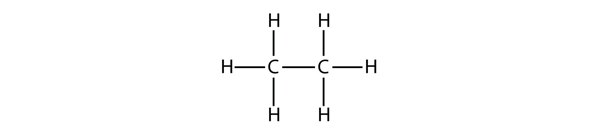
Další největší alkan má dva atomy C, které jsou vzájemně kovalentně vázány. Aby každý atom C vytvořil čtyři kovalentní vazby, musí být každý atom C vázán ke třem atomům H. Výsledná molekula, jejíž vzorec je C2H6, je ethan:
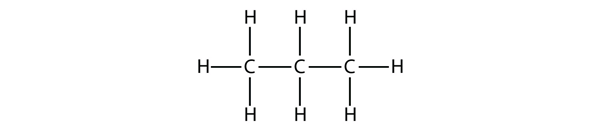
Propan má páteř tvořenou třemi atomy C obklopenými atomy H. V případě, že se jedná o ethan, je jeho páteř tvořena třemi atomy C, které jsou obklopeny atomy H. V tomto případě se jedná o ethan. Měli byste být schopni ověřit, že molekulový vzorec propanu je C3H8:
Schémata, která jsme dosud viděli a která představují alkany, jsou poměrně jednoduché Lewisovy struktury. Jak se však molekuly zvětšují, Lewisovy struktury jsou stále složitější. Jedním ze způsobů, jak to obejít, je použít kondenzovanou strukturu,která uvádí vzorec každého atomu C v páteři molekuly. Například kondenzovaná struktura pro ethan je CH3CH3, zatímco pro propan je to CH3CH2CH3. V tabulce 16.1 „Prvních 10 alkanů“ jsou uvedeny molekulové vzorce, kondenzované strukturní vzorce a názvy prvních 10 alkanů.
Tabulka 16.1 Prvních 10 alkanů
| Molekulární vzorec | Kondenzovaný strukturní vzorec | Název |
|---|---|---|
| CH4 | CH4 | methan |
| C2H6 | CH3CH3 | etan |
| C3H8 | CH3CH2CH3 | propan |
| C4H10 | CH3CH2CH2CH3 | butan |
| C5H12 | CH3CH2CH2CH3 | pentan |
| C6H14 | CH3(CH2)4CH3 | hexan |
| C7H16 | CH3(CH2)5CH3 | heptan |
| C8H18 | CH3(CH2)6CH3 | oktan |
| C9H20 | CH3(CH2)7CH3 | nonan |
| C10H22 | CH3(CH2)8CH3 | dekan |
Protože alkany mají maximální možný počet atomů H podle pravidel kovalentních vazeb, označují se alkany také jako nasycené uhlovodíky.
Alkeny mají dvojnou vazbu C-C. Protože mají menší než maximální možný počet atomů H, nazývají se nenasycené uhlovodíky. Nejmenší alken – ethen – má dva atomy C a je známý také pod svým obecným názvem ethylen:
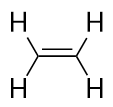
Další největší alken – propen – má tři atomy C s dvojnou vazbou C-C mezi dvěma z atomů C. Nejmenší alken – ethen – má dva atomy C a je známý pod svým obecným názvem ethylen. Známe ho také jako propylen:
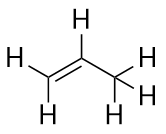
Co si všimnete na názvech alkanů a alkenů? Názvy alkenů jsou stejné jako názvy jim odpovídajících alkanů s tím rozdílem, že přípona (koncovka) je -en, nikoliv -an. Používání kmene známého jako mateřský řetězec pro označení počtu atomů C v molekule a koncovky pro označení typu organické sloučeniny je v organické chemii běžné, jak uvidíme.
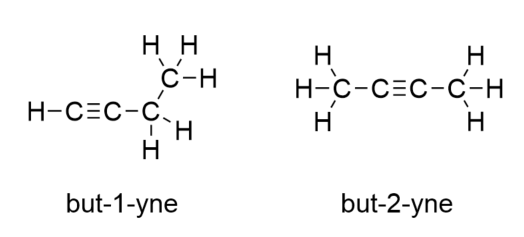
S uvedením dalšího alkenu, butenu, začínáme vidět hlavní problém organických molekul: výběr. Při čtyřech atomech C může dvojná vazba C-C probíhat mezi prvním a druhým atomem C nebo mezi druhým a třetím atomem C:
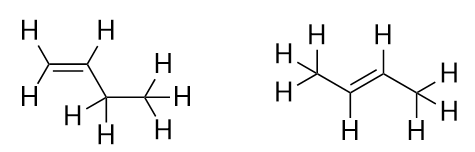
(Dvojná vazba mezi třetím a čtvrtým atomem C je stejná, jako kdyby probíhala mezi prvním a druhým atomem C, jen je převrácená). Pravidla pojmenování v organické chemii vyžadují, aby tyto dvě látky měly různé názvy. První molekula se jmenuje but-1-en, zatímco druhá molekula se jmenuje but-2-en. Číslo mezi názvem mateřského řetězce a koncovkou se nazývá lokant a označuje, na kterém uhlíku dvojná vazba vzniká. Pro číslování prvku v molekule se používá nejnižší možné číslo; proto by bylo nesprávné nazývat druhou molekulu but-3-en. Čísla jsou běžnou součástí názvů organických chemických látek, protože označují, který atom C v řetězci obsahuje rozlišovací znak. Pokud se dvojná vazba (nebo jiná funkční skupina) nachází na prvním uhlíku, je běžnou praxí některých autorů lokant vynechat. Například pokud by byl buten napsán bez lokantu, měli byste předpokládat, že se jedná o but-1-en, nikoli o but-2-en.
Sloučeniny but-1-en a but-2-en mají odlišné fyzikální a chemické vlastnosti, i když mají stejný molekulový vzorec – C4H8. Různé molekuly se stejným molekulovým vzorcem se nazývají izomery. Izomery jsou v organické chemii běžné a přispívají k její složitosti.
Příklad 1
Na základě názvů molekul butenu navrhněte název této molekuly.
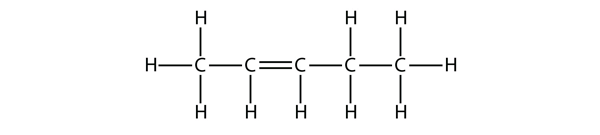
Řešení
Při pěti atomech C použijeme název penten a při dvojné vazbě C-C se jedná o alken, takže tato molekula je penten. Při číslování atomů C použijeme číslo 2, protože je to nejnižší možné označení. Tato molekula se tedy jmenuje pent-2-en.
Vyzkoušejte se
Na základě názvů molekul butenu navrhněte název pro tuto molekulu.
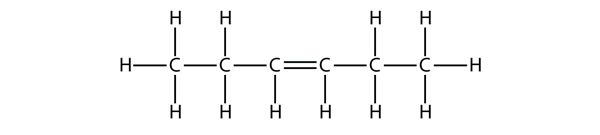
Odpověď
hex-3-en
Alkiny s trojnou vazbou C-C se nazývají podobně jako alkeny, jen jejich názvy končí na -yne. Nejmenším alkynem je etyn, který je známý také jako acetylen:
![]()
Propyn má tuto strukturu:
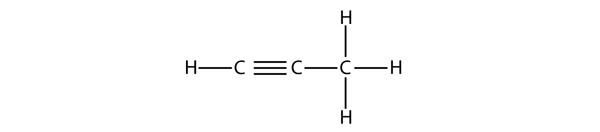
U butynu musíme začít číslovat polohu trojné vazby, stejně jako u alkenů:
Benzen je aromatická sloučenina složená ze šesti atomů C v kruhu se střídavými jednoduchými a dvojitými vazbami C-C:
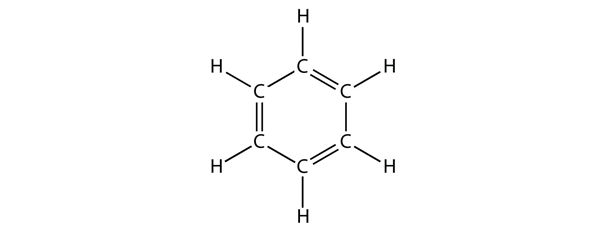
Střídavé jednoduché a dvojité vazby C-C dávají benzenovému kruhu zvláštní stabilitu a nereaguje jako alken, jak by se dalo očekávat.
Jakkoli jsou uhlovodíky pro organickou chemii zásadní, jejich vlastnosti a chemické reakce jsou poměrně všední. Většina uhlovodíků je nepolární, protože elektronegativita atomů C a H je blízká. Proto se v H2O a jiných polárních rozpouštědlech rozpouštějí jen zřídka. Malé uhlovodíky, jako je methan a ethan, jsou při pokojové teplotě plyny, zatímco větší uhlovodíky, jako je hexan a oktan, jsou kapaliny. Dokonce i větší uhlovodíky, jako je hentriacontan (C31H64), jsou při pokojové teplotě pevné látky a mají měkkou, voskovitou konzistenci.
Uhlovodíky jsou poměrně málo reaktivní, ale účastní se některých klasických chemických reakcí. Jednou z běžných reakcí je substituce atomem halogenu spojením uhlovodíku s elementárním halogenem. K podpoře reakce se někdy používá světlo, jako například při této reakci mezi metanem a chlorem:
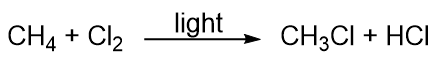
Halogeny mohou také reagovat s alkeny a alkyny, ale reakce je jiná. V těchto případech reagují molekuly halogenů s dvojnou nebo trojnou vazbou C-C a připojují se na každý atom C zapojený do vícenásobné vazby. Tato reakce se nazývá adiční reakce. Jedním z příkladů je
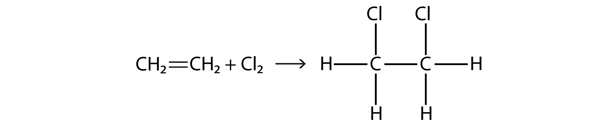
Reakční podmínky jsou obvykle mírné; v mnoha případech reaguje halogen s alkenem nebo alkynem spontánně.
Vodík lze také přidat přes násobnou vazbu; tato reakce se nazývá hydrogenační reakce. V tomto případě však reakční podmínky nemusí být mírné; mohou být nutné vysoké tlaky plynu H2. Obvykle se používá platinový nebo palladiový katalyzátor, aby reakce probíhala přiměřeným tempem:
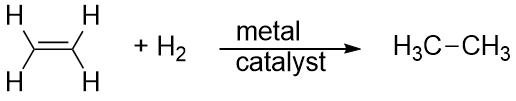
Daleko nejběžnější reakcí uhlovodíků je spalování, což je spojení uhlovodíku s O2 za vzniku CO2 a H2O. Spalování uhlovodíků je doprovázeno uvolňováním energie a je hlavním zdrojem výroby energie v naší společnosti (obrázek 16.2 „Spalování“). Například reakce spalování benzínu, který lze znázornit pomocí C8H18, probíhá takto:
2 C8H18 + 25 O2 → 16 CO2 + 18 H2O + ~5060 kJ
Obrázek 16.2 Spalování

.