Læringsmål
- Identificer alkaner, alkener, alkyner og aromatiske forbindelser.
- Oplys nogle egenskaber ved kulbrinter.
De enkleste organiske forbindelser er de forbindelser, der kun består af to grundstoffer: kulstof og brint. Disse forbindelser kaldes carbonhydrider. Kulbrinterne selv er opdelt i to typer: alifatiske kulbrinter og aromatiske kulbrinter. Alifatiske carbonhydrider er carbonhydrider, der er baseret på kæder af C-atomer. Der findes tre typer af alifatiske carbonhydrider. Alkaner er alifatiske carbonhydrider med kun enkelte kovalente bindinger. Alkener er alifatiske kulbrinter, der indeholder mindst én C-C-dobbeltbinding, og alkyner er alifatiske kulbrinter, der indeholder en C-C-dobbeltbinding. Lejlighedsvis finder vi en alifatisk kulbrinte med en ring af C-atomer; disse kulbrinter kaldes cycloalkaner (eller cycloalkener eller cycloalkyner).
Aromatiske kulbrinter, såsom benzen,er flade ringsystemer, der indeholder kontinuerligt overlappende p-orbitaler.Elektroner i benzenringen har særlige energimæssige egenskaber, der giver benzen fysiske og kemiske egenskaber, der adskiller sig markant fra alkaner. Oprindeligt blev betegnelsen aromatisk brugt til at beskrive denne klasse af forbindelser, fordi de var særligt velduftende. I moderne kemi betegner udtrykket aromatisk imidlertid tilstedeværelsen af en meget stabil ring, der giver et molekyle forskellige og unikke egenskaber.
De enkleste alkaner har deres C-atomer bundet i en lige kæde; disse kaldes normale alkaner. De er navngivet efter antallet af C-atomer i kæden. Den mindste alkan er metan:
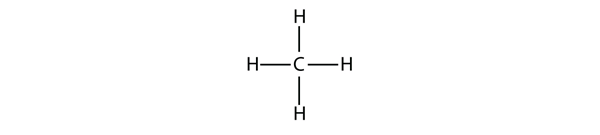
Figur 16.1 Tre-dimensionel fremstilling af metan

For at lave fire kovalente bindinger binder C-atomet sig til fire H-atomer, hvilket giver molekylformlen for metan CH4. Det todimensionelle diagram for metan er dog misvisende; de fire kovalente bindinger, som C-atomet laver, er orienteret tredimensionelt mod hjørnerne i et tetraeder. En bedre repræsentation af metanmolekylet er vist i figur 16.1 “Three-Dimensional Representation of Methane.”
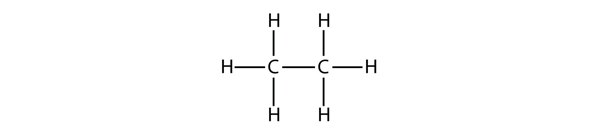
Den næststørste alkan har to C-atomer, der er kovalent bundet til hinanden. For at hvert C-atom kan lave fire kovalente bindinger, skal hvert C-atom være bundet til tre H-atomer. Det resulterende molekyle, hvis formel er C2H6, er ethan:
Propan har en rygsøjle bestående af tre C-atomer omgivet af H-atomer. Du bør kunne bekræfte, at propans molekylformel er C3H8:
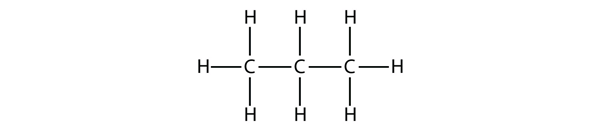
De diagrammer, vi har set indtil nu, der repræsenterer alkaner, er ret enkle Lewis-strukturer. Men efterhånden som molekylerne bliver større, bliver Lewis-strukturerne mere og mere komplekse. En måde at omgå dette på er at anvende en kondenseret struktur, som angiver formlen for hvert C-atom i molekylets rygsøjle. F.eks. er den kondenserede struktur for ethan CH3CH3, mens den er CH3CH2CH3 for propan. Tabel 16.1 “De 10 første alkaner” angiver molekylformlerne, de kondenserede strukturformler og navnene på de 10 første alkaner.
Tabel 16.1 De 10 første alkaner
| Molekylformel | Kondenseret strukturformel | Navn | |
|---|---|---|---|
| CH4 | CH4 | methan | |
| C2H6 | CH3CH3CH3 | ethan | |
| C3H8 | CH3CH3CH2CH3 | propan | |
| C4H10 | CH3CH3CH2CH2CH2CH3 | butan | |
| C5H12 | CH3CH2CH2CH2CH2CH3 | pentan | |
| C6H14 | CH3(CH2)4CH3 | hexan | |
| C7H16 | CH3(CH2)5CH3 | heptan | |
| C8H18 | CH3(CH2)6CH3 | oktan | |
| C9H20 | CH3(CH2)7CH3 | nonan | |
| C10H22 | CH3(CH2)8CH3 | decan |
Da alkaner har det maksimale antal H-atomer, der er muligt i henhold til reglerne for kovalente bindinger, kaldes alkaner også for mættede carbonhydrider.
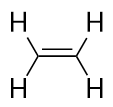
Alkener har en C-C-dobbeltbinding. Da de har mindre end det maksimalt mulige antal H-atomer, kaldes de umættede carbonhydrider. Den mindste alken – ethen – har to C-atomer og er også kendt under det almindelige navn ethylen:
Den næststørste alken – propen – har tre C-atomer med en C-C-dobbeltbinding mellem to af C-atomerne. Det er også kendt som propylen:
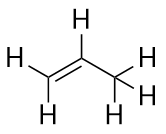
Hvad bemærker du ved navnene på alkaner og alkener? Navnene på alkener er de samme som deres tilsvarende alkaner, bortset fra at suffikset (endelsen) er -en i stedet for -an. At bruge en stamme, kendt som moderkæden, til at angive antallet af C-atomer i et molekyle og en endelse til at repræsentere typen af organisk forbindelse er almindeligt i organisk kemi, som vi skal se.
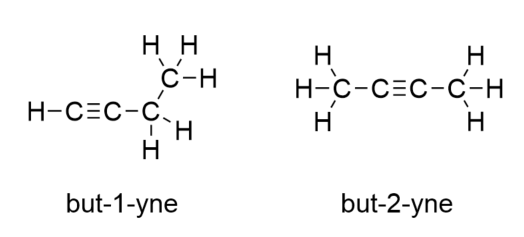
Med introduktionen af den næste alken, buten, begynder vi at se et vigtigt problem med organiske molekyler: valgmuligheder. Med fire C-atomer kan C-C-dobbeltbindingen gå mellem det første og andet C-atom eller mellem det andet og tredje C-atom:
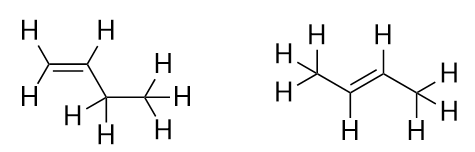
(En dobbeltbinding mellem det tredje og fjerde C-atom er det samme som at have den mellem det første og andet C-atom, blot vendt om). Reglerne for navngivning i organisk kemi kræver, at disse to stoffer har forskellige navne. Det første molekyle benævnes but-1-en, mens det andet molekyle benævnes but-2-ene. Tallet mellem navnet på moderkæden og suffikset er kendt som en lokant og angiver, på hvilket kulstof dobbeltbindingen stammer fra. Det lavest mulige tal anvendes til at nummerere et træk i et molekyle; derfor ville det være forkert at kalde det andet molekyle but-3-ene. Numre er almindelige dele af organiske kemiske navne, fordi de angiver, hvilket C-atom i en kæde der indeholder en karakteristisk egenskab. Når dobbeltbindingen (eller en anden funktionel gruppe) er placeret på det første kulstofatom, er det almindelig praksis for nogle forfattere at udelade lokanten. Hvis f.eks. buten blev skrevet uden lokant, skal man antage, at det henviser til but-1-ene, ikke but-2-ene.
Forbindelserne but-1-ene og but-2-ene har forskellige fysiske og kemiske egenskaber, selv om de har den samme molekylformel-C4H8. Forskellige molekyler med samme molekylformel kaldes isomerer. Isomerer er almindelige i organisk kemi og bidrager til dens kompleksitet.
Eksempel 1
Forsøg et navn til dette molekyle på baggrund af navnene på butenmolekylerne.
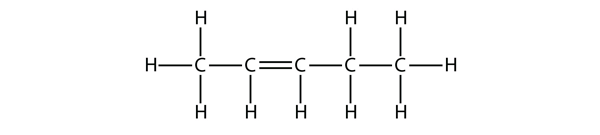
Løsning
Med fem C-atomer vil vi bruge penten-navnet, og med en C-C-dobbeltbinding er der tale om en alken, så dette molekyle er en penten. Ved nummerering af C-atomerne bruger vi tallet 2, fordi det er den lavest mulige betegnelse. Så dette molekyle hedder pent-2-ene.
Test Yourself
Forsøg et navn til dette molekyle på baggrund af navnene på butenmolekylerne.
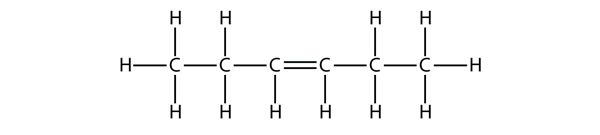
Svar
hex-3-en
Alkyner, der har en C-C-dobbeltbinding, har samme navn som alkener, bortset fra at deres navne ender på -yne. Det mindste alkyn er ethyn, som også kaldes acetylen:
![]()
Propyn har denne struktur:
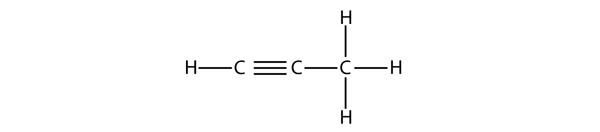
Med butyn skal vi begynde at nummerere placeringen af tripelbindingen, ligesom vi gjorde med alkenerne:
Benzen er en aromatisk forbindelse, der består af seks C-atomer i en ring med skiftevis enkelt- og dobbelt-C-C-bindinger:
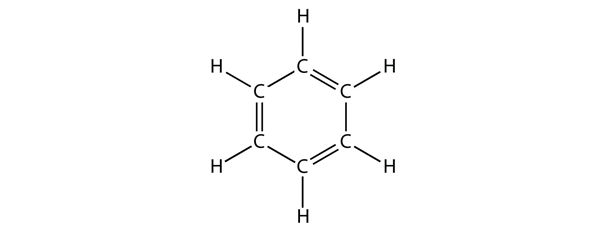
De skiftevis enkelt- og dobbelt-C-C-bindinger giver benzenringen en særlig stabilitet, og den reagerer ikke som en alken, som man kunne forvente.
Så grundlæggende som kulbrinterne er for den organiske kemi, er deres egenskaber og kemiske reaktioner ret banale. De fleste kulbrinter er upolære på grund af C- og H-atomernes tætte elektronegativitet. Som sådan opløses de kun sparsomt i H2O og andre polære opløsningsmidler. Små kulbrinter, som f.eks. methan og ethan, er gasser ved stuetemperatur, mens større kulbrinter, som f.eks. hexan og oktan, er væsker. Selv større kulbrinter, som hentriacontan (C31H64), er faste stoffer ved stuetemperatur og har en blød, voksagtig konsistens.
Kulbrinter er ret ureaktive, men de deltager dog i nogle klassiske kemiske reaktioner. En almindelig reaktion er substitution med et halogenatom ved at kombinere et kulbrinte med et elementært halogen. Lys bruges nogle gange til at fremme reaktionen, som f.eks. denne mellem metan og klor:
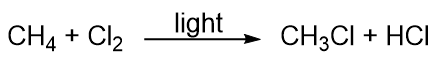
Halogener kan også reagere med alkener og alkyner, men reaktionen er anderledes. I disse tilfælde reagerer halogenmolekylerne med C-C-dobbelt- eller trippelbindingen og lægger sig på hvert C-atom, der er involveret i de flere bindinger. Denne reaktion kaldes en additionsreaktion. Et eksempel er
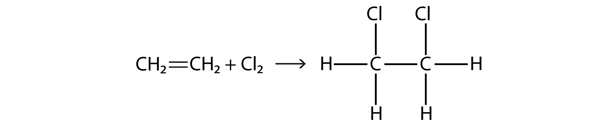
Reaktionsbetingelserne er normalt milde; i mange tilfælde reagerer halogenet spontant med et alken eller et alkyn.
Hydrogen kan også tilsættes på tværs af en flerbinding; denne reaktion kaldes en hydrogeneringsreaktion. I dette tilfælde er reaktionsbetingelserne dog ikke nødvendigvis milde; det kan være nødvendigt med høje tryk af H2-gas. Der anvendes normalt en platin- eller palladiumkatalysator for at få reaktionen til at forløbe i et rimeligt tempo:
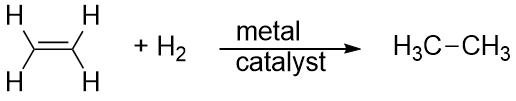
Langt den mest almindelige reaktion af kulbrinter er forbrænding, som er kombinationen af et kulbrinte med O2 til CO2 og H2O. Forbrændingen af kulbrinter er ledsaget af en frigivelse af energi og er en primær kilde til energiproduktion i vores samfund (figur 16.2 “Forbrænding”). Forbrændingsreaktionen for benzin, som f.eks. kan repræsenteres ved C8H18, er som følger:
2 C8H18 + 25 O2 → 16 CO2 + 18 H2O + ~5060 kJ
Figur 16.2 Forbrænding
