Learning Objectives
- Identify alkanes, alkenes, alkynes, and aromatic compounds.
- Lijst enkele eigenschappen van koolwaterstoffen.
De eenvoudigste organische verbindingen zijn die welke uit slechts twee elementen bestaan: koolstof en waterstof. Deze verbindingen worden koolwaterstoffen genoemd. Koolwaterstoffen zelf worden in twee soorten onderverdeeld: alifatische koolwaterstoffen en aromatische koolwaterstoffen. Alifatische koolwaterstoffen zijn koolwaterstoffen die bestaan uit ketens van C-atomen. Er zijn drie soorten alifatische koolwaterstoffen. Alkanen zijn alifatische koolwaterstoffen met slechts enkele covalente bindingen. Alkenen zijn alifatische koolwaterstoffen die ten minste één C-C-dubbele binding bevatten, en alkynen zijn alifatische koolwaterstoffen die een C-C-drievoudige binding bevatten. Af en toe vinden we een alifatische koolwaterstof met een ring van C-atomen; deze koolwaterstoffen worden cycloalkanen (of cycloalkenen of cycloalkynen) genoemd.
Aromatische koolwaterstoffen, zoals benzeen, zijn platte-ringsystemen die continu overlappende p-banen bevatten.Elektronen in de benzeenring hebben speciale energetische eigenschappen die benzeen fysische en chemische eigenschappen geven die duidelijk verschillen van alkenen. Oorspronkelijk werd de term aromatisch gebruikt om deze klasse van verbindingen te beschrijven omdat ze bijzonder geurig waren. In de moderne scheikunde duidt de term aromatisch echter op de aanwezigheid van een zeer stabiele ring die verschillende en unieke eigenschappen aan een molecuul verleent.
De eenvoudigste alkanen hebben hun C-atomen in een rechte keten aan elkaar gebonden; deze worden normale alkanen genoemd. Ze worden genoemd naar het aantal C-atomen in de keten. Het kleinste alkaan is methaan:
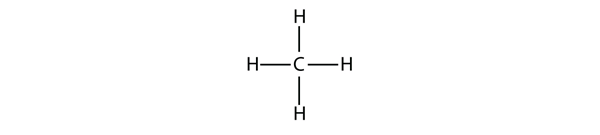
Figuur 16.1 Driedimensionale weergave van methaan

Om vier covalente bindingen te maken, bindt het C-atoom zich aan vier H-atomen, waardoor de molecuulformule voor methaan CH4 wordt. Het tweedimensionale diagram voor methaan is echter misleidend; de vier covalente bindingen die het C-atoom maakt, zijn driedimensionaal georiënteerd naar de hoeken van een tetraëder. Een betere weergave van het methaanmolecuul is te zien in figuur 16.1 “Driedimensionale weergave van methaan.”
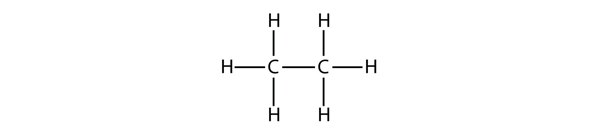
Het op een na grootste alkaan heeft twee C-atomen die covalent aan elkaar gebonden zijn. Om vier covalente bindingen te kunnen maken, moet elk C-atoom gebonden zijn aan drie H-atomen. Het resulterende molecuul, waarvan de formule C2H6 is, is ethaan:
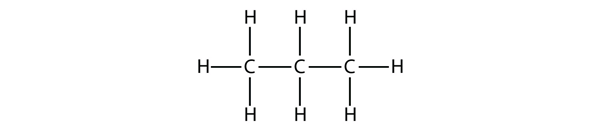
Propaan heeft een ruggengraat van drie C-atomen omgeven door H-atomen. Je zou moeten kunnen nagaan dat de molecuulformule voor propaan C3H8 is:
De diagrammen die we tot nu toe hebben gezien en die alkanen voorstellen, zijn vrij eenvoudige Lewis-structuren. Naarmate moleculen groter worden, worden de Lewisstructuren echter steeds complexer. Een manier om dit te omzeilen is gebruik te maken van een gecondenseerde structuur, waarin de formule van elk C-atoom in de ruggengraat van het molecuul wordt vermeld. Bijvoorbeeld, de gecondenseerde structuur voor ethaan is CH3CH3, terwijl het CH3CH2CH3 is voor propaan. Tabel 16.1 “De eerste 10 alkanen” geeft de molecuulformules, de gecondenseerde structuurformules, en de namen van de eerste 10 alkanen.
Tabel 16.1 De eerste 10 alkanen
| Molecuulformule | Gecondenseerde structuurformule | Naam |
|---|---|---|
| CH4 | methaan | |
| C2H6 | CH3CH3 | ethaan |
| C3H8 | CH3CH2CH3 | propaan |
| C4H10 | CH3CH2CH2CH3 | butaan |
| C5H12 | CH3CH2CH2CH3 | pentaan |
| C6H14 | CH3(CH2)4CH3 | hexaan |
| C7H16 | CH3(CH2)5CH3 | heptaan |
| C8H18 | CH3(CH2)6CH3 | octaan |
| C9H20 | CH3(CH2)7CH3 | nonaan |
| C10H22 | CH3(CH2)8CH3 | decaan |
Omdat alkanen het maximaal aantal H-atomen hebben dat volgens de regels van de covalente bindingen mogelijk is, worden alkanen ook wel verzadigde koolwaterstoffen genoemd.
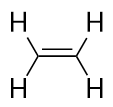
Alkenen hebben een C-C dubbele binding. Omdat zij minder dan het maximaal mogelijke aantal H-atomen hebben, worden zij onverzadigde koolwaterstoffen genoemd. Het kleinste alkeen – etheen – heeft twee C-atomen en is ook bekend onder de gewone naam ethyleen:
Het op een na grootste alkeen – propeen – heeft drie C-atomen met een C-C-dubbele binding tussen twee van de C-atomen. Het staat ook bekend als propyleen:
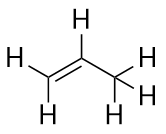
Wat valt je op aan de namen van alkanen en alkenen? De namen van alkenen zijn hetzelfde als die van hun corresponderende alkanen, behalve dat het achtervoegsel (uitgang) -een is, in plaats van -aan. Het gebruik van een stam, bekend als de moeder-keten, om het aantal C atomen in een molecuul aan te geven en een achtervoegsel om het type organische verbinding aan te geven, is gebruikelijk in de organische chemie, zoals we zullen zien.
Met de introductie van het volgende alkeen, buteen, beginnen we een belangrijk probleem te zien met organische moleculen: keuzes. Met vier C-atomen kan de dubbele C-C-binding tussen het eerste en tweede C-atoom of tussen het tweede en derde C-atoom komen:
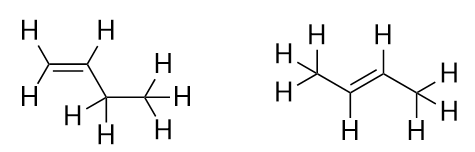
(Een dubbele binding tussen het derde en vierde C-atoom is hetzelfde als tussen het eerste en tweede C-atoom, alleen dan omgedraaid). Volgens de regels voor naamgeving in de organische chemie moeten deze twee stoffen verschillende namen hebben. Het eerste molecuul wordt but-1-een genoemd, terwijl het tweede molecuul but-2-een wordt genoemd. Het getal tussen de naam van de ouder-keten en het achtervoegsel wordt locant genoemd en geeft aan op welke koolstof de dubbele binding ontstaat. Het laagst mogelijke nummer wordt gebruikt om een eigenschap in een molecule te nummeren; het tweede molecule but-3-een noemen zou dus onjuist zijn. Nummers maken vaak deel uit van organisch-chemische namen omdat ze aangeven welk C-atoom in een keten een onderscheidend kenmerk bevat. Wanneer de dubbele binding (of een andere functionele groep) zich op de eerste koolstof bevindt, is het gebruikelijk dat sommige auteurs de plaatsaanduiding weglaten. Als buteen bijvoorbeeld zonder plaatsnaam wordt geschreven, moet je aannemen dat het but-1-een betreft en niet but-2-een.
De verbindingen but-1-een en but-2-een hebben verschillende fysische en chemische eigenschappen, ook al hebben ze dezelfde molecuulformule-C4H8. Verschillende moleculen met dezelfde molecuulformule worden isomeren genoemd. Isomeren komen veel voor in de organische chemie en dragen bij tot de complexiteit ervan.
Voorbeeld 1
Baseer op de namen voor de buteenmoleculen en stel een naam voor dit molecuul voor.
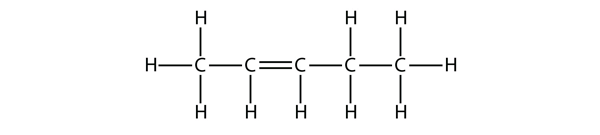
Oplossing
Met vijf C-atomen gebruiken we de pentenaam, en met een C-C-dubbele binding is dit een alkeen, dus is dit molecuul een penteen. Bij de nummering van de C-atomen gebruiken we het getal 2 omdat dit het laagst mogelijke label is. Dit molecuul krijgt dus de naam pent-2-een.
Test jezelf
Op basis van de namen voor de buteënmoleculen stelt u een naam voor dit molecuul voor.
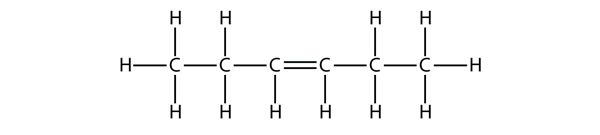
Antwoord
hex-3-een
Alkynen, met een C-C drievoudige binding, worden op dezelfde manier genoemd als alkenen, behalve dat hun namen eindigen op -yne. De kleinste alkyne is ethyne, dat ook wel acetyleen wordt genoemd:
![]()
Propyne heeft deze structuur:
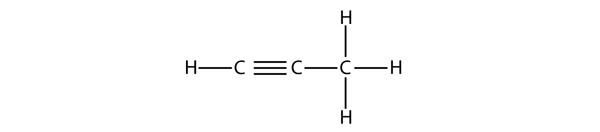
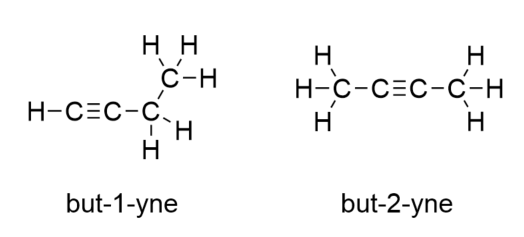
Bij butyne moeten we beginnen met het nummeren van de positie van de drievoudige binding, net zoals we bij alkenen hebben gedaan:
Benzeen is een aromatische verbinding die bestaat uit zes C-atomen in een ring, met afwisselend enkele en dubbele C-C-bindingen:
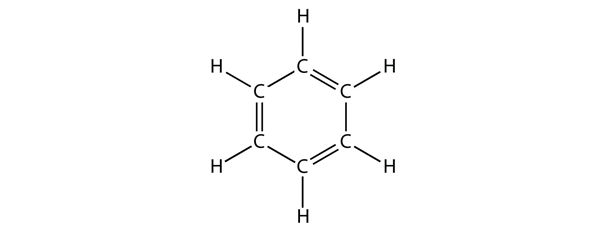
De afwisselende enkele en dubbele C-C-bindingen geven de benzeenring een bijzondere stabiliteit, en hij reageert niet als een alkeen, zoals te verwachten zou zijn.
Zo fundamenteel als koolwaterstoffen zijn voor de organische chemie, zijn hun eigenschappen en chemische reacties tamelijk alledaags. De meeste koolwaterstoffen zijn niet polair vanwege de nauwe elektronegativiteiten van C en H atomen. Als zodanig lossen zij slechts spaarzaam op in H2O en andere polaire oplosmiddelen. Kleine koolwaterstoffen, zoals methaan en ethaan, zijn gassen bij kamertemperatuur, terwijl grotere koolwaterstoffen, zoals hexaan en octaan, vloeistoffen zijn. Zelfs grotere koolwaterstoffen, zoals hentriacontaan (C31H64), zijn vaste stoffen bij kamertemperatuur en hebben een zachte, wasachtige consistentie.
Koolwaterstoffen zijn tamelijk onreactief, maar zij nemen wel deel aan enkele klassieke chemische reacties. Een veel voorkomende reactie is substitutie met een halogeenatoom door het combineren van een koolwaterstof met een elementair halogeen. Soms wordt licht gebruikt om de reactie te bevorderen, zoals deze tussen methaan en chloor:
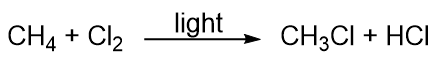
Halogenen kunnen ook reageren met alkenen en alkynen, maar de reactie verloopt anders. In deze gevallen reageren de halogeenmoleculen met de dubbele of drievoudige C-C-binding en hechten zich aan elk C-atoom dat betrokken is bij de meervoudige bindingen. Deze reactie wordt een additiereactie genoemd. Een voorbeeld is
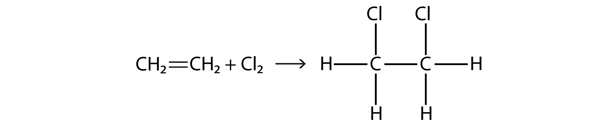
De reactieomstandigheden zijn meestal mild; in veel gevallen reageert het halogeen spontaan met een alkeen of een alkyne.
Waterstof kan ook over een meervoudige binding worden toegevoegd; deze reactie wordt een hydrogeneringsreactie genoemd. In dit geval kunnen de reactieomstandigheden echter niet mild zijn; er kan een hoge druk van H2-gas nodig zijn. Meestal wordt een platina- of palladiumkatalysator gebruikt om de reactie in een redelijk tempo te laten verlopen:
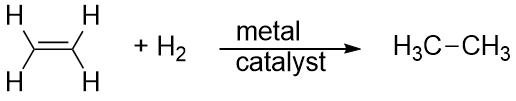
Verreweg de meest voorkomende reactie van koolwaterstoffen is verbranding, dat wil zeggen de combinatie van een koolwaterstof met O2 om CO2 en H2O te maken. De verbranding van koolwaterstoffen gaat gepaard met het vrijkomen van energie en is een primaire bron van energieproductie in onze samenleving (figuur 16.2 “Verbranding”). De verbrandingsreactie voor bijvoorbeeld benzine, die kan worden weergegeven met C8H18, is als volgt:
2 C8H18 + 25 O2 → 16 CO2 + 18 H2O + ~5060 kJ
Figuur 16.2 Verbranding
