Obiective de învățare
- Identificați alcanii, alchenele, alchenele și compușii aromatici.
- Enumerați câteva proprietăți ale hidrocarburilor.
Cei mai simpli compuși organici sunt cei compuși din numai două elemente: carbon și hidrogen. Acești compuși se numesc hidrocarburi. Hidrocarburile însele sunt separate în două tipuri: hidrocarburi alifatice și hidrocarburi aromatice. Hidrocarburile alifatice sunt hidrocarburi bazate pe lanțuri de atomi de C. Există trei tipuri de hidrocarburi alifatice. Alcanii sunt hidrocarburi alifatice care au doar legături covalente simple. Alchenele sunt hidrocarburi alifatice care conțin cel puțin o legătură dublă C-C, iar alchenele sunt hidrocarburi alifatice care conțin o legătură triplă C-C. Ocazional, găsim o hidrocarbură alifatică cu un inel de atomi de C; aceste hidrocarburi se numesc cicloalcani (sau cicloalchene sau cicloalchene).
Hidrocarburile aromatice, cum ar fi benzenul, sunt sisteme de inele plate care conțin orbitali p care se suprapun continuu.Electronii din inelul benzenic au proprietăți energetice speciale care conferă benzenului proprietăți fizice și chimice care sunt net diferite de cele ale alcanilor. Inițial, termenul aromatic a fost folosit pentru a descrie această clasă de compuși deoarece erau deosebit de parfumați. Cu toate acestea, în chimia modernă, termenul aromatic denotă prezența unui inel foarte stabil care conferă proprietăți diferite și unice unei molecule.
Cei mai simpli alcani au atomii lor de C legați într-un lanț drept; aceștia se numesc alcani normali. Aceștia sunt denumiți în funcție de numărul de atomi de C din lanț. Cel mai mic alcan este metanul:
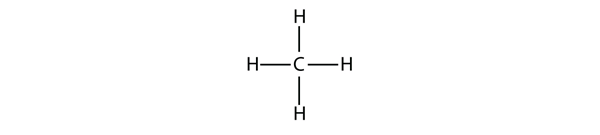
Figura 16.1 Reprezentarea tridimensională a metanului

Pentru a realiza patru legături covalente, atomul de C se leagă de patru atomi de H, ceea ce face ca formula moleculară a metanului să fie CH4. Diagrama bidimensională pentru metan este însă înșelătoare; cele patru legături covalente pe care le face atomul C sunt orientate tridimensional spre colțurile unui tetraedru. O reprezentare mai bună a moleculei de metan este prezentată în figura 16.1 „Reprezentarea tridimensională a metanului.”
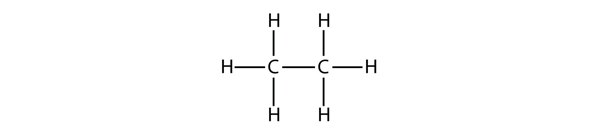
Alcanul următor ca mărime are doi atomi de C care sunt legați covalent unul de celălalt. Pentru ca fiecare atom de C să realizeze patru legături covalente, fiecare atom de C trebuie să fie legat de trei atomi de H. Molecula rezultată, a cărei formulă este C2H6, este etanul:
Propanul are o coloană vertebrală formată din trei atomi de C înconjurați de atomi de H. Ar trebui să puteți verifica că formula moleculară a propanului este C3H8:
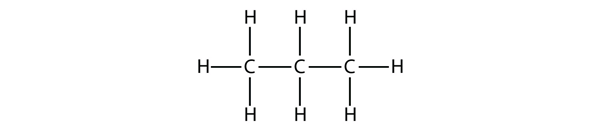
Diagramele pe care le-am văzut până acum reprezentând alcani sunt structuri Lewis destul de simple. Cu toate acestea, pe măsură ce moleculele devin mai mari, structurile Lewis devin din ce în ce mai complexe. O modalitate de a evita acest lucru este de a folosi o structură condensată,care enumeră formula fiecărui atom de C din coloana vertebrală a moleculei. De exemplu, structura condensată pentru etan este CH3CH3, în timp ce pentru propan este CH3CH2CH3. Tabelul 16.1 „Primii 10 alcani” prezintă formulele moleculare, formulele structurale condensate și denumirile primilor 10 alcani.
Tabelul 16.1 Primii 10 alcani
| Formula moleculară | Formula structurală condensată | Nume |
|---|---|---|
| CH4 | CH4 | metan |
| C2H6 | CH3CH3 | etan |
| C3H8 | CH3CH2CH3 | propan |
| C4H10 | CH3CH2CH2CH3 | butan |
| C5H12 | CH3CH2CH2CH2CH3 | pentan |
| C6H14 | CH3(CH2)4CH3 | hexan |
| C7H16 | CH3(CH2)5CH3 | heptan |
| C8H18 | CH3(CH2)6CH3 | octan |
| C9H20 | CH3(CH2)7CH3 | nonan |
| C10H22 | CH3(CH2)8CH3 | decan |
Pentru că alcanii au numărul maxim de atomi de H posibil conform regulilor legăturilor covalente, alcanii sunt, de asemenea, denumiți hidrocarburi saturate.
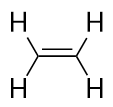
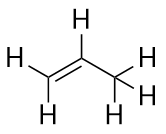
Alchenele au o legătură dublă C-C. Deoarece au mai puțin decât numărul maxim de atomi de H posibil, se numesc hidrocarburi nesaturate. Cel mai mic alchenă – etena – are doi atomi de C și este, de asemenea, cunoscută sub numele comun de etilenă:
Postul cel mai mare alchenă – propenă – are trei atomi de C cu o legătură dublă C-C între doi dintre atomii de C. Este cunoscut și sub numele de propilenă:
Ce observați la denumirile alcanilor și alchenelor? Denumirile alchenelor sunt identice cu cele ale alcanilor lor corespunzători, cu excepția faptului că sufixul (terminația) este -ene, în loc de -ane. Utilizarea unei tulpini cunoscute sub numele de lanț parental pentru a indica numărul de atomi de C dintr-o moleculă și a unei terminații pentru a reprezenta tipul de compus organic este comună în chimia organică, după cum vom vedea.
Cu introducerea următoarei alchene, butena, începem să observăm o problemă majoră cu moleculele organice: alegerile. Cu patru atomi de C, dubla legătură C-C poate merge între primul și al doilea atom de C sau între al doilea și al treilea atom de C:
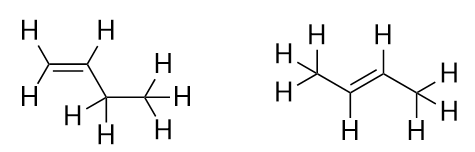
(O dublă legătură între al treilea și al patrulea atom de C este la fel ca și cum ar fi între primul și al doilea atom de C, doar că este răsturnată). Regulile de denumire în chimia organică impun ca aceste două substanțe să aibă nume diferite. Prima moleculă se numește but-1-ene, în timp ce a doua moleculă se numește but-2-ene. Numărul dintre numele și sufixul lanțului parental este cunoscut sub numele de locant și indică pe ce carbon își are originea dubla legătură. Cel mai mic număr posibil este utilizat pentru a numerota o caracteristică dintr-o moleculă; prin urmare, numirea celei de-a doua molecule but-3-ene ar fi incorectă. Numerele sunt părți comune ale denumirilor chimice organice, deoarece indică ce atom de C dintr-un lanț conține o caracteristică distinctivă. Atunci când dubla legătură (sau altă grupare funcțională) este situată pe primul carbon, este o practică obișnuită pentru unii autori să omită locantul. De exemplu, dacă butenul ar fi scris fără locant, ar trebui să presupuneți că se referă la but-1-ene, nu la but-2-ene.
Compușii but-1-ene și but-2-ene au proprietăți fizice și chimice diferite, chiar dacă au aceeași formulă moleculară-C4H8. Moleculele diferite cu aceeași formulă moleculară se numesc izomeri. Izomerii sunt comuni în chimia organică și contribuie la complexitatea acesteia.
Exemplul 1
Bazându-vă pe denumirile moleculelor de butenă, propuneți un nume pentru această moleculă.
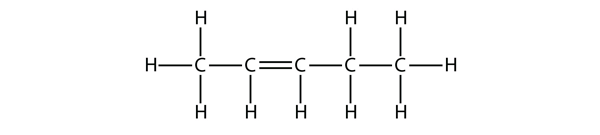
Soluție
Cu cinci atomi de C, vom folosi denumirea de pent- părinte, iar cu o dublă legătură C-C, aceasta este o alcană, deci această moleculă este o pentenă. La numerotarea atomilor de C, vom folosi numărul 2 deoarece este cea mai mică etichetă posibilă. Deci această moleculă se numește pent-2-ene.
Test Yourself
Pe baza denumirilor moleculelor de butenă, propuneți un nume pentru această moleculă.
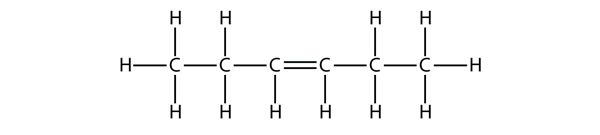
Răspuns
hex-3-ene
Alchenele, cu o legătură triplă C-C, sunt denumite în mod similar cu alchenele, cu excepția faptului că numele lor se termină în -yne. Cea mai mică alchină este etina, care este cunoscută și sub numele de acetilenă:
![]()
Propina are această structură:
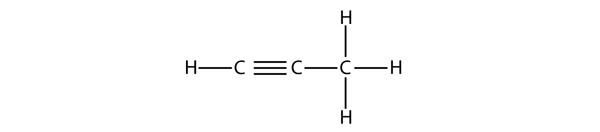
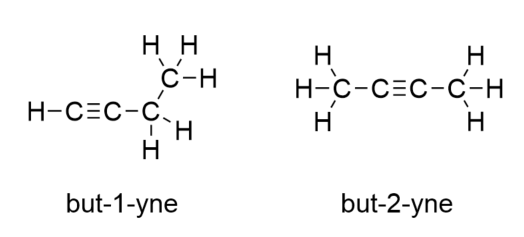
Cu butilena, trebuie să începem să numerotăm poziția legăturii triple, la fel cum am făcut cu alchenele:
Benzenul este un compus aromatic alcătuit din șase atomi de C într-un inel, cu legături C-C simple și duble alternante:
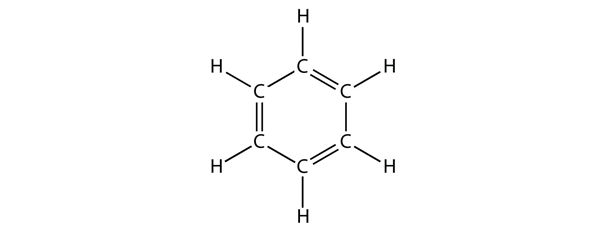
Legăturile C-C simple și duble alternante conferă inelului benzenic o stabilitate deosebită și nu reacționează ca o alchenă, așa cum ar fi de așteptat.
Pe cât de fundamentale sunt hidrocarburile pentru chimia organică, proprietățile și reacțiile lor chimice sunt mai degrabă banale. Majoritatea hidrocarburilor sunt nepolare din cauza electronegativității apropiate a atomilor de C și H. Ca atare, ele se dizolvă doar cu moderație în H2O și în alți solvenți polari. Hidrocarburile mici, cum ar fi metanul și etanul, sunt gaze la temperatura camerei, în timp ce hidrocarburile mai mari, cum ar fi hexanul și octanul, sunt lichide. Chiar și hidrocarburile mai mari, cum ar fi hentriacontanul (C31H64), sunt solide la temperatura camerei și au o consistență moale, ceroasă.
Hidrocarburile sunt mai degrabă nereactive, dar participă la unele reacții chimice clasice. O reacție comună este substituirea cu un atom de halogen prin combinarea unei hidrocarburi cu un halogen elementar. Lumina este uneori folosită pentru a favoriza reacția, cum ar fi aceasta dintre metan și clor:
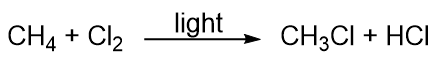
Halogenii pot, de asemenea, să reacționeze cu alchene și alchene, dar reacția este diferită. În aceste cazuri, moleculele de halogen reacționează cu legătura dublă sau triplă C-C și se atașează pe fiecare atom de C implicat în legăturile multiple. Această reacție se numește reacție de adiție. Un exemplu este
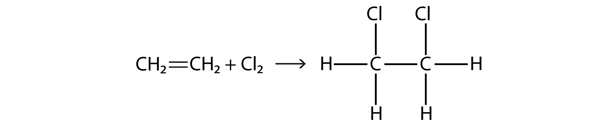
Condițiile de reacție sunt de obicei blânde; în multe cazuri, halogenul reacționează spontan cu o alchenă sau o alchină.
Hidrogenul poate fi, de asemenea, adăugat de-a lungul unei legături multiple; această reacție se numește reacție de hidrogenare. Cu toate acestea, în acest caz, condițiile de reacție pot să nu fie blânde; pot fi necesare presiuni mari de gaz H2. Un catalizator din platină sau paladiu este de obicei utilizat pentru ca reacția să se desfășoare într-un ritm rezonabil:
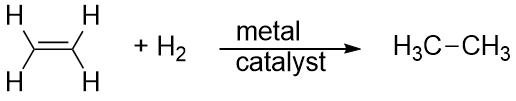
De departe cea mai comună reacție a hidrocarburilor este combustia, care este combinarea unei hidrocarburi cu O2 pentru a obține CO2 și H2O. Arderea hidrocarburilor este însoțită de o eliberare de energie și reprezintă o sursă primară de producere a energiei în societatea noastră (figura 16.2 „Combustia”). Reacția de combustie pentru benzină, de exemplu, care poate fi reprezentată prin C8H18, este următoarea:
2 C8H18 + 25 O2 → 16 CO2 + 18 H2O + ~5060 kJ
Figura 16.2 Combustie

.