Antibiotika odstraňují patogenní infekce a zachraňují životy – ale přitom také narušují integritu střevního mikrobiomu. Mnoho lékařů sice uznává potřebu obnovit mikrobiální rovnováhu pacienta po léčbě antibiotiky, ale mnohem méně z nich rozumí tomu, jak to efektivně provést.
Podle Amie Skiltonové, ND, je obnovení střevní flóry uměním i vědou. Pokud se provede dobře, může pro pacienty znamenat velký rozdíl. V některých případech může dokonce pomoci pacientům překonat nemoci, kvůli kterým jim byla původně předepsána antibiotika.
Ale je potřeba víc než jen doporučit volně prodejné probiotikum a doufat v to nejlepší.
Centrum pro kontrolu nemocí loni na jaře uvedlo, že ze 154 milionů receptů na antibiotika, které jsou každoročně předepsány v ordinacích lékařů a na pohotovostech, je 30 procent zbytečných. Většina zbytečných receptů, jak zjistila CDC, byla vydána na respirační onemocnění způsobená viry, jako je běžné nachlazení, virové bolesti v krku, bronchitida a infekce dutin a uší, které nereagují na antibiotika. Užívání těchto léků „vystavuje pacienty zbytečnému riziku alergických reakcí nebo někdy smrtelného průjmu, Clostridium difficile.“
Obrázek dále komplikuje skutečnost, že antibiotika se nerozšiřují pouze z ordinací lékařů; jsou také hojně podávána hospodářským zvířatům a ve velké míře se jimi stříkají produkty, což zanechává nepatrné, ale biologicky aktivní stopy v potravinách, které pak konzumují lidé.
Dávky, načasování určují dopad
Jak antibiotika hubí mikroorganismy způsobující infekce, tak také neselektivně ničí společenství prospěšných střevních bakterií, čímž oslabují stabilitu střevního mikrobiomu. Tato plošná destrukce může být masivní; experimentální data získaná ze studie využívající qPCR naznačují až desetinásobné snížení počtu bakteriálních izolátů bezprostředně po léčbě antibiotiky (Panda, S. et al. PLoS One. 2014; 9(4): e95476).
„Je to skutečně decimující účinek,“ říká Dr. Skilton, naturopatický lékař a bylinkář na klinice přírodní medicíny Elysium v Sydney, Nový Jižní Wales, Austrálie.
Ve webináři sponzorovaném společností Holistic Primary Care and Bioceuticals nastínila nesčetné dopady antibiotik na lidský mikrobiom s tím, že ne všechna antibiotika jsou pro střevní bakterie stejně destruktivní.
Míra poškození střevní mikroflóry těmito léky závisí na typu léku, délce léčby a četnosti užívání, uvedla Skiltonová. Některá antibiotika například vyvolávají větší uvolňování endotoxinů a cytokinů než jiná. Větší vliv mají vyšší denní dávky. Dlouhodobé užívání vysokých dávek antibiotik může způsobit extrémní poškození mikrobiomu, které může být zvráceno až po letech obnovovací léčby, pokud se to vůbec podaří.
A v rozporu s obecným přesvědčením mohou mít intravenózní antibiotika stejný negativní dopad na střevní flóru jako perorální léky. „Dlouho se mělo za to, že intravenózní léky střeva obcházejí a nemají stejný dopad. Nyní víme, že to není pravda.“
Záleží také na načasování podání antibiotika. Jedinci, kteří na počátku života často užívají antibiotika, jsou ve stáří náchylnější k mnoha typům onemocnění. V práci publikované na začátku tohoto roku vědci prokázali souvislost mezi užíváním antibiotik v kojeneckém věku a následnými špatnými neurokognitivními výsledky, což naznačuje, že užívání antibiotik v prvním roce života pacienta bylo spojeno s malými, ale statisticky významnými rozdíly v kognitivních, behaviorálních a náladových ukazatelích během dětství (Slykerman, R. et al. Acta Paediatr. 2017; 106(1): 87-94).
Další studie spojují expozici plodu a raného dětství antibiotikům s následným rozvojem astmatu v pozdějším věku (Örtqvist, A. et al. Brit Med J. 2014; 349. doi: https://doi.org/10.1136/bmj.g6979). Antibiotika jsou také spojována s obezitou a nárůstem hmotnosti u dětí i dospělých (Million, M. et al. Clin Microbiol & Infec. 2013; 19(4): 305-313). Vědci tyto změny přičítají změněnému složení střevní mikroflóry.
Antibiotika mohou vyvolat uvolňování toxických lipopolysacharidů (LPS), velkých molekul, které se nacházejí ve vnějších membránách patogenních gramnegativních bakterií. Podle některých názorů může uvolňování LPS vyvolané antibiotiky přispívat k rozvoji septického šoku u pacientů léčených pro závažné infekce způsobené gramnegativními bakteriemi. Jiní prokázali, že LPS spouští imunitní reakci uvolňováním zánětlivých cytokinů, což je problém, který se po léčbě antibiotiky zhoršuje, poznamenala Skiltonová na svém webináři (Wu, T. et al. Toxicol Lett. 2009; 191(2-3): 195-202).
Z pohledu patogenu je produkce LPS strategií přežití. Tyto molekuly interagují na povrchu buněk a vytvářejí bariéru, která brání průniku antibiotik a dalších hydrofobních sloučenin a umožňuje gramnegativním bakteriím žít i v drsném prostředí (Zhang, G. et al. Curr Opin Microbiol. 2013; 16(6): 779-785).
Jak obnovit střevní flóru
Probiotika jsou jedním z aspektů komplexní strategie obnovy střevní flóry po podání antibiotik. Vzhledem k mikrobiální rozmanitosti zdravého střevního ekosystému doporučuje Skilton používat přípravky, které obsahují mnoho různých druhů prospěšných mikrobů, a ne „monokulturu“ s jedním nebo dvěma jedinými kmeny.
Jako obecné pravidlo doporučuje jeden měsíc probiotické léčby za každý týden, kdy pacient užíval antibiotika. Ti, kteří byli na dlouhodobých nepřetržitých antibiotických režimech, budou podobně potřebovat dlouhodobou obnovu. Zdůraznila, že pro většinu lidí nejsou s dlouhodobým podáváním probiotik spojena žádná zdravotní rizika.
Pacienti, kteří dostávají intravenózně antibiotika, by měli užívat také komenzální probiotika. Někteří lékaři, kteří si jsou tohoto problému vědomi, nasazují probiotika již čtyři hodiny po podání intravenózní dávky antibiotik.
Obnovení glykokalyxu
U lidí, kteří dlouhodobě nebo opakovaně užívali antibiotika, se obvykle projevuje silná eroze glykokalyxu, který normálně pokrývá střevní mikrovily. To je obvykle doprovázeno ztrátou kartáčových okrajů a výrazným snížením sekreční produkce IgA.
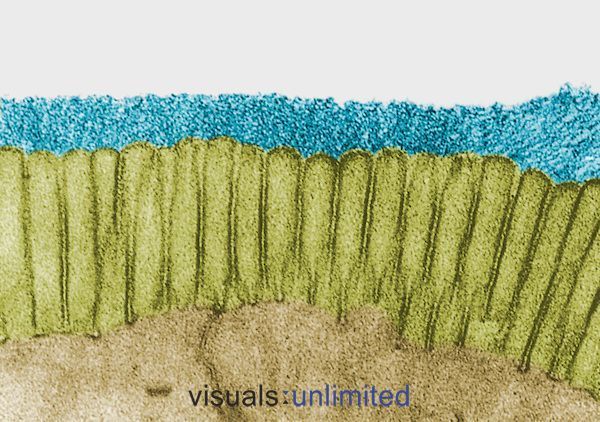 V některých případech jsou tyto změny způsobeny samotnými účinky antibiotik. V jiných odrážejí dopad infekce, na kterou byla antibiotika předepsána. Ať tak či onak, účinek je stejný: vytvoření mikroprostředí, které je pohostinné pro oportunní patogeny, jako je Candida, ale stále obtížnější pro normální komenzální bakterie.
V některých případech jsou tyto změny způsobeny samotnými účinky antibiotik. V jiných odrážejí dopad infekce, na kterou byla antibiotika předepsána. Ať tak či onak, účinek je stejný: vytvoření mikroprostředí, které je pohostinné pro oportunní patogeny, jako je Candida, ale stále obtížnější pro normální komenzální bakterie.
Fungální infekce jsou téměř vždy doprovázeny nedostatečnou produkcí IgA, protože Candida spotřebovává glykokalyx i sIgA jako palivo. Stává se z toho začarovaný kruh: nízká hladina IgA plodí kandidu, která dále vyčerpává IgA. Chronické infekce močových cest a infekce sliznic, jako je afty, jsou červeným signálem nízké produkce sIgA, upozornil Skilton.
Bez zdravého glykokalyxu mají organismy, jako jsou laktobacily a bifidobacily, velké problémy se prosadit. V této souvislosti obvykle selhává doplňování běžných probiotik.
„I když doporučíte sebelepší probiotika na světě, nemají šanci se uchytit a kolonizovat, pokud je glykokalyx narušen,“ vysvětlil doktor Skilton. „Pokud dojde ke ztrátě schopnosti produkovat glykokalyx, můžete podáváním probiotik ve skutečnosti přehnat symptomy trávicího traktu.“
K obnovení zdravějšího mikroprostředí v těchto případech je třeba využít jedinečných vlastností Saccharomyces boulardii, probiotických kvasinek odolných vůči antibiotikům, které byly původně izolovány z plodů liči v Indočíně. Ačkoli S. boulardii nepatří mezi skutečné komenzály, je silným induktorem produkce glykokalyxů a sekrece IgA. Stimuluje také enzymy na hranici kartáčku a podporuje produkci polyaminů, které vyživují střevní mikrovily a mohou být užitečné při hojení ulcerózní kolitidy, Crohnovy choroby a syndromu dráždivého tračníku.
S. boulardii je schopna působit v kontextu vysoce patogenních bakterií rezistentních vůči antibiotikům, jako je Clostridium difficile, a byla skutečně použita jako preventivní terapie proti průjmu spojenému s C. difficile (Goldstein, E. et al. Clin Infect Dis. 2015; 60 (suppl_2): S148-S158). S. boulardii může snižovat některé toxické účinky enterotoxinu A tím, že inhibuje vazbu toxinu A na receptor a zabraňuje tvorbě enterotoxinu B.
Nejpozoruhodnější je však její schopnost rychle kolonizovat poškozený endotel a vytlačit patogenní kvasinky a současně vytvořit zdravější mikroprostředí pro komenzální bakterie. „S. boulardii si vlastně vynucuje fyzickou evakuaci kandid,“ řekl Dr. Skilton s tím, že je specificky aktivní proti 7 z 8 nejběžnějších patogenních druhů kandid. Jedinou výjimkou je C. tropicalis.
„Představte si situaci jako následky hurikánu, který zasáhl vesnici. Antibiotika jsou tím hurikánem. S. boulardii je jako dodavatel, který přijde a opraví škody na vesnici. Poté můžete vesnici znovu osídlit komenzály.“
Společnost BioCeuticals, australská nutraceutická společnost zaměřená pouze na praktické lékaře, nedávno představila produkt s názvem SB Floractiv, který poskytuje 250 mg S. boulardii (nazývané také S. cereviciae) v jedné kapsli.
U pacientů, kteří dlouhodobě užívali antibiotika, začněte pomalu s jednou kapslí (250 mg) denně po dobu 3-4 dnů, poté zvyšte dávku na dvě denně po dobu dalších 3-4 dnů a poté zvyšujte podobně postupně až na čtyři denně (1000 mg), které by měly být užívány po zbytek čtyřtýdenního období.
S. boulardii je velmi bezpečná a jedinou skutečnou kontraindikací jsou pacienti se skutečnými IgE zprostředkovanými reakcemi na kvasinky, projevujícími se anafylaxí nebo  vyrážkou. Přesto je důležité si uvědomit, že v prvních dnech užívání S. boulardii mohou někteří pacienti pociťovat znatelný „výplach střev“, protože probiotické kvasinky vytlačují druh Candida. Odumírání kandid může také způsobit, že se lidé budou cítit špatně. Nejlepší je pacienty o těchto možnostech předem informovat, aby nebyli překvapeni, pokud k nim dojde.
vyrážkou. Přesto je důležité si uvědomit, že v prvních dnech užívání S. boulardii mohou někteří pacienti pociťovat znatelný „výplach střev“, protože probiotické kvasinky vytlačují druh Candida. Odumírání kandid může také způsobit, že se lidé budou cítit špatně. Nejlepší je pacienty o těchto možnostech předem informovat, aby nebyli překvapeni, pokud k nim dojde.
Podle Dr. Skeltona jsou u 9 z 10 pacientů čtyři týdny intenzivního podávání S. boulardii siffucientní k obnovení zdravé vrstvy glykokalyxu a navození dostatečné sekrece IgA. To pak připravuje půdu pro mnohem účinnější kolo obnovy pomocí probiotika s více kmeny.
Bioceuticals navrhla přípravek speciálně pro použití po antibiotikách. Jmenuje se BioFloractiv 500 a obsahuje 500 miliard CFU, 12 druhů a 14 kmenů prospěšných bakterií. Dr. Skilton doporučuje maximálně 14 dní, i když podle něj většině pacientů postačí týdenní denní léčba.
Pacienti se syndromem dráždivého tračníku nebo Crohnovou chorobou však mohou potřebovat dlouhodobější podporu, aby po užívání antibiotik obnovili zdravý mikrobiom.
Komplexní přístup
Probiotika jsou jen jednou částí obrazu. A pokud pacient netoleruje žádný typ probiotika, je to červená vlajka, že pacientův imunitní systém nefunguje správně.
„Nejprve je třeba řešit všechny aspekty nervového systému, zejména dominanci sympatiku, které mohou ovlivňovat trávicí trakt,“ řekl doktor Skilton. V mnoha případech se jí osvědčil rybí tuk, zinek, vitamin A a kolostrum. Posledně jmenované „je opravdu dobré pro obnovení sIgA. Dělejte to zhruba týden, než vyzkoušíte i probiotika“. V některých případech mohou být užitečné také doplňky stravy s jilmem skvrnitým a glutaminem.
Při zbavování trávicího traktu patogenních kvasinek mohou pomoci léky na bázi rostlin, jako je oreganový olej, olej z čajovníku nebo extrakt pau d’arco. Dr. Skilton však zdůraznil, že tyto přípravky nijak nestimulují tvorbu sIgA a chronické kvasinkové infekce jsou téměř vždy spojeny s nízkou hladinou IgA. Tyto přírodní přípravky proti kvasinkám by se nikdy neměly používat současně se S. boulardii; tyto „přátelské“ kvasinky jsou stejně zranitelné vůči věcem, jako je oregano a tea tree, jako patogenní kvasinky.
Proces obnovy střev může podpořit řada probiotických a prebiotických potravin. Tom O’Bryan, DC, zakladatel Gluten Summitu a školicího programu Certified Gluten Practitioner, doporučuje při obnově střev po léčbě antibiotiky několik potravin, které je vhodné jíst – a několika, kterým je vhodné se vyhnout.
„Když byla vaše střeva narušena, nechcete je zatěžovat,“ říká O’Bryan. Mezi „zatěžující“ potraviny patří pšenice, mléčné výrobky, cukr, nezdravé tuky a smažené výrobky. Tyto potraviny, jak poznamenává, „přilévají benzín do ohně“ zotavujícího se střevního systému.
Na druhou stranu je třeba jíst dostatek potravin, které podporují růst zdravých komenzálních organismů. O’Bryan doporučuje jako jednu z dobrých možností organická dušená jablka, vařená, dokud nejsou měkká a lesklá. Vysvětluje, že vařením jablek se uvolňuje pektin – rozpustná vláknina, která poskytuje palivo pro prospěšné bakterie.
Pektin obsažený v dušených jablkách může také pomoci zacelit poškozenou střevní výstelku a utěsnit trhliny v netěsném střevě a zabránit proklouznutí velkých molekul potravy.
Podobně pomáhá utěsnit netěsné střevo kolagen. O’Bryan také doporučuje pacientům, kteří se zotavují po léčbě antibiotiky, aby jedli vývar z kuřecích kostí, který je dobrým zdrojem kolagenu, který působí také jako přírodní prebiotikum a vyživuje zdravé bakterie ve střevech.
Dalším důležitým hráčem při obnově střevních bakterií je butyrát – přírodní látka vytvářená ve střevech. O’Bryan vysvětluje, že buňky vystýlající vnitřek střeva se rychle množí a že butyrát podporuje obnovu nových buněk. Nedostatečná produkce butyrátu a pomalá obměna střevních buněk činí tělo zranitelnějším vůči vzniku rakovinných buněk, což vede k vyššímu riziku rakoviny tlustého střeva.
Řada prebiotického ovoce a zeleniny, včetně potravin typu banánů, sladkých brambor a dalších hlíz, pomáhá obnovovat střevní mikrobiom a poskytuje nerozpustnou vlákninu, která vyživuje dobré – ale ne škodlivé – bakterie.
Dalším vynikajícím zdrojem přírodních probiotik je fermentovaná, nepasterizovaná zelenina, jako je kysané zelí, kimči a fermentovaná řepa. Každá zelenina produkuje během fermentace různé rodiny prospěšných bakterií, poznamenává O’Bryan a doporučuje pacientům, aby dvakrát denně snědli jednu vidličku kvašené zeleniny. „Klíčem ke zdraví ve střevech je rozmanitost vašeho mikrobiomu,“ tvrdí a poukazuje na to, že ve střevech žijí a vzájemně se ovlivňují tisíce různých rodin bakterií, které mají rozsáhlý vliv na naše zdraví.
END