VIVO Patofyziologie
Struktura inzulínu
Inzulín se skládá ze dvou peptidových řetězců označovaných jako řetězec A a řetězec B. Inzulín se skládá ze dvou peptidových řetězců. Řetězce A a B jsou navzájem spojeny dvěma disulfidickými vazbami a další disulfid se tvoří uvnitř řetězce A. U většiny druhů se řetězec A skládá z 21 aminokyselin a řetězec B z 30 aminokyselin.
Ačkoli se aminokyselinová sekvence inzulinu u různých druhů liší, některé úseky molekuly jsou vysoce konzervované, včetně polohy tří disulfidických vazeb, obou konců řetězce A a C-koncových zbytků řetězce B. V případě inzulinu se jedná o řetězec B, který se skládá ze dvou částí. Tyto podobnosti v aminokyselinové sekvenci inzulinu vedou k trojrozměrné konformaci inzulinu, která je mezi druhy velmi podobná, a inzulin z jednoho zvířete je velmi pravděpodobně biologicky aktivní u jiných druhů. Prasečí inzulín se skutečně široce používá k léčbě lidských pacientů.
Molekuly inzulínu mají tendenci vytvářet v roztoku dimery v důsledku vodíkové vazby mezi C-konci B řetězců. V přítomnosti zinečnatých iontů se navíc inzulinové dimery sdružují do hexamerů.
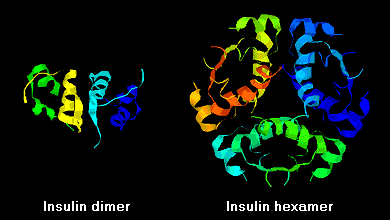
Tyto interakce mají důležité klinické důsledky. Monomery a dimery snadno difundují do krve, zatímco hexamery difundují špatně. Proto je absorpce inzulinových přípravků obsahujících vysoký podíl hexamerů opožděná a poněkud pomalá. Tento jev mimo jiné podnítil vývoj řady rekombinantních inzulinových analogů. První z těchto molekul, která byla uvedena na trh – nazývá se inzulin lispro – je upravena tak, že lysinové a prolinové zbytky na C-konci řetězce B jsou obráceny; tato úprava nemění vazbu na receptor, ale minimalizuje tendenci k tvorbě dimerů a hexamerů.
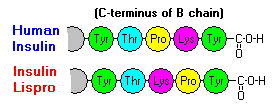 .
.