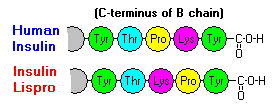VIVO Pathofysiologie
Structuur van insuline
Insuline is opgebouwd uit twee peptideketens, die de A- en de B-keten worden genoemd. A en B ketens zijn met elkaar verbonden door twee disulfide bindingen, en een extra disulfide wordt gevormd binnen de A keten. Bij de meeste soorten bestaat de A keten uit 21 aminozuren en de B keten uit 30 aminozuren.
Hoewel de aminozuursequentie van insuline per soort varieert, zijn bepaalde segmenten van het molecuul in hoge mate geconserveerd, waaronder de posities van de drie disulfidebindingen, beide uiteinden van de A keten en de C-terminale residuen van de B keten. Deze overeenkomsten in de aminozuursequentie van insuline leiden tot een driedimensionale conformatie van insuline die zeer vergelijkbaar is tussen soorten, en insuline van het ene dier is zeer waarschijnlijk biologisch actief in andere soorten. Varkensinsuline is zelfs op grote schaal gebruikt voor de behandeling van menselijke patiënten.
Insulinemoleculen hebben de neiging om in oplossing dimeren te vormen als gevolg van waterstofbruggen tussen de C-termini van B-ketens. Bovendien kunnen insulinedimeren zich in aanwezigheid van zinkionen verenigen tot hexameren.
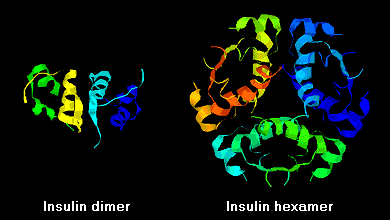
Deze interacties hebben belangrijke klinische vertakkingen. Monomeren en dimeren diffunderen gemakkelijk in het bloed, terwijl hexameren slecht diffunderen. De absorptie van insulinepreparaten met een hoog gehalte aan hexameren verloopt dan ook vertraagd en enigszins traag. Onder meer dit verschijnsel heeft de ontwikkeling van een aantal recombinante insuline-analoga gestimuleerd. De eerste van deze moleculen die op de markt is gebracht – insuline lispro genaamd – is zodanig gemodificeerd dat de lysine- en proline-residuen aan het C-terminale uiteinde van de B-keten zijn omgedraaid; deze modificatie verandert de receptorbinding niet, maar minimaliseert de neiging tot vorming van dimeren en hexameren.