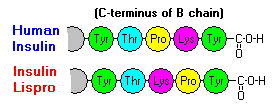VIVO Pathophysiologie
Struktur von Insulin
Insulin besteht aus zwei Peptidketten, die als A- und B-Kette bezeichnet werden. Die A- und B-Ketten sind durch zwei Disulfidbindungen miteinander verbunden, und ein zusätzliches Disulfid wird innerhalb der A-Kette gebildet. Bei den meisten Spezies besteht die A-Kette aus 21 Aminosäuren und die B-Kette aus 30 Aminosäuren.
Obwohl die Aminosäuresequenz von Insulin von Spezies zu Spezies variiert, sind bestimmte Segmente des Moleküls in hohem Maße konserviert, einschließlich der Positionen der drei Disulfidbindungen, beider Enden der A-Kette und der C-terminalen Reste der B-Kette. Diese Ähnlichkeiten in der Aminosäuresequenz des Insulins führen zu einer dreidimensionalen Konformation des Insulins, die bei verschiedenen Tierarten sehr ähnlich ist, und das Insulin eines Tieres ist sehr wahrscheinlich auch bei anderen Arten biologisch aktiv. Tatsächlich wurde Schweineinsulin in großem Umfang zur Behandlung menschlicher Patienten eingesetzt.
Insulinmoleküle neigen aufgrund von Wasserstoffbrückenbindungen zwischen den C-Termini der B-Ketten dazu, in Lösung Dimere zu bilden. Außerdem verbinden sich Insulindimere in Gegenwart von Zinkionen zu Hexameren.
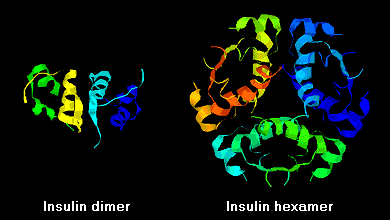
Diese Wechselwirkungen haben wichtige klinische Auswirkungen. Monomere und Dimere diffundieren leicht ins Blut, während Hexamere nur schlecht diffundieren. Daher wird die Aufnahme von Insulinpräparaten mit einem hohen Anteil an Hexameren verzögert und etwas langsamer. Dieses Phänomen hat unter anderem die Entwicklung einer Reihe von rekombinanten Insulinanaloga angeregt. Das erste dieser Moleküle, das auf den Markt kommt – Insulin lispro – ist so konstruiert, dass die Lysin- und Prolinreste am C-terminalen Ende der B-Kette vertauscht sind; diese Modifikation verändert nicht die Rezeptorbindung, sondern minimiert die Tendenz zur Bildung von Dimeren und Hexameren.