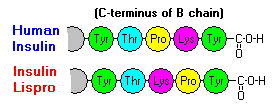VIVO Physiopathologie
Structure de l’insuline
L’insuline est composée de deux chaînes peptidiques appelées chaîne A et chaîne B. Les chaînes A et B sont liées entre elles par deux liaisons disulfure, et un disulfure supplémentaire est formé au sein de la chaîne A. Chez la plupart des espèces, la chaîne A est constituée de 21 acides aminés et la chaîne B de 30 acides aminés.
Bien que la séquence d’acides aminés de l’insuline varie selon les espèces, certains segments de la molécule sont hautement conservés, notamment les positions des trois liaisons disulfure, les deux extrémités de la chaîne A et les résidus C-terminaux de la chaîne B. Ces similitudes dans la séquence d’acides aminés de l’insuline conduisent à une conformation tridimensionnelle de l’insuline qui est très similaire entre les espèces, et l’insuline d’un animal est très probablement biologiquement active dans d’autres espèces. En effet, l’insuline de porc a été largement utilisée pour traiter des patients humains.
Les molécules d’insuline ont tendance à former des dimères en solution en raison de la liaison hydrogène entre les terminaisons C des chaînes B. De plus, en présence d’ions zinc, les dimères d’insuline s’associent en hexamères.
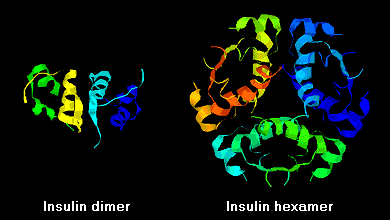
Ces interactions ont des ramifications cliniques importantes. Les monomères et les dimères diffusent facilement dans le sang, alors que les hexamères diffusent mal. Par conséquent, l’absorption des préparations d’insuline contenant une forte proportion d’hexamères est retardée et quelque peu lente. Ce phénomène, entre autres, a stimulé le développement d’un certain nombre d’analogues de l’insuline recombinante. La première de ces molécules à être commercialisée – appelée insuline lispro – est conçue de telle sorte que les résidus lysine et proline de l’extrémité C-terminale de la chaîne B sont inversés ; cette modification n’altère pas la liaison au récepteur, mais minimise la tendance à former des dimères et des hexamères.