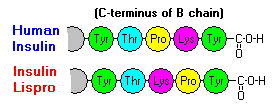VIVO Patofysiologia
Insuliinin rakenne
Insuliini koostuu kahdesta peptidiketjusta, joita kutsutaan A- ja B-ketjuksi. A- ja B-ketjut liittyvät toisiinsa kahdella disulfidisidoksella, ja A-ketjuun muodostuu lisäksi yksi disulfidi. Useimmilla lajeilla A-ketju koostuu 21 aminohaposta ja B-ketju 30 aminohaposta.
Vaikka insuliinin aminohapposekvenssi vaihtelee eri lajien välillä, tietyt molekyylin osat ovat hyvin konservoituneita, mukaan lukien kolmen disulfidisidoksen sijainnit, A-ketjun kumpikin pää ja B-ketjun C-terminaaliset jäännökset. Nämä samankaltaisuudet insuliinin aminohapposekvenssissä johtavat siihen, että insuliinin kolmiulotteinen konformaatio on hyvin samankaltainen eri lajeissa, ja yhden eläimen insuliini on hyvin todennäköisesti biologisesti aktiivinen muissa lajeissa. Sian insuliinia onkin käytetty laajalti ihmispotilaiden hoidossa.
Insuliinimolekyyleillä on taipumus muodostaa liuoksessa dimeerejä, mikä johtuu B-ketjujen C-terminaalien välisestä vetysidoksesta. Lisäksi sinkki-ionien läsnä ollessa insuliinidimeerit yhdistyvät heksaameereiksi.
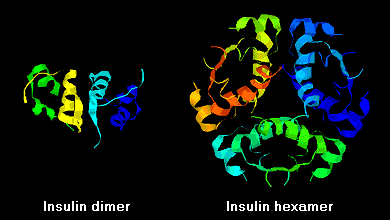
Näillä vuorovaikutuksilla on merkittäviä kliinisiä vaikutuksia. Monomeerit ja dimeerit diffundoituvat helposti vereen, kun taas heksaamerit diffundoituvat huonosti. Näin ollen runsaasti heksaameereja sisältävien insuliinivalmisteiden imeytyminen on viivästynyttä ja jokseenkin hidasta. Muun muassa tämä ilmiö on edistänyt useiden rekombinanttiinsuliinianalogien kehittämistä. Ensimmäinen näistä markkinoille saatetuista molekyyleistä – nimeltään insuliini lispro – on kehitetty siten, että B-ketjun C-pään lysiini- ja proliinijäämät on käännetty päinvastaisiksi; tämä modifikaatio ei muuta reseptorin sitoutumista, mutta minimoi taipumuksen muodostaa dimeerejä ja heksaameja.