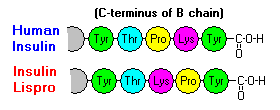VIVO Patofysiologi
Insulins struktur
Insulin består af to peptidkæder, der kaldes A-kæden og B-kæden. A- og B-kæderne er forbundet med hinanden af to disulfidbindinger, og der dannes yderligere et disulfid i A-kæden. Hos de fleste arter består A-kæden af 21 aminosyrer og B-kæden af 30 aminosyrer.
Og selv om insulins aminosyresekvens varierer fra art til art, er visse segmenter af molekylet stærkt bevaret, herunder positionerne af de tre disulfidbindinger, begge ender af A-kæden og de C-terminale rester af B-kæden. Disse ligheder i insulins aminosyresekvens fører til en tredimensionel konformation af insulin, der er meget ens blandt arter, og insulin fra et dyr er med stor sandsynlighed biologisk aktivt i andre arter. Faktisk er insulin fra svin blevet anvendt i vid udstrækning til behandling af menneskelige patienter.
Insulinmolekyler har en tendens til at danne dimerer i opløsning på grund af hydrogenbinding mellem B-kædens C-terminaler. I tilstedeværelse af zinkioner associerer insulindimere sig desuden til hexamere.
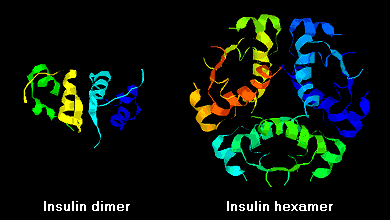
Disse interaktioner har vigtige kliniske konsekvenser. Monomerer og dimerer diffunderer let i blodet, hvorimod hexamere diffunderer dårligt. Derfor er absorptionen af insulinprжparater, der indeholder en stor andel hexamere, forsinket og noget langsom. Dette fænomen har bl.a. stimuleret udviklingen af en række rekombinante insulinanaloger. Det første af disse molekyler, der markedsføres – kaldet insulin lispro – er konstrueret således, at lysin- og prolinrester på den C-terminale ende af B-kæden er omvendt; denne modifikation ændrer ikke receptorbindingen, men minimerer tendensen til at danne dimerer og hexamerer.