ABSTRACT: De tilgængelige antiretrovirale lægemidler (ARV) til behandling af hiv er blevet udvidet siden 2018. Nye typer ARV-præparater med nye virkningsmekanismer er blevet godkendt, herunder ibalizumab-uiyk og fostemsavir. Der er også sket godkendelser af kombinationstabletter af tidligere tilgængelige lægemidler, såsom bictegravir/emtricitabin/tenofovir alafenamid og dolutegravir/lamivudin. Endelig er der sket en udvidelse af de godkendte indikationer for tidligere tilgængelige ARV’er i sig selv, såsom emtricitabin/tenofovir alafenamid til brug i præeksponeringsprofylakse.
US Pharm. 2020:45(10):17-25.
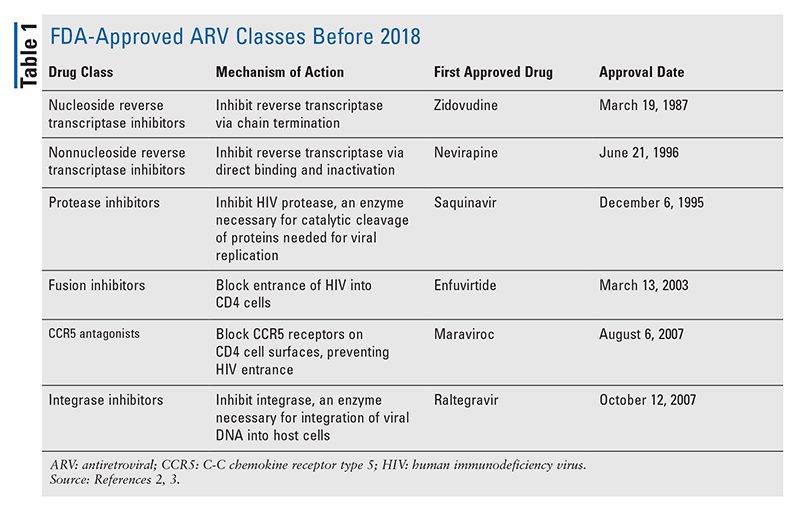
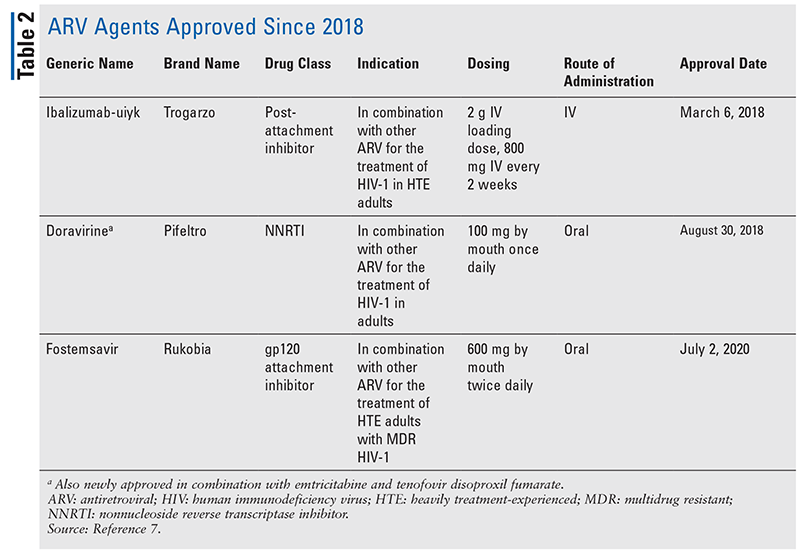
De vigtigste grundpiller af antiretrovirale (ARV) midler til behandling af hiv har i årevis stort set bestået af den samme håndfuld lægemiddelklasser. HIV-behandling blev først forsøgt med nukleoside omvendte transkriptaseinhibitorer (NRTI’er), den første FDA-godkendte klasse af ARV’er. Efterhånden blev flere og flere klasser opdaget og gjort tilgængelige til behandling i forskellige, ofte komplekse regimer (TABEL 1).1-3 Efter godkendelsen af raltegravir i 2007 var nye godkendelser af hiv-præparater i vid udstrækning til omprogrammering af eksisterende lægemidler og nye kombinationslægemidler. Dette ændrede sig i 2018 med godkendelsen af ibalizumab-uiyk, det første nye ARV i over et årti.4 Ibalizumab-uiyk blev hurtigt efterfulgt af en ny ikke-nukleosid revers transkriptasehæmmer (NNRTI), doravirin, senere samme år og en ny tilknytningshæmmer, fostemsavir, i 2020 (TABEL 2).5-7
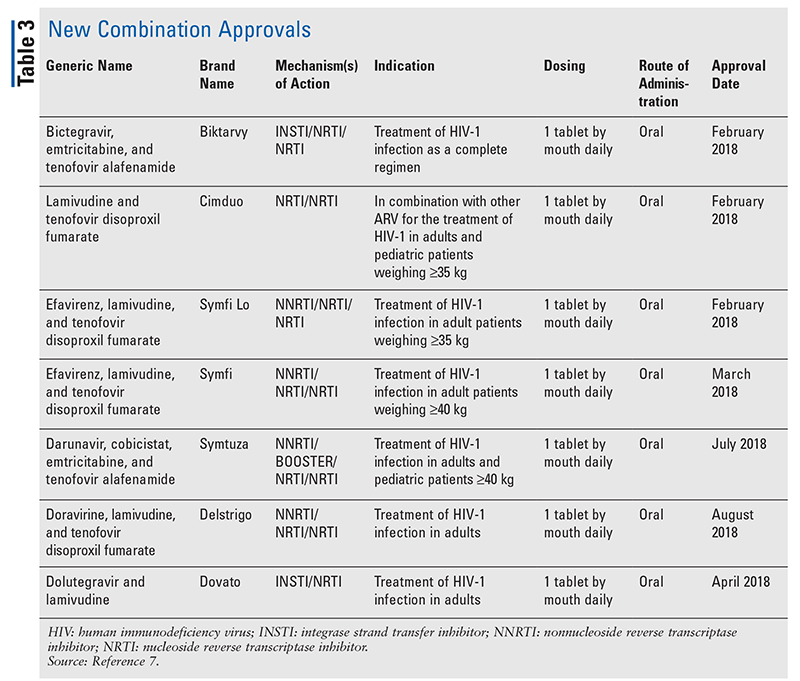
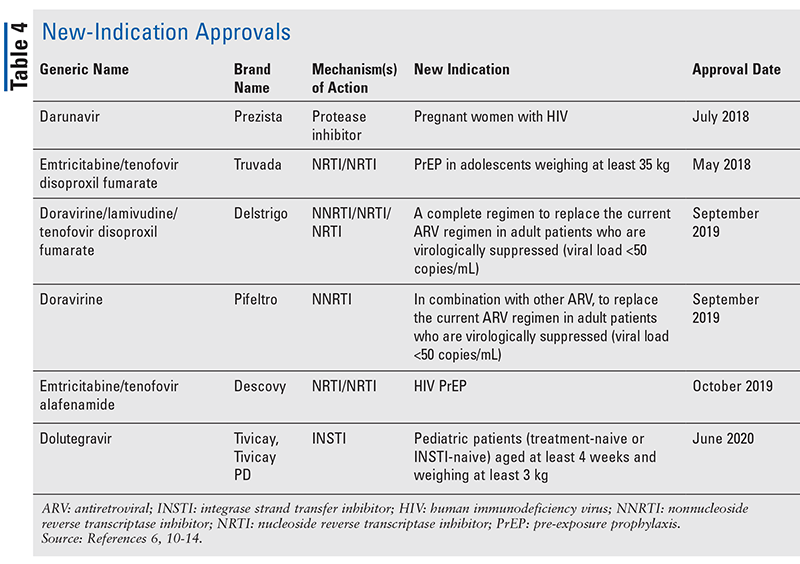
Mens nye lægemidler ofte er de mest spændende nye lægemiddelgodkendelser, er ARV’er blevet forbedret på andre måder. I betragtning af den enorme pillebyrde i mange HIV-regimer kan de nyligt godkendte kombinations-ARV’er (TABEL 3) gøre livet meget lettere for patienterne. Anvendelse af sådanne midler og begrænsning af den nødvendige pillebyrde har vist forbedret overholdelse og samlede resultater.8,9 Der er også sket udvidelser af godkendte indikationer for tidligere tilgængelige ARV’er (TABEL 4), hvilket giver nye muligheder for visse patientpopulationer og indikationer.10-14
Og selv om der er mange nye godkendelser siden 2018, giver denne artikel en profil af fire af de nyligt godkendte lægemidler og en ny indikation. Disse godkendelser blev udvalgt for at demonstrere et udsnit af den brede vifte af nye midler, der bliver tilgængelige, samt for at fremhæve nogle nye muligheder, der giver en unik mulighed i behandlingen af hiv.
Ibalizumab-Uiyk (Trogarzo)
Ibalizumab-uiyk er et injicerbart rekombinant monoklonalt antistof, der binder sig til overfladeproteinerne i CD4-celler, hvilket fører til konformationsændringer, der forhindrer de trin efter tilknytning, der er nødvendige for hiv-1-fusion og indtrængen i cellen. Det er den eneste monoklonale medicin, der anvendes til behandling af hiv. På grund af sin unikke bindingsspecificitet blokerer ibalizumab-uiyk for viral indgang uden at forårsage immunosuppression, hvilket er et problem i forbindelse med mange monoklonale lægemidler.4,15 Det er indiceret i kombination med andre ARV’er til behandling af stærkt behandlingserfarne (HTE) voksne med multiresistent (MDR) hiv-1, som ikke kan klare deres nuværende ARV-behandlingsregime.4
Godkendelsen af ibalizumab-uiyk var baseret på et forsøg udført på 40 HTE-hiv-patienter med en viral belastning på mere end 1.000 kopier/mL og dokumenteret resistens over for mindst én NRTI, NNRTI og en proteasehæmmer. Patienterne skulle også have været i mindst 6 måneders behandling og skulle for nylig have fejlet behandling. Forsøget omfattede tre perioder, begyndende med en 6-dages periode, hvor baseline-viralbelastningen blev fastlagt og bekræftet (kontrolperiode). På dag 7 modtog patienterne en 2.000 mg ladedosis ibalizumab-uiyk ud over deres standard ART-regime (funktionel monoterapi periode). På dag 14 blev viral belastning genvurderet, og regimerne blev overvåget og justeret for at sikre korrekt aktivitet mod deres hiv-infektion. Ibalizumab-uiyk 800 mg blev administreret IV hver 2. uge indtil afslutningen af undersøgelsen (vedligeholdelsesperiode). Det primære endepunkt evaluerede forskellen i andelen af fald i viral belastning fra kontrolperioden til den funktionelle monoterapiperiode, specifikt ved at sammenligne procentdelen af patienter med et fald på ³0,5 log10 i den samlede viral belastning. I kontrolperioden blev det konstateret, at 3 % af patienterne havde et sådant fald, mens den funktionelle monoterapiperiode resulterede i, at 83 % af patienterne opfyldte det angivne fald i viral belastning. Ved udgangen af 25 uger opnåede 43 % af patienterne en viral belastning på <50 kopier/mL.16
Baseret på denne undersøgelse er den godkendte dosering af ibalizumab-uiyk en engangs IV-belastningsdosis på 2.000 mg, efterfulgt af en 800 mg IV-vedligeholdelsesdosis hver 2. uge.4,16 Der kræves omhyggelig overvågning i 1 time efter administration af den første infusion for infusionsrelaterede reaktioner, med efterfølgende infusionsovervågning reduceret til 15 minutter efter tolerering af den første dosis.4 Ibalizumab-uiyk synes ellers at være veltolereret; de mest negative virkninger forbundet med ibalizumab-uiyk var kvalme, svimmelhed og diarré.4,16
Fostemsavir (Rukobia)
Fostemsavir er et nyt ARV, der er indiceret til kombinationsbehandling af HTE-voksne med kendt MDR-hiv-1, specielt til patienter, der ikke kan klare den nuværende ART på grund af potentiel resistens, intolerance eller sikkerhedsovervejelser.4 Det er den første FDA-godkendte tilknytningshæmmer. Efter enzymatisk aktivering til det aktive molekyle temsavir binder det sig til gp120, et viralt envelope-glykoprotein, der er nødvendigt for viral vedhæftning til CD4-celler. Dette forhindrer viral indtrængen i CD4-celler, hvilket effektivt stopper viral replikation. På grund af denne nye mekanisme er det usandsynligt, at fostemsavir inducerer resistens mod sig selv gennem det selektive pres, der er forbundet med de fleste andre ARV’er.6,17
Fostemsavir blev evalueret for både sikkerhed og effekt i et randomiseret, dobbeltblindet, placebokontrolleret klinisk forsøg (BRIGHTE), der omfattede 371 HTE HIV-1 patienter.16,17 Patienterne i hovedkohorten blev behandlet med både deres baseline ART-regime sammen med enten fostemsavir 600 mg to gange dagligt eller placebo i i i alt 8 dage. Ved vurderingen på dag 8 udviste fostemsavir-patienterne signifikant lavere serumniveauer af viralt hiv-RNA. Efter denne indledende behandlingsperiode blev alle patienterne overgået til fostemsavir 600 mg to gange dagligt. Efter 24 uger opnåede 53 % af forsøgsdeltagerne effektive ikke påviselige niveauer af virussuppression, med en forbedring af suppressionen til 60 % i uge 96.17,18
Den mest almindeligt rapporterede bivirkning ved fostemsavir var kvalme. Mere alvorlige reaktioner, herunder forhøjelser af leverenzymer, blev rapporteret hos patienter med hepatitis B- eller C-koinfektion.17,18 Andre undersøgelser rapporterede mindre forekomst af hovedpine, udslæt og diarré. Den aktive metabolit temsavir metaboliseres af CYP3A4, så stærke induktorer såsom carbamazepin, rifampicin og perikum bør undgås for at forhindre nedsat serumkoncentration af temsavir.17-19
Bictegravir/Emtricitabin/TenofovirAlafenamid (Biktarvy)
Bictegravir/emtricitabin/tenofovir alafenamid (BIC/FTC/TAF) er en fast dosis, en gang daglig kombinationstablet, der indeholder en ny integrasehæmmer og to nukleosid/nucleotid-omvendt transkriptasehæmmere. De enkelte komponenter i Biktarvy er bictegravir 50 mg (en integrase-strengoverførselsinhibitor ), emtricitabin 200 mg (en NRTI) og tenofovir alafenamid 25 mg (en NRTI). BIC/FTC/TAF er indiceret som et komplet regime hos HIV-1-inficerede voksne uden tidligere ART eller til at erstatte det nuværende ART-regime hos patienter, der er virologisk undertrykt (viral belastning £ 50 kopier pr. mL) på et stabilt ARV-regime i mindst 3 måneder og uden historik for behandlingssvigt eller resistens over for de enkelte komponenter. Det mest betydningsfulde er, at det er et komplet regime med én pille, der ikke kræver andre ARV’er.20
BIC/FTC/TAF blev godkendt i 2018 efter fire kliniske forsøg. To af de kliniske forsøg testede effektiviteten og sikkerheden af BIC/FTC/TAF hos patienter uden ART-historik: Forsøg 1489 (randomiseret, BIC/FTC/TAF vs. abacavir/ dolutegravir/lamivudin, og forsøg 1490 (randomiseret, BIC/FTC/TAF vs. dolutegravir + emtricitabin/tenofovir alafenamid ).21,22 I forsøg 1489 blev det primære endepunkt for viral belastning <50 kopier/mL opnået hos 92 % af BIC/FTC/TAF-gruppen og 93 % af ABC/DTG/3TC-gruppen (behandlingsforskel på -0,6 %; 95 % konfidensinterval , -4,8 % til 3,6 %). I forsøg 1490 blev det primære endepunkt for viral belastning <50 kopier/mL opnået hos 89 % af BIC/FTC/TAF-gruppen og 93 % af DTG + FTC/TAF-gruppen (behandlingsforskel på -3,5 %; 95 % CI, -7,9 % til 1,0 %).21,22
De to andre forsøg testede effektiviteten og sikkerheden af BIC/FTC/TAF hos virologisk undertrykte patienter, som ville blive skiftet fra deres nuværende ART-regimer til BIC/FTC/TAF: Forsøg 1844 (randomiseret, skift fra dolutegravir plus abacavir/lamivudin eller ABC/DTG/3TC til BIC/FTC/TAF) og forsøg 1878 (åbent forsøg, skift fra atazanavir eller boosted darunavir plus abacavir/emtricitabin eller emtricitabin/tenofovir disoproxilfumarat til BIC/FTC/TAF).23,24 I forsøg 1844 blev det primære endepunkt for patienter, der mistede deres virologiske undertrykkelsesstatus (viral belastning ³50 kopier pr. mL), set hos 1 % af BIC/FTC/TAF-gruppen og <1 % af gruppen med den oprindelige behandling (behandlingsforskel på 0,7 %, 95 % CI, -1,0 % til 2,8 %). I forsøg 1878 blev det primære endepunkt for patienter, der mistede deres virologiske undertrykkelsesstatus, set hos 2 % af BIC/FTC/TAF-gruppen og 2 % af gruppen med det oprindelige regime (behandlingsforskel på 0,0 %; 95 % CI, -2,5 % til 2,5 %).23,24
BIC/FTC/TAF doseres én gang dagligt gennem munden med eller uden mad. De hyppigst rapporterede bivirkninger set hos patienterne var diarré, kvalme og hovedpine.20-24
Dolutegravir/Lamivudin (Dovato)
Kombinationen dolutegravir/lamivudin (DTG/3TC), en INSTI og NRTI, blev godkendt i 2019. Det er det første komplette regime med to lægemidler i faste doser til behandling af hiv-1-infektion hos behandlingsnaive voksne patienter. Dette står i kontrast til de traditionelt krævede muligheder for standardbehandlingsregimer med tre lægemidler. Dette kan give mulighed for patienter, der ikke kan tåle nogen af de mere almindelige tre-lægemiddelregimer på grund af bivirkninger eller uundgåelige lægemiddelinteraktioner.25,26
Effektiviteten og sikkerheden af kombinationen dolutegravir/lamivudin blev påvist i to identiske undersøgelser, GEMINI-1 og GEMINI-2.27 Disse undersøgelser omfattede i alt 1.433 HIV-1-inficerede, behandlingsnaive voksne, som blev randomiseret til at modtage et topræparatregime, dolutegravir 50 mg plus lamivudin 150 mg, eller et trepræparatregime, dolutegravir plus emtricitabin plus tenofovir disoproxilfumarat. Det primære endepunkt om opnåelse af en viral belastning <50 kopier/mL viste, at DTG/3TC ikke var bedre – 91 % af de 716 patienter, der fik to lægemidler, og 93 % af de 717 patienter, der fik tre lægemidler (behandlingsforskel på -1,7 %; 95 % CI, -4,4 % til 1,1 %) – da resultaterne af de to undersøgelser blev lagt sammen. De sammenlagte undersøgelser viste også, at der numerisk set var færre patienter, der havde lægemiddelrelaterede bivirkninger i to- og tre-præparatregimet sammenlignet med tre-præparatregimet (henholdsvis 126 ud af 716 og 169 ud af 717 ). På grund af den ikke-underordnede effekt og en lignende tolerabilitetsprofil var Department of Health and Human Services i stand til at medtage fast dosiskombinationen DTG/3TC i retningslinjerne for hiv/aids som et anbefalet indledende regime til de fleste personer med hiv.27
Kombinationen dolutegravir/lamivudin doseres én gang dagligt gennem munden med eller uden mad. De mest almindelige bivirkninger, der ses hos patienter, er hovedpine, kvalme, diarré, træthed og søvnløshed. Selv om det er en kombinationstablet med to lægemidler, er det ikke nødvendigt at administrere den sammen med andre ARV-medikamenter, da det er et komplet behandlingsregime.25-27
Emtricitabin/tenofovir alafenamid til præeksponeringsprofylakse (PrEP)
Siden 2012 har den eneste FDA-godkendte mulighed for PrEP været FTC/ TDF.11 Dette ændrede sig i 2019 med godkendelsen af kombinationen emtricitabin/tenofovir alafenamid (FTC/TAF),13 en strukturelt set lignende kombinationsmedicin. Det er nu indiceret til brug i PrEP hos ikke-inficerede patienter med høj risiko for hiv-overførsel via samleje. Dette udelukker patienter med risiko ved receptivt vaginalt samleje, da denne population endnu ikke er blevet evalueret.
Godkendelsen af PrEP er baseret på det nylige DISCOVER-forsøg, en randomiseret, dobbeltblindet undersøgelse, der sammenligner FTC/TAF med standardbehandling med FTC/TDF med hensyn til at reducere risikoen for at erhverve hiv-1-infektion hos mænd og transkønnede kvinder, der har sex med mænd og er i risiko for hiv-1-infektion.7 Forsøget blev gennemført som et randomiseret, dobbeltblindet parallelgruppeforsøg med en opfølgning på mindst 48 uger, hvor mindst 50 % af deltagerne havde 96 ugers opfølgning efter randomiseringen. Der blev indskrevet 5.399 deltagere, som blev randomiseret 1:1 til en af de to grupper. Undersøgelsens primære mål var at vurdere forekomsten af HIV-1-infektion pr. 100 personår. Blandt de 2.694 deltagere i FTC/TAF-armen blev der set hiv-1-incidens hos 7 patienter (0,16/100 personår). Blandt de 2 693 deltagere i FTC/TDF-armen blev der konstateret hiv-1-incidens hos 15 patienter (0,34/100 personår). Disse incidenser viser, at FTC/TAF ikke var ikke ringere end FTC/TDF hos deltagere i undersøgelsen, der var i risiko for at få hiv, og gav i sidste ende FDA mulighed for at tilføje PrEP til indikationerne for FTC/TAF.13
Den plads, som FTC/TAF har i hiv-behandlingen, er sandsynligvis stadig uklar. Selv om det har fundet anvendelse inden for andre områder af hiv-behandlingen, er dets fordele i forhold til alternativet i denne sammenhæng endnu ikke endeligt fastlagt. Selv om TAF ligner hinanden, kan den måske tilbyde en lavere forekomst af ændringer i knogletætheden og nyre dysfunktion, bivirkninger, der er forbundet med TDF. Denne forskel er dog ikke veletableret, idet nogle data tyder på, at denne fordel i regimer, der ikke omfatter en farmakokinetisk booster som f.eks. cobicistat eller ritonavir, måske ikke er klinisk signifikant. 27-29
Slutning
På grund af kompleksiteten af HIV og dets potentiale for resistens kan ARV-behandling hurtigt blive besværlig for patienterne. Fra 2018 og frem til i dag har det medicinske samfund oplevet en stor udvidelse af FDA-godkendte ARV-behandlinger til behandling af hiv. Disse behandlinger omfatter nye faste doser, kombinationstabletter, nye lægemidler, der virker gennem andre mekanismer end dem, der tidligere var på markedet, og endda nye indikationer for tidligere eksisterende medicin. Disse nye lægemidler har allerede haft indflydelse på de nuværende retningslinjer for behandling og kan hjælpe patienterne til at leve længere og sundere.
Indholdet i denne artikel er kun til oplysningsformål. Indholdet er ikke tænkt som en erstatning for professionel rådgivning. Tillid til oplysninger i denne artikel er udelukkende på egen risiko.
1. Vella S, Schwartländer B, Sow SP, et al. Historien om antiretroviral terapi og om dens gennemførelse i ressourcebegrænsede områder i verden. AIDS. 2012;26(10):1231-1241.
2. Arts EJ, Hazuda DJ. HIV-1 antiretroviral lægemiddelbehandling. Cold Spring Harb Perspect Med. 2012;2(4):a007161.
3. Chaudhuri S, Symons JA, Deval J. Innovation og tendenser i udviklingen og godkendelsen af antivirale lægemidler: 1987-2017 og fremover. Antiviral Res. 2018;155;155:76-88.
4. Trogarzo (ibalizumab-uiyk) indlægsseddel. Montreal, Quebec: Theratechnologies Inc; marts 2018.
5. Pifeltro (doravirine) indlægsseddel. Whitehouse Station, NJ: Merck & Co, Inc; marts 2019.
6. Rukobia (fostemsavir) indlægsseddel. Research Triangle Park, NC: GlaxoSmithKline; juli 2020.
7. Pan F, Chernew ME, Fendrick AM. Indflydelse af kombinationsmedicin med fast dosis på overholdelse af receptpligtig medicin. J Gen Intern Med. 2008;23(5):611-614.
8. Verma AA, Khuu W, Tadrous M,et al. Fixed-dose combination antihypertensive medications, adherence, and clinical outcomes: a population-based retrospective cohort study. PLoS Med. 2018;15(6):e1002584.
9. National Institutes of Health. HIVinfo. FDA-godkendte hiv-medicin. hivinfo.nih.gov/understanding-hiv/fact-sheets/fda-approved-hiv-medicines. Tilgået den 22. september 2020.
10. Prezista (darunavir) indlægsseddel. Titusville, NJ: Janssen Therapeutics; maj 2019.
11. Truvada (emtricitabin/tenofovir disoproxilfumarat) indlægsseddel. Foster City, CA: Gilead Sciences, Inc; juni 2004/2020.
12. Delstrigo (doravirin/lamivudin/tenofovir disproxil fumerat) indlægsseddel. White House Starion, NJ: Merck & Co, Inc; august 2018.
13. Descovy (emtricitabin/tenofovir alafenamid) indlægsseddel. Foster City, CA: Gilead Sciences, Inc; december 2019.
14. Tivicay (dolutegravir) indlægsseddel. Research Triangle Park, NC. GlaxoSmithKline; juni 2020.
15. Iacob SA, Iacob DG. Ibalizumab, der er rettet mod CD4-receptorer, et nyt molekyle i HIV-behandling. Front Microbiol. 2017;8:2323.
16. Emu B, Fessel J, Schrader S, et al. Fase 3-undersøgelse af ibalizumab til behandling af multiresistent hiv-1. N Engl J Med. 2018;379:645-654.
17. Li Z, Zhou N, Sun Y, et al. Aktivitet af HIV-1-vedhæftningsinhibitoren BMS-626529, den aktive komponent i prodrug BMS-663068, mod CD4-uafhængige vira og HIV-1-hylstre, der er resistente over for andre entry-inhibitorer. Antimicrob Agents Chemother. 2013:57(9):4172-4180.
18. Kozal M, Aberg J, Pialoux G. Fostemsavir hos voksne med multiresistent HIV-1-infektion. N Engl J Med. 2020;382(13):1232-1243.
19. Cahn P, Fink V, Patterson P. Fostemsavir: en ny CD4-tilhæftningsinhibitor. Curr Opin HIV AIDS. 2018;13(4):341-345.
20. Biktarvy (bictecgravir/emtricitabin/tenofovir alafenamid) indlægsseddel. Foster City, CA: Gilead Sceinces, Inc; februar 2018.
21. Gallant J, Lazzarin A, Mills M, et al. Bictegravir, emtricitabin og tenofovir alafenamid versus dolutegravir, abacavir og lamivudin til initialbehandling af hiv-1-infektion (GS-US-380-1489): et dobbeltblindet, multicenter, fase 3, randomiseret, kontrolleret non-inferiority forsøg. Lancet. 2017;390(10107):2063-2072.
22. Sax PE, Pozniak A, Montes M, et al. Coformuleret bictegravir, emtricitabin og tenofovir alafenamid versus dolutegravir med emtricitabin og tenofovir alafenamid, til initial behandling af HIV-1-infektion (GS-US-380-1490): et randomiseret, dobbeltblindet, multicenter, fase 3, non-inferiority forsøg. Lancet. 2017;390(10107):2073-2082.
23. Malina JM, Ward D, Brar I, et al. Skift til fast doseret bictegravir, emtricitabin og tenofovir alafenamid fra dolutegravir plus abacavir oglamivudin hos virologisk undertrykte voksne med hiv-1: 48 ugers resultater af et randomiseret, dobbeltblindet, multicenter, aktivt kontrolleret, fase 3, non-inferiority forsøg. Lancet HIV. 2018;5(7):E357-E365.
24. Daar ES, De Jesus E, Ruane P, et al. Efficacy and safety of switching to fixed-dose bictegravir, emtricitabine, and tenofovir alafenamide from boosted protease inhibitor-based regimens in virologically suppressed adults with HIV-1: 48-week results of a randomised, open-label, multicentre, phase 3, non-inferiority trial. Lancet HIV. 2018;5(7):e347-e356.
25. Dovato (dolutegravir/lamivudin) indlægsseddel. Research Triangle Park, NC: GlaxoSmithKline. Marts 2020.
26. Scott LJ. Dolutegravir/lamivudin enkelttabletregime: en gennemgang ved HIV-1-infektion. Drugs. 2020;80(1):61-72.
27. Cahn P, Madero JS, Arribas JR, et al. GEMINI Study Team. Dolutegravir plus lamivudin versus dolutegravir plus tenofovir disoproxilfumarat og emtricitabin hos antiretroviralt naive voksne med hiv-1-infektion (GEMINI-1 og GEMINI-2): uge 48-resultater fra to multicenter, dobbeltblindede, randomiserede, non-inferiority, fase 3-forsøg. Lancet. 2019;393(10167):143-155.
28. Mayer KH, Molina JM, Thompson MA, et al. Emtricitabin og tenofovir alafenamid vs. emtricitabin og tenofovir disoproxilfumarat til hiv-præekspositions-profylakse (DISCOVER): primære resultater fra et randomiseret, dobbeltblindet multicenter, aktivt kontrolleret, fase 3-non-inferioritetsforsøg. Lancet. 2020;396(10246):239-254.
29. Hill A, Hughes SL, Gotham D, Pozniak AL. Tenofovir alafenamid versus tenofovir disoproxilfumarat: Er der en reel forskel i effektivitet og sikkerhed? J Virus Erad. 2018;4(2):72-79.