ABSTRACT : Les médicaments antirétroviraux (ARV) disponibles pour le traitement du VIH se sont développés depuis 2018. De nouveaux types d’ARV avec de nouveaux mécanismes d’action ont été approuvés, notamment l’ibalizumab-uiyk et le fostemsavir. Des comprimés d’association de médicaments déjà disponibles ont également été approuvés, comme le bictegravir/emtricitabine/ténofovir alafenamide et le dolutegravir/lamivudine. Enfin, il y a eu une expansion des indications approuvées pour les ARV précédemment disponibles eux-mêmes, comme l’emtricitabine/tenofovir alafenamide pour une utilisation en prophylaxie pré-exposition.
US Pharm. 2020:45(10):17-25.
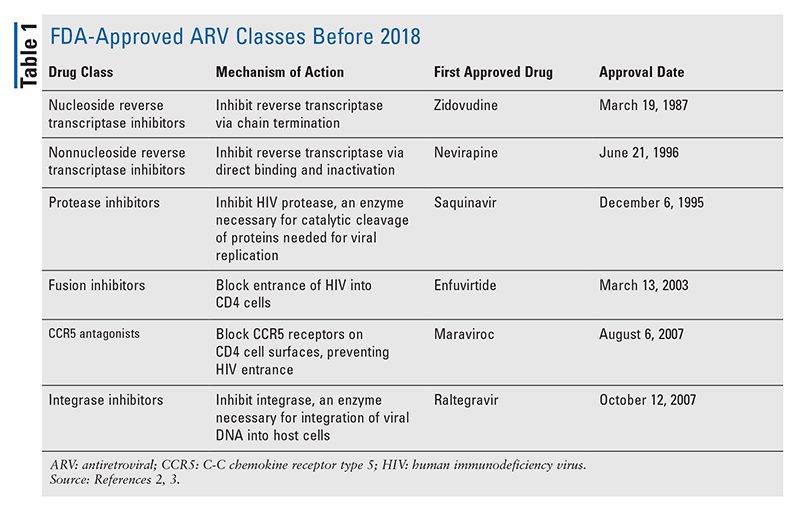
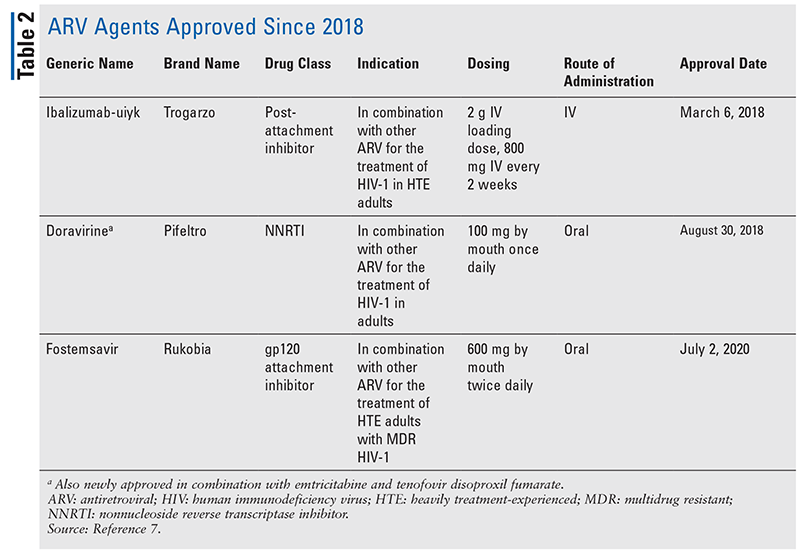
Les piliers des agents antirétroviraux (ARV) pour le traitement du VIH ont largement consisté en la même poignée de classes de médicaments pendant des années. Le traitement du VIH a d’abord été tenté avec les inhibiteurs nucléosidiques de la transcriptase inverse (INTI), la première classe d’ARV approuvée par la FDA. Progressivement, de plus en plus de classes ont été découvertes et mises à disposition pour le traitement dans divers régimes, souvent complexes (TABLEAU 1).1-3 Après l’approbation du raltégravir en 2007, les nouvelles approbations de médicaments contre le VIH concernaient principalement des médicaments disponibles réadaptés et de nouvelles associations médicamenteuses. Cela a changé en 2018 avec l’approbation de l’ibalizumab-uiyk, le premier nouvel ARV depuis plus d’une décennie4. L’ibalizumab-uiyk a été rapidement suivi d’un nouvel inhibiteur non nucléosidique de la transcriptase inverse (INNTI), la doravirine, plus tard cette année-là, et d’un nouvel inhibiteur d’attachement, le fostemsavir, en 2020 (TABLEAU 2).5-7
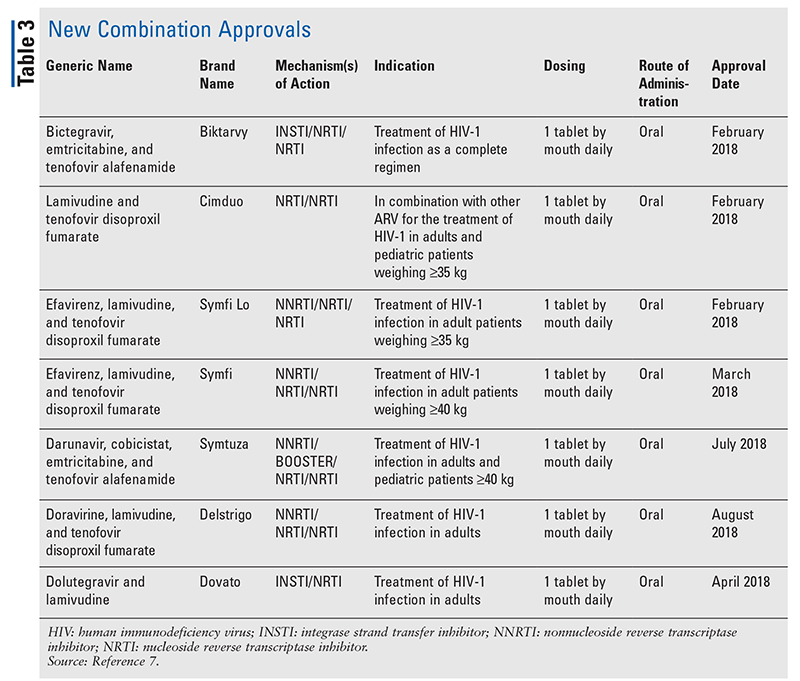
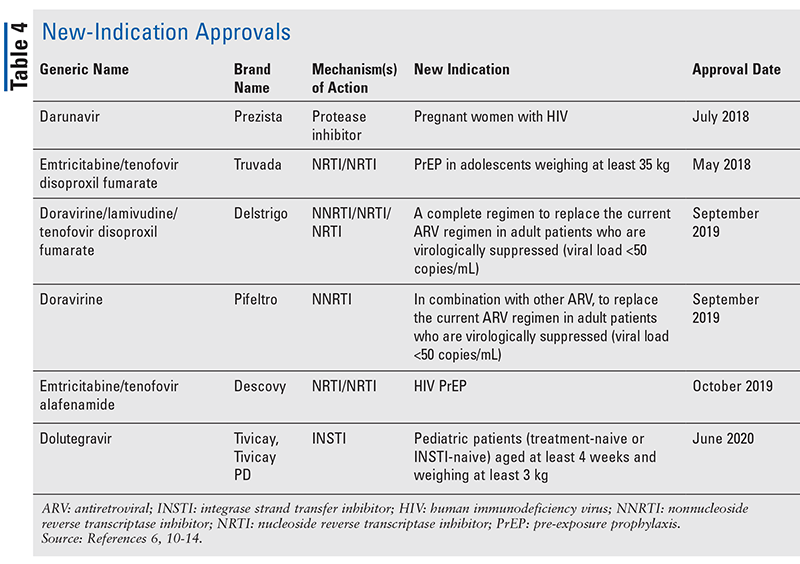
Bien que les nouveaux médicaments soient souvent les approbations de nouveaux médicaments les plus excitantes, les ARV se sont améliorés d’autres façons. Compte tenu de l’énorme charge en pilules de nombreux régimes anti-VIH, les ARV combinés récemment approuvés (TABLEAU 3) peuvent rendre la vie des patients beaucoup plus facile. L’utilisation de ces agents et la limitation de la charge de pilules nécessaire ont démontré une amélioration de l’adhésion et des résultats globaux.8,9 Il y a également eu des expansions dans les indications approuvées pour les ARV précédemment disponibles (TABLEAU 4), offrant de nouvelles options pour certaines populations de patients et indications.10-14
Bien qu’il y ait beaucoup de nouvelles approbations depuis 2018, cet article présente le profil de quatre des médicaments nouvellement approuvés et une nouvelle indication. Ces approbations ont été sélectionnées pour démontrer un échantillon de la grande variété de nouveaux agents qui deviennent disponibles, ainsi que pour souligner certaines nouvelles options qui offrent une opportunité unique dans le traitement du VIH.
Ibalizumab-Uiyk (Trogarzo)
L’ibalizumab-uiyk est un anticorps monoclonal recombinant injectable qui se lie aux protéines de surface des cellules CD4, entraînant des changements de conformation qui empêchent les étapes post-fixation nécessaires à la fusion et à l’entrée du VIH-1 dans la cellule. Il s’agit du seul médicament monoclonal utilisé dans le traitement du VIH. En raison de sa spécificité de liaison unique, l’ibalizumab-uiyk bloque l’entrée du virus sans provoquer d’immunosuppression, ce qui est un problème pour de nombreux médicaments monoclonaux.4,15 Il est indiqué en association avec d’autres ARV pour le traitement des adultes lourdement expérimentés en matière de traitement (HTE) atteints de VIH-1 multirésistant (MDR) et qui ne parviennent pas à suivre leur régime de traitement ARV actuel.4
L’approbation de l’ibalizumab-uiyk était basée sur un essai mené sur 40 patients VIH HTE ayant une charge virale supérieure à 1 000 copies/mL et une résistance documentée à au moins un INTI, un INNTI et un inhibiteur de protéase. Les patients devaient également avoir été traités pendant au moins 6 mois et avoir récemment échoué dans leur traitement. L’essai comprenait trois périodes, commençant par une période de 6 jours où la charge virale de base était établie et confirmée (période de contrôle). Le 7e jour, les patients ont reçu une dose de charge de 2 000 mg d’ibalizumab-uiyk en plus de leur traitement antirétroviral standard (période de monothérapie fonctionnelle). Au jour 14, la charge virale a été réévaluée et les régimes ont été surveillés et ajustés pour garantir une activité adéquate contre leur infection par le VIH. Ibalizumab-uiyk 800 mg a été administré par voie IV toutes les 2 semaines jusqu’à la fin de l’étude (période de maintien). Le critère principal a évalué la différence dans la proportion de diminution de la charge virale entre la période de contrôle et la période de monothérapie fonctionnelle, en comparant spécifiquement le pourcentage de patients présentant une diminution ³0,5 log10 de la charge virale globale. Au cours de la période de contrôle, 3 % des patients ont présenté une telle diminution, tandis que pendant la période de monothérapie fonctionnelle, 83 % des patients ont atteint la diminution de la charge virale indiquée. A la fin des 25 semaines, 43% des patients ont atteint une charge virale <50 copies/mL.16
Selon cette étude, la posologie approuvée de l’ibalizumab-uiyk est une dose de charge IV unique de 2000 mg, suivie d’une dose d’entretien IV de 800 mg toutes les 2 semaines.4,16 Une surveillance attentive est requise pendant une heure après l’administration de la première perfusion pour les réactions liées à la perfusion, la surveillance des perfusions suivantes étant réduite à 15 minutes après la tolérance de la dose initiale.4 L’ibalizumab-uiyk semble être autrement bien toléré ; les effets indésirables les plus associés à l’ibalizumab-uiyk sont les nausées, les étourdissements et la diarrhée4,16.
Fostemsavir (Rukobia)
Le fostemsavir est un nouvel ARV indiqué pour une thérapie combinée chez les adultes HTE avec un VIH-1 MDR connu, spécifiquement pour les patients qui échouent à l’ART actuel en raison d’une résistance potentielle, d’une intolérance ou de considérations de sécurité.4 C’est le premier inhibiteur d’attachement approuvé par la FDA. Après activation enzymatique en molécule active, le temsavir se lie à la gp120, une glycoprotéine d’enveloppe virale nécessaire à l’attachement du virus aux cellules CD4. Cela empêche l’entrée du virus dans les cellules CD4, stoppant ainsi efficacement la réplication virale. En raison de ce nouveau mécanisme, il est peu probable que le fostemsavir induise une résistance à lui-même par le biais de la pression sélective associée à la plupart des autres ARV.6,17
La sécurité et l’efficacité du fostemsavir ont été évaluées dans le cadre d’un essai clinique randomisé, en double aveugle, contrôlé par placebo (BRIGHTE) incluant 371 patients VIH-1 HTE.16,17 Les patients de la cohorte principale ont reçu leur traitement antirétroviral de base ainsi que du fostemsavir 600 mg deux fois par jour ou un placebo pendant un total de 8 jours. Lors de l’évaluation au huitième jour, les patients sous fostemsavir ont présenté des taux sériques d’ARN-VIH significativement plus faibles. Après cette période initiale de traitement, tous les patients sont passés à 600 mg de fostemsavir deux fois par jour. Au bout de 24 semaines, 53 % des participants à l’étude ont atteint des niveaux efficaces de suppression virale indétectables, la suppression s’améliorant à 60 % à la semaine 96.17,18
L’effet indésirable du fostemsavir le plus souvent signalé était la nausée. Des réactions plus graves, notamment des élévations des enzymes hépatiques, ont été signalées chez les patients atteints d’une co-infection par l’hépatite B ou C.17,18 D’autres études ont fait état d’une incidence mineure de céphalées, d’éruptions cutanées et de diarrhée. Le métabolite actif, le temsavir, est métabolisé par le CYP3A4, il faut donc éviter les inducteurs forts comme la carbamazépine, la rifampicine et le millepertuis pour prévenir une diminution de la concentration sérique du temsavir.17-19
Bictegravir/Emtricitabine/TénofovirAlafenamide (Biktarvy)
Bictegravir/emtricitabine/ténofovir alafenamide (BIC/FTC/TAF) est un comprimé d’association à dose fixe et à prise unique quotidienne contenant un nouvel inhibiteur d’intégrase et deux inhibiteurs nucléosidiques/nucléotidiques de la transcriptase inverse. Les composants individuels de Biktarvy sont le bictegravir 50 mg (un inhibiteur de transfert de brin d’intégrase), l’emtricitabine 200 mg (un INTI) et le ténofovir alafenamide 25 mg (un INTI). BIC/FTC/TAF est indiqué comme traitement complet chez les adultes infectés par le VIH-1 sans antécédents de traitement antirétroviral ou pour remplacer le traitement antirétroviral actuel des patients qui sont virologiquement supprimés (charge virale £50 copies par ml) sous un traitement antirétroviral stable depuis au moins 3 mois et qui n’ont pas d’antécédents d’échec thérapeutique ou de résistance à ses composants individuels. Plus important encore, il s’agit d’un régime complet en un seul comprimé ne nécessitant aucun autre ARV.20
BIC/FTC/TAF a été approuvé en 2018 après quatre essais cliniques. Deux de ces essais cliniques ont testé l’efficacité et la sécurité de BIC/FTC/TAF chez des patients sans antécédents de traitement antirétroviral : Essai 1489 (randomisé, BIC/FTC/TAF vs abacavir/ dolutégravir/lamivudine, et Essai 1490 (randomisé, BIC/FTC/TAF vs dolutégravir + emtricitabine/ténofovir alafenamide ).21,22 Dans l’étude 1489, le critère d’évaluation principal de la charge virale <50 copies/mL a été atteint dans 92 % du groupe BIC/FTC/TAF et 93 % du groupe ABC/DTG/3TC (différence de traitement de -0,6 % ; intervalle de confiance à 95 %, -4,8 % à 3,6 %). Dans l’essai 1490, le critère d’évaluation primaire de la charge virale <50 copies/mL a été atteint chez 89% du groupe BIC/FTC/TAF et 93% du groupe DTG + FTC/TAF (différence de traitement de -3,5% ; intervalle de confiance à 95%, -7,9% à 1,0%).21,22
Les deux autres essais ont testé l’efficacité et l’innocuité de BIC/FTC/TAF chez des patients virologiquement supprimés qui seraient passés de leur régime ART actuel à BIC/FTC/TAF : L’essai 1844 (randomisé, passage du dolutégravir plus abacavir/lamivudine ou ABC/DTG/3TC au BIC/FTC/TAF) et l’essai 1878 (ouvert, passage de l’atazanavir ou du darunavir boosté plus abacavir/emtricitabine ou emtricitabine/fumarate de ténofovir disoproxil au BIC/FTC/TAF).23,24 Dans l’essai 1844, le critère d’évaluation principal, à savoir la perte du statut de suppression virologique (charge virale ³50 copies par mL), a été observé chez 1 % des patients du groupe BIC/FTC/TAF et chez <1 % des patients du groupe recevant le régime initial (différence de traitement de 0,7 %, IC à 95 %, -1,0 % à 2,8 %). Dans l’essai 1878, le critère d’évaluation principal, à savoir la perte du statut de suppression virologique, a été observé dans 2 % du groupe BIC/FTC/TAF et 2 % du groupe du régime initial (différence de traitement de 0,0 % ; IC à 95 %, -2,5 % à 2,5 %).23,24
BIC/FTC/TAF est administré une fois par jour par voie orale avec ou sans nourriture. Les effets indésirables les plus fréquemment observés chez les patients sont la diarrhée, les nausées et les maux de tête.20-24
Dolutegravir/Lamivudine (Dovato)
La combinaison dolutegravir/lamivudine (DTG/3TC), un INSTI et un NRTI, a été approuvée en 2019. Il s’agit du premier régime complet à deux médicaments et à dose fixe pour le traitement de l’infection par le VIH-1 chez les patients adultes naïfs de traitement. Cela contraste avec les options de régime standard de soins traditionnellement requis à trois médicaments. Cela peut offrir une opportunité aux patients qui ne peuvent tolérer aucun des régimes à trois médicaments les plus courants en raison d’effets indésirables ou d’interactions médicamenteuses inévitables.25,26
L’efficacité et la sécurité de l’association dolutégravir/lamivudine ont été démontrées dans deux études identiques, GEMINI-1 et GEMINI-2.27 Ces études ont recruté un total de 1 433 adultes infectés par le VIH-1, naïfs de traitement, qui ont été randomisés pour recevoir un régime à deux médicaments, dolutégravir 50 mg plus lamivudine 150 mg, ou un régime à trois médicaments, dolutégravir plus emtricitabine plus fumarate de ténofovir disoproxil. Le critère d’évaluation principal, à savoir l’obtention d’une charge virale <50 copies/mL, a montré que le DTG/3TC n’était pas inférieur chez 91 % des 716 patients traités par deux médicaments et chez 93 % des 717 patients traités par trois médicaments (différence de traitement de -1,7 % ; IC à 95 %, -4,4 % à 1,1 %), lorsque les résultats des deux études ont été regroupés. Les études regroupées ont également montré que, numériquement, moins de patients ont présenté des effets indésirables liés au médicament dans le régime à deux médicaments que dans le régime à trois médicaments (126 sur 716 et 169 sur 717, respectivement). En raison d’une efficacité non inférieure et d’un profil de tolérance similaire, le Department of Health and Human Services a pu inclure l’association DTG/3TC à dose fixe dans les directives sur le VIH/sida comme régime initial recommandé pour la plupart des personnes séropositives.27
L’association dolutégravir/lamivudine est administrée une fois par jour par voie orale avec ou sans nourriture. Les effets indésirables les plus fréquemment observés chez les patients sont les maux de tête, les nausées, la diarrhée, la fatigue et l’insomnie. Bien qu’il s’agisse d’un comprimé associant deux médicaments, il n’est pas nécessaire de l’administrer avec d’autres médicaments ARV car il s’agit d’un régime thérapeutique complet25-27.
Emtricitabine/Ténofovir Alafenamide pour la prophylaxie pré-exposition (PrEP)
Depuis 2012, la seule option approuvée par la FDA pour la PrEP était le FTC/ TDF.11 Cela a changé en 2019 avec l’approbation de l’association emtricitabine/ténofovir alafenamide (FTC/TAF),13 un médicament combiné structurellement similaire. Elle est désormais indiquée pour la PrEP chez les patients non infectés présentant un risque élevé de transmission du VIH lors de rapports sexuels. Cela exclut les patients à risque lors de rapports vaginaux réceptifs, car cette population n’a pas encore été évaluée.
L’approbation de la PrEP est basée sur le récent essai DISCOVER, une étude randomisée en double aveugle comparant le FTC/TAF au FTC/TDF standard dans la réduction du risque de contracter une infection par le VIH-1 chez les hommes et les femmes transgenres qui ont des rapports sexuels avec des hommes et sont à risque d’infection par le VIH-17. L’essai a été mené sous la forme d’une étude randomisée, en double aveugle et en groupes parallèles, avec un suivi minimum de 48 semaines, au moins 50% des participants ayant un suivi de 96 semaines après la randomisation. Il a recruté 5 399 participants qui ont été randomisés 1:1 dans l’un ou l’autre groupe. L’objectif principal de l’étude était d’évaluer l’incidence de l’infection par le VIH-1 pour 100 personnes-années. Parmi les 2 694 participants du groupe FTC/TAF, l’incidence du VIH-1 a été observée chez 7 patients (0,16/100 personnes-années). Parmi les 2 693 participants du groupe FTC/TDF, l’incidence du VIH-1 a été observée chez 15 patients (0,34/100 années-personnes). Ces incidences démontrent que le FTC/TAF n’était pas inférieur au FTC/TDF chez les participants à l’étude qui étaient à risque de contracter le VIH et ont finalement permis à la FDA d’ajouter la PrEP aux indications du FTC/TAF.13
La place du FTC/TAF dans le traitement du VIH n’est probablement pas encore claire. Bien qu’il ait trouvé une utilisation dans d’autres domaines du traitement du VIH, son avantage par rapport à l’alternative dans ce contexte n’a pas encore été déterminé de manière concluante. Bien que similaire, le TAF pourrait offrir une incidence plus faible de modifications de la densité osseuse et de dysfonctionnement rénal, effets indésirables associés au TDF. Cette différence n’est cependant pas bien établie, certaines données suggérant que, dans les régimes qui n’incluent pas de booster pharmacocinétique tel que le cobicistat ou le ritonavir, ce bénéfice pourrait ne pas être cliniquement significatif. 27-29
Conclusion
En raison de la complexité du VIH et de son potentiel de résistance, la thérapie ARV peut rapidement devenir lourde pour les patients. Entre 2018 et aujourd’hui, la communauté médicale a vu une large expansion des thérapies ARV approuvées par la FDA pour le traitement du VIH. Ces thérapies comprennent de nouveaux comprimés combinés à dose fixe, de nouveaux médicaments qui agissent par des mécanismes différents de ceux précédemment sur le marché, et même de nouvelles indications pour des médicaments déjà existants. Ces nouveaux médicaments ont déjà eu un impact sur les directives de traitement actuelles et pourraient aider les patients à vivre plus longtemps et en meilleure santé.
Le contenu de cet article est uniquement destiné à des fins d’information. Le contenu n’est pas destiné à remplacer les conseils d’un professionnel. La confiance accordée à toute information fournie dans cet article est uniquement à vos propres risques.
1. Vella S, Schwartländer B, Sow SP, et al. L’histoire de la thérapie antirétrovirale et de sa mise en œuvre dans les régions du monde à ressources limitées. SIDA. 2012;26(10):1231-1241.
2. Arts EJ, Hazuda DJ. La pharmacothérapie antirétrovirale du VIH-1. Cold Spring Harb Perspect Med. 2012;2(4):a007161.
3. Chaudhuri S, Symons JA, Deval J. Innovation et tendances dans le développement et l’approbation des médicaments antiviraux : 1987-2017 et au-delà. Antiviral Res. 2018;155:76-88.
4. Trogarzo (ibalizumab-uiyk) notice de conditionnement. Montréal, Québec : Theratechnologies Inc ; mars 2018.
5. Pifeltro (doravirine) notice d’emballage. Whitehouse Station, NJ : Merck & Co, Inc ; mars 2019.
6. Rukobia (fostemsavir) notice d’emballage. Research Triangle Park, NC : GlaxoSmithKline ; juillet 2020.
7. Pan F, Chernew ME, Fendrick AM. Impact des médicaments combinés à dose fixe sur l’adhésion aux médicaments sur ordonnance. J Gen Intern Med. 2008;23(5):611-614.
8. Verma AA, Khuu W, Tadrous M,et al. Médicaments combinés antihypertenseurs à dose fixe, adhésion et résultats cliniques : une étude de cohorte rétrospective basée sur la population. PLoS Med. 2018;15(6):e1002584.
9. Instituts nationaux de la santé. HIVinfo. Médicaments contre le VIH approuvés par la FDA. hivinfo.nih.gov/understanding-hiv/fact-sheets/fda-approved-hiv-medicines. Consulté le 22 septembre 2020.
10. Notice d’utilisation de Prezista (darunavir). Titusville, NJ : Janssen Therapeutics ; mai 2019.
11. Truvada (emtricitabine/fumarate de ténofovir disoproxil) notice d’emballage. Foster City, CA : Gilead Sciences, Inc ; juin 2004/2020.
12. Delstrigo (doravirine/lamivudine/tenofovir disproxil fumerate) notice d’emballage. Maison Blanche Starion, NJ : Merck & Co, Inc ; août 2018.
13. Descovy (emtricitabine/ténofovir alafénamide) notice d’emballage. Foster City, CA : Gilead Sciences, Inc ; décembre 2019.
14. Tivicay (dolutégravir) notice d’emballage. Research Triangle Park, NC. GlaxoSmithKline ; juin 2020.
15. Iacob SA, Iacob DG. Ibalizumab ciblant les récepteurs CD4, une molécule émergente dans la thérapie du VIH. Front Microbiol. 2017;8:2323.
16. Emu B, Fessel J, Schrader S, et al. Étude de phase 3 de l’ibalizumab pour le VIH-1 multirésistant aux médicaments. N Engl J Med. 2018;379:645-654.
17. Li Z, Zhou N, Sun Y, et al. Activité de l’inhibiteur d’attachement du VIH-1 BMS-626529, le composant actif du promédicament BMS-663068, contre les virus indépendants de CD4 et les enveloppes du VIH-1 résistant à d’autres inhibiteurs d’entrée. Antimicrob Agents Chemother. 2013:57(9):4172-4180.
18. Kozal M, Aberg J, Pialoux G. Fostemsavir chez les adultes atteints d’une infection à VIH-1 multirésistante. N Engl J Med. 2020;382(13):1232-1243.
19. Cahn P, Fink V, Patterson P. Fostemsavir : a new CD4 attachment inhibitor. Curr Opin HIV AIDS. 2018;13(4):341-345.
20. Biktarvy (bictecgravir/emtricitabine/ténofovir alafenamide) notice d’emballage. Foster City, CA : Gilead Sceinces, Inc ; février 2018.
21. Gallant J, Lazzarin A, Mills M, et al. Bictegravir, emtricitabine et ténofovir alafenamide versus dolutegravir, abacavir et lamivudine pour le traitement initial de l’infection par le VIH-1 (GS-US-380-1489) : un essai de non-infériorité en double aveugle, multicentrique, de phase 3, randomisé et contrôlé. Lancet. 2017;390(10107):2063-2072.
22. Sax PE, Pozniak A, Montes M, et al. Bictegravir, emtricitabine et ténofovir alafenamide coformulés versus dolutegravir avec emtricitabine et ténofovir alafenamide, pour le traitement initial de l’infection par le VIH-1 (GS-US-380-1490) : un essai de non-infériorité randomisé, en double aveugle, multicentrique, de phase 3. Lancet. 2017;390(10107):2073-2082.
23. Malina JM, Ward D, Brar I, et al. Switching to fixed-dose bictegravir, emtricitabine, and tenofovir alafenamide from dolutegravir plus abacavir andlamivudine in virologically suppressed adults with HIV-1 : 48 week results of a randomised, double-blind, multicentre, active-controlled, phase 3, non-inferiority trial. Lancet HIV. 2018;5(7):E357-E365.
24. Daar ES, De Jesus E, Ruane P, et al. Efficacité et sécurité du passage à des doses fixes de bictegravir, d’emtricitabine et de ténofovir alafenamide à partir de régimes boostés à base d’inhibiteurs de protéase chez les adultes virologiquement supprimés atteints du VIH-1 : résultats à 48 semaines d’un essai de non-infériorité randomisé, ouvert, multicentrique et de phase 3. Lancet HIV. 2018;5(7):e347-e356.
25. Dovato (dolutégravir/lamivudine) notice d’emballage. Research Triangle Park, NC : GlaxoSmithKline. Mars 2020.
26. Scott LJ. Régime de dolutégravir/lamivudine en un seul comprimé : une revue dans l’infection par le VIH-1. Médicaments. 2020;80(1):61-72.
27. Cahn P, Madero JS, Arribas JR, et al. Équipe de l’étude GEMINI. Dolutegravir plus lamivudine versus dolutegravir plus fumarate de ténofovir disoproxil et emtricitabine chez les adultes naïfs de traitement antirétroviral atteints d’une infection par le VIH-1 (GEMINI-1 et GEMINI-2) : résultats à la semaine 48 de deux essais multicentriques, en double aveugle, randomisés, de non-infériorité, de phase 3. Lancet. 2019;393(10167):143-155.
28. Mayer KH, Molina JM, Thompson MA, et al. Emtricitabine et ténofovir alafénamide vs emtricitabine et fumarate de ténofovir disoproxil pour la prophylaxie de pré-exposition au VIH (DISCOVER) : résultats primaires d’un essai de non-infériorité de phase 3, randomisé, en double aveugle, multicentrique, contrôlé par voie active. Lancet. 2020;396(10246):239-254.
29. Hill A, Hughes SL, Gotham D, Pozniak AL. Tenofovir alafenamide versus fumarate de ténofovir disoproxil : existe-t-il une véritable différence en termes d’efficacité et de sécurité ? J Virus Erad. 2018;4(2):72-79.