ABSTRACT: Los medicamentos antirretrovirales (ARV) disponibles para el tratamiento del VIH se han ampliado desde 2018. Se han aprobado nuevos tipos de ARV con nuevos mecanismos de acción, como ibalizumab-uiyk y fostemsavir. También se han aprobado comprimidos combinados de fármacos ya disponibles, como bictegravir/emtricitabina/tenofovir alafenamida y dolutegravir/lamivudina. Por último, se han ampliado las indicaciones aprobadas para los propios antirretrovirales previamente disponibles, como emtricitabina/tenofovir alafenamida para su uso en la profilaxis previa a la exposición.
US Pharm. 2020:45(10):17-25.
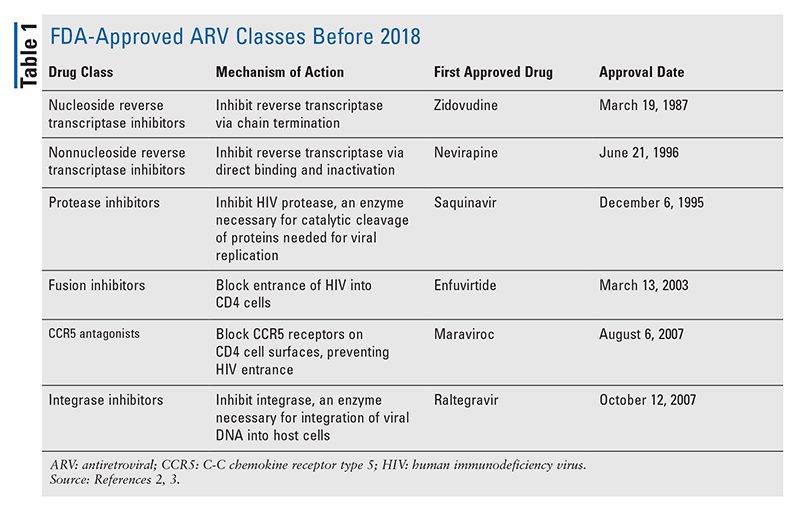
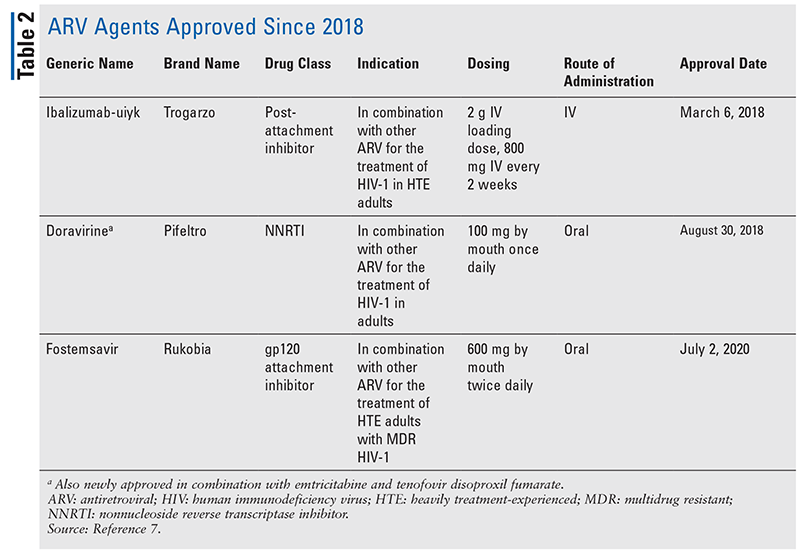
Los pilares de los agentes antirretrovirales (ARV) para el tratamiento del VIH han consistido en gran medida en el mismo puñado de clases de fármacos durante años. El tratamiento del VIH se intentó por primera vez con los inhibidores nucleósidos de la transcriptasa inversa (INTR), la primera clase de ARV aprobada por la FDA. Gradualmente, se descubrieron más y más clases y se pusieron a disposición para el tratamiento en varios regímenes, a menudo complejos (TABLA 1).1-3 Después de la aprobación de raltegravir en 2007, las nuevas aprobaciones de medicamentos para el VIH fueron en gran parte para medicamentos disponibles reutilizados y nuevos medicamentos combinados. Esto cambió en 2018 con la aprobación de ibalizumab-uiyk, el primer nuevo ARV en más de una década.4 A ibalizumab-uiyk le siguió rápidamente un nuevo inhibidor no nucleósido de la transcriptasa inversa (ITIN), la doravirina, ese mismo año, y un nuevo inhibidor de la fijación, el fostemsavir, en 2020 (TABLA 2).5-7
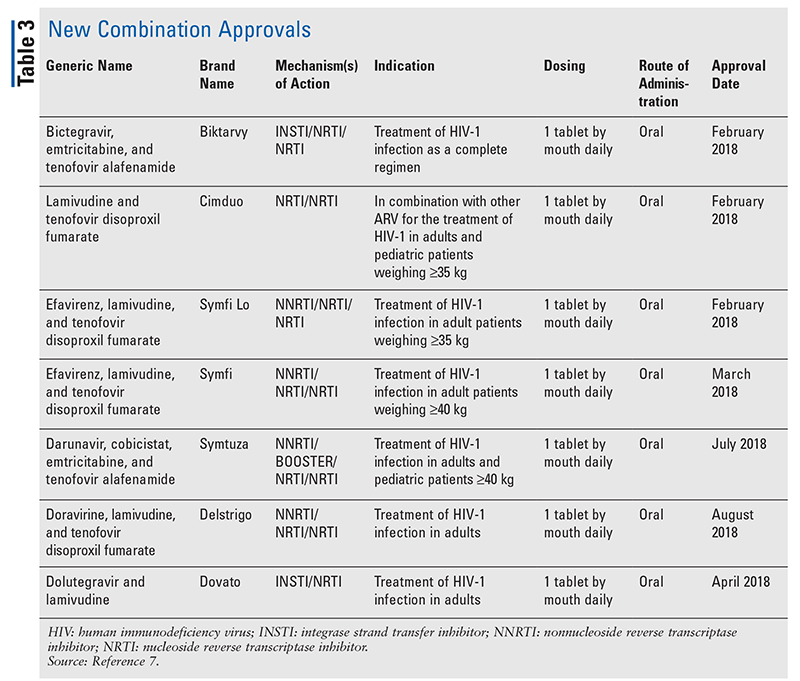
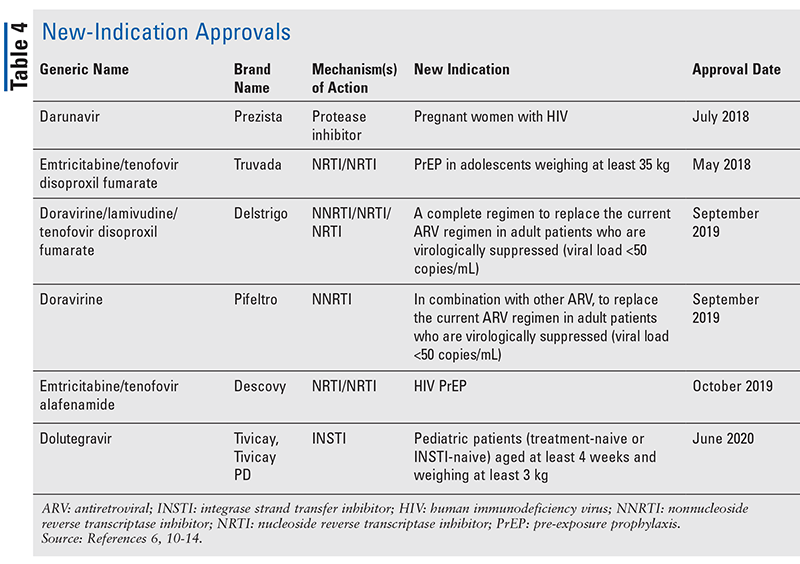
Aunque los nuevos fármacos suelen ser las aprobaciones más interesantes, los ARV han mejorado de otras maneras. Dada la enorme carga de píldoras de muchos regímenes contra el VIH, los ARV combinados recientemente aprobados (TABLA 3) pueden facilitar mucho la vida de los pacientes. El uso de tales agentes y la limitación de la carga de píldoras necesaria han demostrado una mejor adherencia y resultados generales.8,9 También ha habido expansiones en las indicaciones aprobadas para los ARV previamente disponibles (TABLA 4), ofreciendo nuevas opciones para ciertas poblaciones de pacientes e indicaciones.10-14
Aunque hay muchas aprobaciones nuevas desde 2018, este artículo perfila cuatro de los medicamentos recientemente aprobados y una nueva indicación. Estas aprobaciones se seleccionaron para demostrar una muestra de la amplia variedad de nuevos agentes que están disponibles, así como para enfatizar algunas opciones nuevas que ofrecen una oportunidad única en el tratamiento del VIH.
Ibalizumab-Uiyk (Trogarzo)
Ibalizumab-uiyk es un anticuerpo monoclonal recombinante inyectable que se une a las proteínas de la superficie de las células CD4, lo que conduce a cambios conformacionales que impiden los pasos posteriores a la adhesión necesarios para la fusión del VIH-1 y su entrada en la célula. Es el único medicamento monoclonal utilizado en el tratamiento del VIH. Debido a su exclusiva especificidad de unión, ibalizumab-uiyk bloquea la entrada del virus sin causar inmunosupresión, algo que preocupa a muchos medicamentos monoclonales.4,15 Está indicado en combinación con otros ARV para el tratamiento de adultos con mucha experiencia en el tratamiento (HTE) y con VIH-1 multirresistente (MDR) que están fracasando en su actual régimen de terapia ARV.4
La aprobación de ibalizumab-uiyk se basó en un ensayo realizado en 40 pacientes con VIH HTE con una carga viral superior a 1.000 copias/mL y una resistencia documentada a al menos un ITIN, un ITINN y un inhibidor de la proteasa. También se requería que los pacientes llevaran al menos 6 meses de tratamiento y que hubieran fracasado recientemente la terapia. El ensayo incluyó tres periodos, empezando por un periodo de 6 días en el que se estableció y confirmó la carga viral basal (periodo de control). El día 7, los pacientes recibieron una dosis de carga de 2.000 mg de ibalizumab-uiyk, además de su régimen estándar de tratamiento antirretroviral (período de monoterapia funcional). En el día 14, se volvió a evaluar la carga viral y se controlaron y ajustaron los regímenes para garantizar una actividad adecuada contra su infección por el VIH. Ibalizumab-uiyk 800 mg se administró por vía intravenosa cada 2 semanas hasta la conclusión del estudio (período de mantenimiento). El criterio de valoración primario evaluó la diferencia en la proporción de disminución de la carga viral entre el período de control y el período de monoterapia funcional, concretamente comparando el porcentaje de pacientes con una disminución de ³0,5 log10 en la carga viral global. Durante el período de control, el 3% de los pacientes presentaron tal disminución, mientras que en el período de monoterapia funcional el 83% de los pacientes cumplieron con la disminución de la carga viral establecida. Al final de las 25 semanas, el 43% de los pacientes alcanzaron una carga viral de <50 copias/mL.16
Basado en este estudio, la dosis aprobada de ibalizumab-uiyk es una dosis única de carga intravenosa de 2.000 mg, seguida de una dosis de mantenimiento intravenosa de 800 mg cada 2 semanas.4,16 Se requiere una monitorización cuidadosa durante 1 hora después de la administración de la primera infusión para detectar reacciones relacionadas con la infusión, y la monitorización posterior de la infusión se reduce a 15 minutos después de la tolerancia de la dosis inicial.4 Ibalizumab-uiyk parece ser bien tolerado por lo demás; los efectos adversos más asociados a ibalizumab-uiyk fueron náuseas, mareos y diarrea.4,16
Fostemsavir (Rukobia)
Fostemsavir es un nuevo ARV indicado para la terapia de combinación en adultos HTE con VIH-1 MDR conocido, específicamente para pacientes que están fracasando en la terapia actual debido a una potencial resistencia, intolerancia o consideraciones de seguridad.4 Es el primer inhibidor de la fijación aprobado por la FDA. Tras su activación enzimática a la molécula activa temsavir, se une a la gp120, una glicoproteína de la envoltura viral necesaria para la adhesión viral a las células CD4. Esto impide la entrada del virus en las células CD4, deteniendo eficazmente la replicación viral. Debido a este novedoso mecanismo, es poco probable que fostemsavir induzca resistencia a sí mismo a través de la presión selectiva asociada a la mayoría de los demás ARV.6,17
Fostemsavir fue evaluado tanto en cuanto a su seguridad como a su eficacia en un ensayo clínico aleatorizado, doble ciego y controlado con placebo (BRIGHTE) que incluyó a 371 pacientes con VIH-1 HTE.16,17 Los pacientes de la cohorte principal fueron tratados con su régimen antirretroviral de referencia junto con fostemsavir 600 mg dos veces al día o con placebo durante un total de 8 días. En la evaluación del día 8, los pacientes con fostemsavir demostraron niveles séricos significativamente más bajos de ARN VIH viral. Tras este periodo inicial de tratamiento, todos los pacientes pasaron a tomar fostemsavir 600 mg dos veces al día. A las 24 semanas, el 53% de los participantes en el estudio alcanzaron niveles efectivos indetectables de supresión viral, y la supresión mejoró hasta el 60% en la semana 96.17,18
El efecto adverso de fostemsavir notificado con más frecuencia fueron las náuseas. Se notificaron reacciones más graves, incluidas elevaciones de las enzimas hepáticas, en pacientes con coinfección por hepatitis B o C.17,18 Otros estudios notificaron una incidencia menor de dolor de cabeza, sarpullido y diarrea. El metabolito activo temsavir es metabolizado por el CYP3A4, por lo que deben evitarse inductores fuertes como la carbamazepina, la rifampicina y la hierba de San Juan para evitar la disminución de la concentración sérica de temsavir.17-19
Bictegravir/Emtricitabina/TenofovirAlafenamida (Biktarvy)
Bictegravir/emtricitabina/tenofovir alafenamida (BIC/FTC/TAF) es un comprimido combinado de dosis fija, una vez al día, que contiene un nuevo inhibidor de la integrasa y dos inhibidores de la transcriptasa inversa de nucleósidos/nucleótidos. Los componentes individuales de Biktarvy son bictegravir 50 mg (un inhibidor de la transferencia de la cadena de la integrasa), emtricitabina 200 mg (un INTR) y tenofovir alafenamida 25 mg (un INTR). BIC/FTC/TAF está indicado como régimen completo en adultos infectados por el VIH-1 sin antecedentes de tratamiento antirretroviral o para sustituir el régimen antirretroviral actual de los pacientes con supresión virológica (carga viral de 50 copias por ml) con un régimen antirretroviral estable durante al menos 3 meses y sin antecedentes de fracaso del tratamiento o resistencia a sus componentes individuales. Lo más significativo es que se trata de un régimen completo de una sola píldora que no requiere ningún otro ARV.20
BIC/FTC/TAF fue aprobado en 2018 tras cuatro ensayos clínicos. Dos de los ensayos clínicos probaron la eficacia y seguridad de BIC/FTC/TAF en pacientes sin antecedentes de TAR: El ensayo 1489 (aleatorizado, BIC/FTC/TAF frente a abacavir/dolutegravir/lamivudina, y el ensayo 1490 (aleatorizado, BIC/FTC/TAF frente a dolutegravir + emtricitabina/tenofovir alafenamida ).21,22 En el ensayo 1489, el criterio de valoración primario de carga viral <50 copias/mL se alcanzó en el 92% del grupo BIC/FTC/TAF y en el 93% del grupo ABC/DTG/3TC (diferencia de tratamiento de -0,6%; intervalo de confianza del 95%, -4,8% a 3,6%). En el ensayo 1490, el criterio de valoración principal de carga viral <50 copias/mL se alcanzó en el 89% del grupo BIC/FTC/TAF y en el 93% del grupo DTG + FTC/TAF (diferencia de tratamiento de -3,5%; IC del 95%, -7,9% a 1,0%).21,22
Los otros dos ensayos probaron la eficacia y la seguridad de BIC/FTC/TAF en pacientes virológicamente suprimidos que serían cambiados de sus regímenes ART actuales a BIC/FTC/TAF: Ensayo 1844 (aleatorizado, cambio de dolutegravir más abacavir/lamivudina o ABC/DTG/3TC a BIC/FTC/TAF) y Ensayo 1878 (abierto, cambio de atazanavir o darunavir potenciado más abacavir/emtricitabina o emtricitabina/tenofovir disoproxil fumarato a BIC/FTC/TAF).23,24 En el ensayo 1844, el criterio de valoración principal de los pacientes que perdieron su estado de supresión virológica (carga viral ³50 copias por ml) se observó en el 1% del grupo de BIC/FTC/TAF y en <1% del grupo del régimen original (diferencia de tratamiento del 0,7%, IC del 95%, -1,0% a 2,8%). En el ensayo 1878, el criterio de valoración principal de pacientes que perdieron su estado de supresión virológica se observó en el 2% del grupo de BIC/FTC/TAF y en el 2% del grupo del régimen original (diferencia de tratamiento del 0,0%; IC del 95%, -2,5% a 2,5%).23,24
BIC/FTC/TAF se administra una vez al día por vía oral con o sin alimentos. Las reacciones adversas más frecuentes observadas en los pacientes fueron diarrea, náuseas y dolor de cabeza.20-24
Dolutegravir/Lamivudina (Dovato)
La combinación dolutegravir/lamivudina (DTG/3TC), un INSTI y un NRTI, se aprobó en 2019. Se trata del primer régimen completo de dos fármacos y dosis fijas para el tratamiento de la infección por VIH-1 en pacientes adultos sin tratamiento. Esto contrasta con las opciones de regímenes de atención estándar tradicionalmente requeridas de tres fármacos. Esto puede ofrecer una oportunidad en los pacientes que no pueden tolerar ninguno de los regímenes de tres fármacos más comunes debido a los efectos adversos o a las interacciones inevitables entre los medicamentos.25,26
La eficacia y seguridad de la combinación dolutegravir/lamivudina se demostró en dos estudios idénticos, GEMINI-1 y GEMINI-2.27 En estos estudios participaron un total de 1.433 adultos infectados por el VIH-1 y sin tratamiento, que fueron aleatorizados para recibir un régimen de dos fármacos, dolutegravir 50 mg más lamivudina 150 mg, o un régimen de tres fármacos, dolutegravir más emtricitabina más tenofovir disoproxil fumarato. El criterio de valoración principal de conseguir una carga viral <50 copias/mL mostró que DTG/3TC no era inferior -el 91% de los 716 pacientes con dos fármacos y el 93% de los 717 pacientes con tres fármacos (diferencia de tratamiento de -1,7%; IC del 95%, -4,4% a 1,1%)- cuando se agruparon los resultados de los dos estudios. Los estudios agrupados también mostraron que, numéricamente, un menor número de pacientes tuvo eventos adversos relacionados con el fármaco en el régimen de dos fármacos en comparación con el régimen de tres fármacos (126 de 716 y 169 de 717 , respectivamente). Debido a la eficacia no inferior y a un perfil de tolerabilidad similar, el Departamento de Salud y Servicios Humanos pudo incluir la combinación de dosis fijas de DTG/3TC en las directrices sobre el VIH/SIDA como régimen inicial recomendado para la mayoría de las personas con VIH.27
La combinación de dolutegravir/lamivudina se administra una vez al día por vía oral con o sin alimentos. Las reacciones adversas más comunes observadas en los pacientes son dolor de cabeza, náuseas, diarrea, fatiga e insomnio. A pesar de ser un comprimido combinado de dos medicamentos, no es necesario administrarlo con otros medicamentos ARV porque es un régimen terapéutico completo.25-27
Emtricitabina/Tenofovir Alafenamida para la profilaxis previa a la exposición (PrEP)
Desde 2012, la única opción aprobada por la FDA para la PrEP ha sido FTC/ TDF.11 Esto cambió en 2019 con la aprobación de la combinación emtricitabina/tenofovir alafenamida (FTC/TAF),13 un medicamento combinado estructuralmente similar. Ahora está indicado para su uso en la PrEP en pacientes no infectados con alto riesgo de transmisión del VIH a través de las relaciones sexuales. Esto excluye a los pacientes con riesgo por relaciones vaginales receptivas, ya que esta población aún no ha sido evaluada.
La aprobación de la PrEP se basa en el reciente ensayo DISCOVER, un estudio aleatorizado y doble ciego que comparó FTC/TAF con el FTC/TDF de tratamiento estándar para reducir el riesgo de contraer la infección por VIH-1 en hombres y mujeres transexuales que mantienen relaciones sexuales con hombres y están en riesgo de infección por VIH-1.7 El ensayo se llevó a cabo como un estudio aleatorizado, doble ciego y de grupos paralelos con un seguimiento mínimo de 48 semanas, con al menos el 50% de los participantes con 96 semanas de seguimiento después de la aleatorización. En él se inscribieron 5.399 participantes que fueron asignados al azar 1:1 a cualquiera de los dos grupos. El objetivo principal del estudio era evaluar la incidencia de la infección por VIH-1 por cada 100 personas-año. Entre los 2.694 participantes del brazo FTC/TAF, se observó una incidencia de VIH-1 en 7 pacientes (0,16/100 personas-año). Entre los 2.693 participantes del brazo FTC/TDF, se observó una incidencia de VIH-1 en 15 pacientes (0,34/100 personas-año). Estas incidencias demuestran que FTC/TAF no fue inferior a FTC/TDF en los participantes del estudio que estaban en riesgo de contraer el VIH y, en última instancia, permitieron a la FDA añadir la PrEP a las indicaciones de FTC/TAF.13
El lugar de FTC/TAF en la terapia contra el VIH probablemente aún no está claro. Aunque se ha utilizado en otras áreas del tratamiento del VIH, aún no se ha determinado de forma concluyente su beneficio sobre la alternativa en este contexto. Aunque es similar, el TAF puede ofrecer una menor incidencia de cambios en la densidad ósea y disfunción renal, efectos adversos asociados al TDF. Sin embargo, esta diferencia no está bien establecida, y algunos datos sugieren que, en los regímenes que no incluyen un refuerzo farmacocinético como cobicistat o ritonavir, este beneficio puede no ser clínicamente significativo. 27-29
Conclusión
Debido a la complejidad del VIH y su potencial de resistencia, la terapia ARV puede convertirse rápidamente en una carga para los pacientes. Entre 2018 y el presente, la comunidad médica ha visto una amplia expansión de las terapias ARV aprobadas por la FDA para el tratamiento del VIH. Estas terapias incluyen nuevos comprimidos combinados de dosis fija; nuevos fármacos que actúan a través de mecanismos diferentes a los que ya estaban en el mercado; e incluso nuevas indicaciones para medicamentos ya existentes. Estos nuevos medicamentos ya han influido en las actuales directrices de tratamiento y pueden ayudar a los pacientes a llevar una vida más larga y saludable.
El contenido de este artículo tiene únicamente fines informativos. El contenido no pretende sustituir el asesoramiento profesional. La confianza en cualquier información proporcionada en este artículo es únicamente bajo su propio riesgo.
1. Vella S, Schwartländer B, Sow SP, et al. La historia de la terapia antirretroviral y de su aplicación en zonas del mundo con recursos limitados. AIDS. 2012;26(10):1231-1241.
2. Arts EJ, Hazuda DJ. Terapia farmacológica antirretroviral del VIH-1. Cold Spring Harb Perspect Med. 2012;2(4):a007161.
3. Chaudhuri S, Symons JA, Deval J. Innovación y tendencias en el desarrollo y aprobación de medicamentos antivirales: 1987-2017 y más allá. Antiviral Res. 2018;155:76-88.
4. Prospecto de Trogarzo (ibalizumab-uiyk). Montreal, Quebec: Theratechnologies Inc; marzo de 2018.
5. Prospecto de Pifeltro (doravirina). Whitehouse Station, NJ: Merck & Co, Inc; marzo de 2019.
6. Prospecto de Rukobia (fostemsavir). Research Triangle Park, NC: GlaxoSmithKline; julio de 2020.
7. Pan F, Chernew ME, Fendrick AM. Impacto de los medicamentos combinados de dosis fija en la adherencia a los medicamentos recetados. J Gen Intern Med. 2008;23(5):611-614.
8. Verma AA, Khuu W, Tadrous M,et al. Fixed-dose combination antihypertensive medications, adherence, and clinical outcomes: a population-based retrospective cohort study. PLoS Med. 2018;15(6):e1002584.
9. Institutos nacionales de salud. HIVinfo. Medicamentos para el VIH aprobados por la FDA. hivinfo.nih.gov/understanding-hiv/fact-sheets/fda-approved-hiv-medicines. Consultado el 22 de septiembre de 2020.
10. Prospecto de Prezista (darunavir). Titusville, NJ: Janssen Therapeutics; mayo de 2019.
11. Prospecto de Truvada (emtricitabina/tenofovir disoproxil fumarato). Foster City, CA: Gilead Sciences, Inc; junio de 2004/2020.
12. Prospecto de Delstrigo (doravirina/lamivudina/tenofovir disproxil fumerato). White House Starion, NJ: Merck & Co, Inc; agosto de 2018.
13. Prospecto de Descovy (emtricitabina/tenofovir alafenamida). Foster City, CA: Gilead Sciences, Inc; diciembre de 2019.
14. Prospecto de Tivicay (dolutegravir). Research Triangle Park, NC. GlaxoSmithKline; junio de 2020.
15. Iacob SA, Iacob DG. Ibalizumab dirigido a los receptores CD4, una molécula emergente en la terapia del VIH. Front Microbiol. 2017;8:2323.
16. Emu B, Fessel J, Schrader S, et al. Estudio de fase 3 de ibalizumab para el VIH-1 multirresistente. N Engl J Med. 2018;379:645-654.
17. Li Z, Zhou N, Sun Y, et al. Actividad del inhibidor de la fijación del VIH-1 BMS-626529, el componente activo del profármaco BMS-663068, contra los virus independientes de CD4 y las envolturas del VIH-1 resistentes a otros inhibidores de la entrada. Agentes antimicrobianos quimioterapéuticos. 2013:57(9):4172-4180.
18. Kozal M, Aberg J, Pialoux G. Fostemsavir en adultos con infección por VIH-1 multirresistente. N Engl J Med. 2020;382(13):1232-1243.
19. Cahn P, Fink V, Patterson P. Fostemsavir: un nuevo inhibidor de la fijación de CD4. Curr Opin HIV AIDS. 2018;13(4):341-345.
20. Prospecto de Biktarvy (bictecgravir/emtricitabina/tenofovir alafenamida). Foster City, CA: Gilead Sceinces, Inc; febrero de 2018.
21. Gallant J, Lazzarin A, Mills M, et al. Bictegravir, emtricitabina y tenofovir alafenamida frente a dolutegravir, abacavir y lamivudina para el tratamiento inicial de la infección por VIH-1 (GS-US-380-1489): un ensayo doble ciego, multicéntrico, de fase 3, aleatorizado y controlado de no inferioridad. Lancet. 2017;390(10107):2063-2072.
22. Sax PE, Pozniak A, Montes M, et al. Bictegravir coformulado, emtricitabina y tenofovir alafenamida frente a dolutegravir con emtricitabina y tenofovir alafenamida, para el tratamiento inicial de la infección por VIH-1 (GS-US-380-1490): un ensayo aleatorizado, doble ciego, multicéntrico, de fase 3 y de no inferioridad. Lancet. 2017;390(10107):2073-2082.
23. Malina JM, Ward D, Brar I, et al. Cambio a dosis fijas de bictegravir, emtricitabina y tenofovir alafenamida desde dolutegravir más abacavir ylamivudina en adultos virológicamente suprimidos con VIH-1: resultados de 48 semanas de un ensayo aleatorizado, doble ciego, multicéntrico, controlado activamente, de fase 3 y de no inferioridad. Lancet HIV. 2018;5(7):E357-E365.
24. Daar ES, De Jesus E, Ruane P, et al. Eficacia y seguridad del cambio a dosis fijas de bictegravir, emtricitabina y tenofovir alafenamida a partir de regímenes basados en inhibidores de la proteasa reforzados en adultos con VIH-1 virológicamente suprimidos: resultados de 48 semanas de un ensayo aleatorizado, abierto, multicéntrico, de fase 3 y de no inferioridad. Lancet HIV. 2018;5(7):e347-e356.
25. Prospecto de Dovato (dolutegravir/lamivudina). Research Triangle Park, NC: GlaxoSmithKline. Marzo de 2020.
26. Scott LJ. Régimen de dolutegravir/lamivudina en tableta única: una revisión en la infección por VIH-1. Fármacos. 2020;80(1):61-72.
27. Cahn P, Madero JS, Arribas JR, et al. Equipo del estudio GEMINI. Dolutegravir más lamivudina frente a dolutegravir más tenofovir disoproxil fumarato y emtricitabina en adultos con infección por VIH-1 sin tratamiento antirretroviral (GEMINI-1 y GEMINI-2): resultados en la semana 48 de dos ensayos multicéntricos, doble ciego, aleatorizados, de no inferioridad, de fase 3. Lancet. 2019;393(10167):143-155.
28. Mayer KH, Molina JM, Thompson MA, et al. Emtricitabina y tenofovir alafenamida frente a emtricitabina y tenofovir disoproxil fumarato para la profilaxis previa a la exposición al VIH (DISCOVER): resultados primarios de un ensayo aleatorizado, doble ciego, multicéntrico, controlado activamente, de fase 3 de no inferioridad. Lancet. 2020;396(10246):239-254.
29. Hill A, Hughes SL, Gotham D, Pozniak AL. Tenofovir alafenamida frente a tenofovir disoproxil fumarato: ¿existe una verdadera diferencia de eficacia y seguridad? J Virus Erad. 2018;4(2):72-79.