ABSTRACT: Os medicamentos anti-retrovirais (ARV) disponíveis para o tratamento do HIV têm se expandido desde 2018. Novos tipos de ARVs com novos mecanismos de ação foram aprovados, incluindo ibalizumab-uiyk e fostemsavir. Também foram aprovados comprimidos combinados de medicamentos anteriormente disponíveis, tais como bictegravir/emtricitabina/tenofovir alafenamida e dolutegravir/lamivudina. Finalmente, houve uma expansão nas indicações aprovadas para os próprios ARVs anteriormente disponíveis, como emtricitabina/tenofovir alafenamida para uso em profilaxia pré-exposição.
US Pharm. 2020:45(10):17-25.
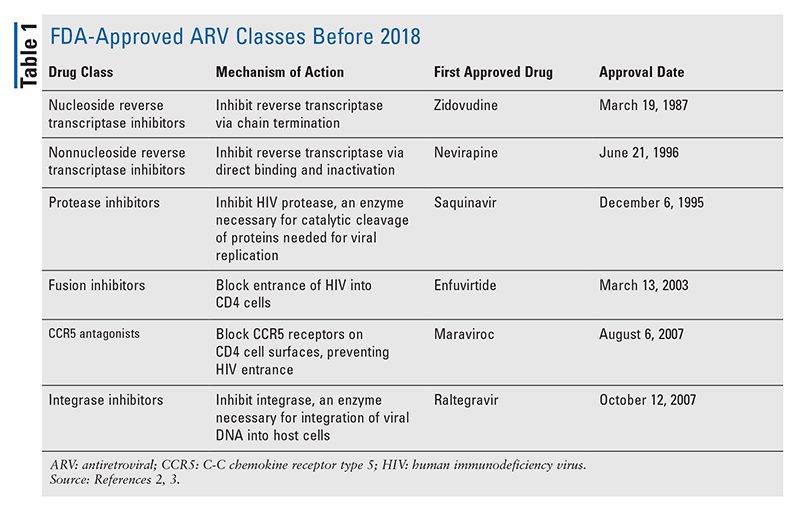
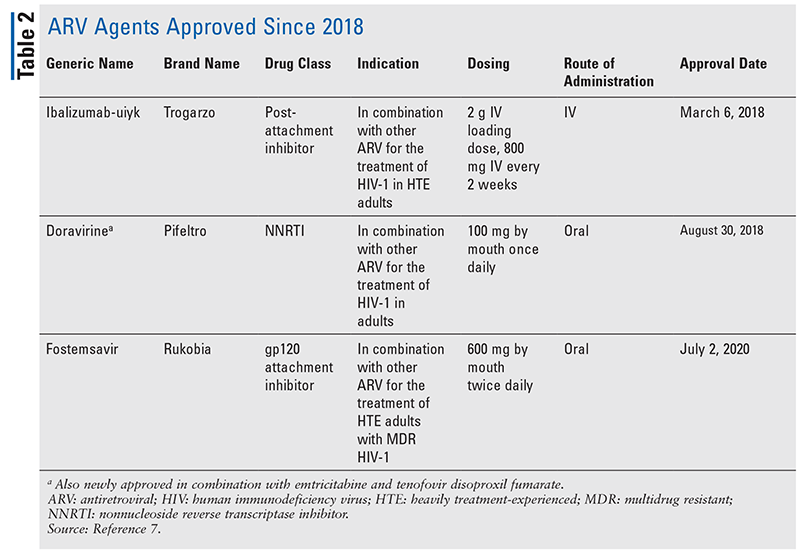
Os princípios básicos dos agentes anti-retrovirais (ARV) para o tratamento do HIV têm consistido, em grande parte, no mesmo punhado de classes de medicamentos durante anos. O tratamento do HIV foi tentado pela primeira vez com inibidores da transcriptase reversa de nucleosídeos (NRTIs), a primeira classe de ARVs aprovada pelo FDA. Gradualmente, mais e mais classes foram descobertas e disponibilizadas para tratamento em vários regimes, freqüentemente complexos (TABELA 1).1-3 Após a aprovação do raltegravir em 2007, novas aprovações de medicamentos para HIV foram, em grande parte, para drogas disponíveis e novas drogas combinadas. Isto mudou em 2018 com a aprovação do ibalizumab-uiyk, o primeiro ARV novo em mais de uma década.4 O ibalizumab-uiyk foi rapidamente seguido por um novo inibidor de transcriptase reversa não-nucleosídeo (NNRTI), doravirina, mais tarde naquele ano e um novo inibidor de ligação, fostemsavir, em 2020 (TABELA 2).5-7
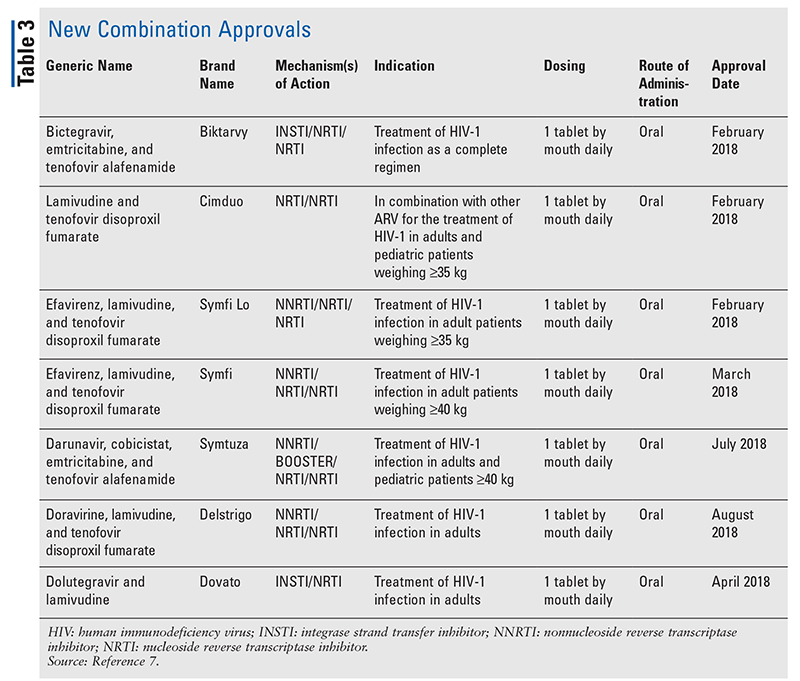
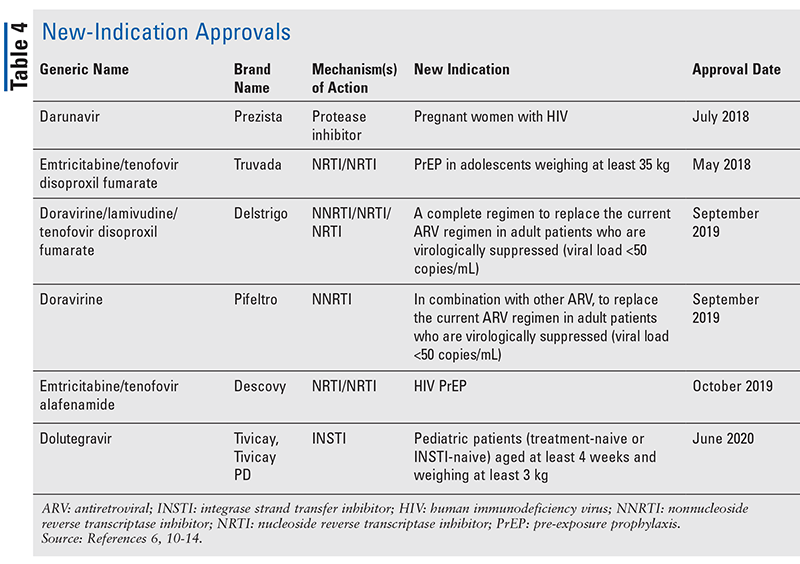
Embora as novas drogas sejam frequentemente as mais excitantes aprovações de novas drogas, os ARVs melhoraram de outras formas. Dada a enorme carga de comprimidos de muitos regimes de HIV, os ARVs combinados recentemente aprovados (TABELA 3) podem tornar a vida muito mais fácil para os pacientes. O uso de tais agentes e a limitação da carga de comprimidos necessária têm demonstrado melhor aderência e resultados gerais.8,9 Também houve expansões nas indicações aprovadas para ARVs anteriormente disponíveis (TABELA 4), oferecendo novas opções para certas populações de pacientes e indicações.10-14
Embora haja muitas novas aprovações desde 2018, este artigo traça o perfil de quatro dos medicamentos recentemente aprovados e uma nova indicação. Estas aprovações foram selecionadas para demonstrar uma amostra da grande variedade de novos agentes que se tornaram disponíveis, assim como enfatizar algumas novas opções que oferecem uma oportunidade única no tratamento do HIV.
Ibalizumab-Uiyk (Trogarzo)
Ibalizumab-uiyk é um anticorpo monoclonal recombinante injetável que se liga às proteínas de superfície das células CD4 levando a mudanças conformacionais que impedem as etapas de pós-fixação necessárias para a fusão e entrada na célula do HIV-1. É o único medicamento monoclonal utilizado no tratamento do HIV. Devido à sua especificidade de ligação única, o ibalizumab-uiyk bloqueia a entrada viral sem causar imunossupressão, uma preocupação em muitos medicamentos monoclonais.4,15 É indicado em combinação com outros ARVs para tratamento em adultos altamente experientes (HTE) com multirresistência aos medicamentos (MDR) HIV-1 que estão falhando em seu regime atual de terapia ARV.4
A aprovação do ibalizumab-uiyk foi baseada em um estudo conduzido em 40 pacientes HIV TEP com carga viral superior a 1.000 cópias/mL e uma resistência documentada a pelo menos um NRTI, NNRTI, e um inibidor de protease. Os pacientes também foram obrigados a ter tido pelo menos 6 meses de tratamento e a ter falhado recentemente a terapia. O ensaio incluiu três períodos, começando com um período de 6 dias em que a carga viral basal foi estabelecida e confirmada (período de controlo). No sétimo dia, os pacientes receberam uma dose de carga de ibalizumab-uiyk de 2,000-mg além do seu regime padrão de ART (período de monoterapia funcional). No 14º dia, a carga viral foi reavaliada e os regimes foram monitorizados e ajustados para assegurar uma actividade adequada contra a sua infecção pelo HIV. O Ibalizumab-uiyk 800 mg foi administrado IV a cada 2 semanas até a conclusão do estudo (período de manutenção). O desfecho primário avaliou a diferença na proporção de diminuição da carga viral do período de controle para o período de monoterapia funcional, comparando especificamente a porcentagem de pacientes com uma diminuição de ³0,5 log10 na carga viral total. Durante o período de controle, verificou-se que 3% dos pacientes tiveram essa diminuição, enquanto o período de monoterapia funcional resultou em 83% dos pacientes com a diminuição da carga viral declarada. Ao final de 25 semanas, 43% dos pacientes atingiram uma carga viral de <50 cópias/mL.16
Baseado neste estudo, a dose aprovada de ibalizumab-uiyk é uma dose única de carga IV de 2.000 mg, seguida por uma dose de manutenção IV de 800 mg a cada 2 semanas.4,16 É necessária uma monitorização cuidadosa durante 1 hora após a administração da primeira infusão para reacções relacionadas com a infusão, com monitorização subsequente da infusão reduzida para 15 minutos após a tolerância da dose inicial.4 O ibalizumab-uiyk parece ser bem tolerado; os efeitos mais adversos associados ao ibalizumab-uiyk foram náusea, tontura e diarréia.4,16
Fostemsavir (Rukobia)
Fostemsavir é um novo ARV indicado para terapia combinada em adultos THE com MDR HIV-1 conhecido, especificamente para pacientes que estão falhando a ART atual devido a resistência potencial, intolerância ou considerações de segurança.4 É o primeiro inibidor de fixação aprovado pelo FDA. Após ativação enzimática à molécula temsavir ativa, ele se liga ao gp120, uma glicoproteína de envelope viral necessária para a fixação viral às células CD4. Isto impede a entrada viral nas células CD4, parando efetivamente a replicação viral. Devido a este novo mecanismo, é improvável que o fostemsavir induza resistência a si mesmo através da pressão seletiva associada à maioria dos outros ARVs.6,17
Fostemsavir foi avaliado tanto para segurança quanto para eficácia em um ensaio clínico aleatório, duplo-cego e placebo-controlado (BRIGHTE), incluindo 371 pacientes com HIV-1 HTE.16,17 Os pacientes da coorte principal foram tratados com ambos os regimes ART de base juntamente com o fostemsavir 600 mg duas vezes por dia ou placebo durante um total de 8 dias. Após a avaliação no 8º dia, os pacientes com fostemsavir demonstraram níveis séricos significativamente mais baixos de HIV-RNA viral. Após este período inicial de tratamento, todos os pacientes foram transitados para fostemsavir 600 mg duas vezes ao dia. Na marca de 24 semanas, 53% dos participantes do estudo alcançaram níveis eficazes e indetectáveis de supressão viral, com a supressão melhorando para 60% na semana 96,17,18
O efeito adverso mais comumente relatado do fostemsavir foi náusea. Reações mais graves, incluindo elevações nas enzimas hepáticas, foram relatadas em pacientes com coinfecção por hepatite B ou C.17,18 Outros estudos relataram menor incidência de dor de cabeça, erupção cutânea e diarréia. O metabólito ativo temsavir é metabolizado pelo CYP3A4, portanto indutores fortes como carbamazepina, rifampicina e erva de São João devem ser evitados para evitar a diminuição da concentração sérica de temsavir.17-19
Bictegravir/Emtricitabine/TenofovirAlafenamida (Biktarvy)
Bictegravir/emtricitabine/tenofovir alafenamida (BIC/FTC/TAF) é uma combinação em dose fixa, uma vez por dia, de comprimidos contendo um novo inibidor de integrase e dois inibidores de transcriptase reversa de nucleósidos/nucleótidos. Os componentes individuais em Biktarvy são bictegravir 50 mg (um inibidor de transferência de cordão integrase), emtricitabina 200 mg (um NRTI) e tenofovir alafenamida 25 mg (um NRTI). O BIC/FTC/TAF é indicado como um regime completo em adultos infectados pelo HIV-1 sem histórico de ART ou para substituir o regime atual de ART de pacientes que são virologicamente suprimidos (carga viral £50 cópias por ml) em um regime ARV estável por pelo menos 3 meses e sem histórico de falha no tratamento ou resistência aos seus componentes individuais. Mais significativamente, é um regime completo de um comprimido que não requer outros ARV.20
BIC/FTC/TAF foi aprovado em 2018 após quatro ensaios clínicos. Dois dos ensaios clínicos testaram a eficácia e a segurança do BIC/FTC/TAF em pacientes sem histórico de ART: Ensaio 1489 (randomizado, BIC/FTC/TAF vs. abacavir/ dolutegravir/lamivudina, e Ensaio 1490 (randomizado, BIC/FTC/TAF vs. dolutegravir + emtricitabina/tenofovir alafenamida ).21,22 No ensaio 1489, o desfecho primário da carga viral <50 cópias/mL foi alcançado em 92% do grupo BIC/FTC/TAF e 93% do grupo ABC/DTG/3TC (diferença de tratamento de -0,6%; intervalo de confiança de 95%, -4,8% a 3,6%). No ensaio 1490, o desfecho primário da carga viral <50 cópias/mL foi alcançado em 89% do grupo BIC/FTC/TAF e 93% do grupo DTG + FTC/TAF (diferença de tratamento de -3,5%; 95% CI, -7,9% a 1,0%).21,22
Os outros dois ensaios testaram a eficácia e segurança do BIC/FTC/TAF em pacientes virologicamente suprimidos que seriam trocados de seus regimes ART atuais para o BIC/FTC/TAF: Ensaio 1844 (randomizado, alternando de dolutegravir mais abacavir/lamivudina ou ABC/DTG/3TC para BIC/FTC/TAF) e Ensaio 1878 (rótulo aberto, alternando de atazanavir ou darunavir reforçado mais abacavir/emtricitabina ou emtricitabina/tenofovir disoproxil fumarate para BIC/FTC/TAF).23,24 No ensaio de 1844, o desfecho primário dos pacientes que perderam o estado de supressão virológica (carga viral ³50 cópias por ml) foi observado em 1% do grupo BIC/FTC/TAF e <1% do grupo do regime original (diferença de tratamento de 0,7%, IC 95%, -1,0% a 2,8%). No Trial 1878, o desfecho primário dos pacientes que perderam seu estado de supressão virológica foi observado em 2% do grupo BIC/FTC/TAF e 2% do grupo do regime original (diferença de tratamento de 0,0%; 95% IC, -2,5% a 2,5%).23,24
BIC/FTC/TAF é dosado uma vez ao dia por via oral, com ou sem alimentos. As reações adversas mais comumente relatadas nos pacientes foram diarréia, náusea e dor de cabeça.20-24
Dolutegravir/Lamivudina (Dovato)
Combinação dolutegravir/lamivudina (DTG/3TC), um INSTI e NRTI, foi aprovada em 2019. É o primeiro regime completo de duas drogas, em dose fixa, para o tratamento da infecção pelo HIV-1 em pacientes adultos ingênuos. Isto contrasta com as opções do regime padrão de tratamento de três drogas tradicionalmente necessárias. Isto pode oferecer oportunidades em pacientes que não podem tolerar nenhum dos regimes de três drogas mais comuns devido a efeitos adversos ou interações medicamentosas inevitáveis.25,26
A eficácia e segurança da combinação dolutegravir/lamivudina foram demonstradas em dois estudos idênticos, GEMINI-1 e GEMINI-2.27 Estes estudos inscreveram um total de 1.433 adultos infectados pelo HIV-1, ingênuos no tratamento, que foram randomizados para receber um regime de duas drogas, dolutegravir 50 mg mais lamivudina 150 mg, ou um regime de três drogas, dolutegravir mais emtricitabina mais tenofovir disoproxil fumarate. O ponto final primário de alcançar uma carga viral <50 cópias/mL mostrou DTG/3TC como não-inferior-91% dos 716 pacientes com dois medicamentos e 93% dos 717 pacientes com três medicamentos (diferença de tratamento de -1,7%; IC 95%, -4,4% a 1,1%)- quando os resultados dos dois estudos foram agrupados. Os estudos reunidos também mostraram que, numericamente, menos pacientes tiveram eventos adversos relacionados a drogas no esquema de dois medicamentos, ao contrário do esquema de três medicamentos (126 de 716 e 169 de 717, respectivamente). Devido à eficácia não-inferior e a um perfil de tolerabilidade semelhante, o Departamento de Saúde e Serviços Humanos conseguiu incluir a combinação em dose fixa DTG/3TC nas diretrizes de HIV/AIDS como um regime inicial recomendado para a maioria das pessoas com HIV.27
Combinação dolutegravir/lamivudina é dosada uma vez ao dia pela boca, com ou sem alimentos. As reacções adversas mais comuns observadas nos doentes são dor de cabeça, náuseas, diarreia, fadiga e insónia. Apesar de ser um comprimido combinado de duas medicações, não há necessidade de administrá-lo com outros medicamentos ARV porque é um regime terapêutico completo.25-27
Emtricitabina/Tenofovir Alafenamida para Profilaxia Pré-Exposição (PrEP)
Desde 2012, a única opção aprovada pelo FDA para PrEP foi a FTC/ TDF.11 Isto mudou em 2019 com a aprovação da combinação emtricitabina/tenofovir alafenamida (FTC/TAF),13 um medicamento combinado estruturalmente similar. Agora está indicado para uso em PrEP em pacientes não infectados com alto risco de transmissão do HIV através de relações sexuais. Isso exclui pacientes em risco de ter relações sexuais vaginais receptivas, pois essa população ainda não foi avaliada.
Aprovação da PrEP é baseada no recente estudo DISCOVER, um estudo randomizado e duplo-cego que compara a FTC/TAF com a FTC/TDF padrão de tratamento para reduzir o risco de adquirir a infecção pelo HIV-1 em homens e mulheres transgêneros que fazem sexo com homens e estão em risco de infecção pelo HIV-1.7 O estudo foi conduzido como um estudo randomizado, duplo-cego, em grupo paralelo, com um seguimento mínimo de 48 semanas, com pelo menos 50% dos participantes tendo 96 semanas de seguimento após a randomização. Foram inscritos 5.399 participantes que foram randomizados 1:1 em ambos os grupos. O objetivo principal do estudo foi avaliar a incidência de infecção pelo HIV-1 por 100 pessoas-anos. Entre os 2.694 participantes do braço FTC/TAF, a incidência do HIV-1 foi observada em 7 pacientes (0,16/100 pessoas-ano). Entre os 2.693 participantes do braço FTC/TDF, a incidência de HIV-1 foi observada em 15 pacientes (0,34/100 anos-pessoa). Essas incidências demonstram que o FTC/TAF não era inferior ao FTC/TDF nos participantes do estudo que estavam em risco de adquirir o HIV e, por fim, permitiram que a FDA adicionasse PrEP às indicações para FTC/TAF.13
O lugar do FTC/TAF na terapia do HIV provavelmente ainda não está claro. Embora tenha encontrado uso em outras áreas de tratamento do HIV, seu benefício sobre a alternativa neste cenário ainda não foi determinado de forma conclusiva. Embora semelhante, a TAF pode oferecer uma menor incidência de alterações da densidade óssea e disfunção renal, efeitos adversos associados à TDF. Esta diferença não está bem estabelecida, entretanto, com alguns dados sugerindo que, em regimes que não incluem um reforço farmacocinético como o cobicistato ou ritonavir, este benefício pode não ser clinicamente significativo. 27-29
Conclusão
Devido à complexidade do HIV e seu potencial de resistência, a terapia ARV pode rapidamente se tornar onerosa para os pacientes. Entre 2018 e o presente, a comunidade médica tem visto uma ampla expansão das terapias ARV aprovadas pelo FDA para o tratamento do HIV. Estas terapias incluem novas doses fixas, comprimidos combinados; novos medicamentos que funcionam através de mecanismos diferentes dos anteriormente existentes no mercado; e até mesmo novas indicações para medicamentos anteriormente existentes. Esses novos medicamentos já causaram impacto nas diretrizes de tratamento atuais e podem ajudar os pacientes a viver vidas mais longas e saudáveis.
O conteúdo deste artigo é apenas para fins informativos. O conteúdo não pretende ser um substituto para o aconselhamento profissional. A confiança em qualquer informação fornecida neste artigo é apenas por sua conta e risco.
1. Vella S, Schwartländer B, Sow SP, et al. A história da terapia anti-retroviral e da sua implementação em áreas de recursos limitados do mundo. A SIDA. 2012;26(10):1231-1241.
2. Arts EJ, Hazuda DJ. HIV-1 terapia com medicamentos anti-retrovirais. Cold Spring Harb Perspect Med. 2012;2(4):a007161.
3. Chaudhuri S, Symons JA, Deval J. Inovação e tendências no desenvolvimento e aprovação de medicamentos antivirais: 1987-2017 e mais além. Antiviral Res. 2018;155:76-88.
4. Inserção da embalagem de Trogarzo (ibalizumab-uiyk). Montreal, Québec: Theratechnologies Inc.; Março 2018.
5. Inserção do pacote Pifeltro (doravirine). Whitehouse Station, NJ: Merck & Co, Inc; Março de 2019.
6. Rukobia (fostemsavir): folheto informativo. Pesquisa Triangle Park, NC: GlaxoSmithKline; Julho 2020.
7. Pan F, Chernew ME, Fendrick AM. Impacto de medicamentos combinados em dose fixa na aderência a medicamentos prescritos. J Gen Med. Intern. 2008;23(5):611-614.
8. Verma AA, Khuu W, Tadrous M,et al. Medicamentos anti-hipertensivos combinados em dose fixa, aderência e resultados clínicos: um estudo de coorte retrospectivo de base populacional. PLoS Med. 2018;15(6):e1002584.
9. Institutos Nacionais de Saúde. HIVinfo. FDA-approved HIV medicines. hivinfo.nih.gov/understanding-hiv/fact-sheets/fda-approved-hiv-medicines. Acesso 22 de setembro de 2020.
10. Folha de embalagem Prezista (darunavir). Titusville, NJ: Terapêutica Janssen; Maio de 2019.
11. Truvada (emtricitabine/tenofovir disoproxil fumarate): folheto informativo. Cidade de Foster, CA: Gilead Sciences, Inc; Junho de 2004/2020.
12. Delstrigo (doravirina/lamivudina/tenofovir disproxil fumarate): folheto informativo. White House Starion, NJ: Merck & Co, Inc; Agosto de 2018.
13. Descovy (emtricitabina/tenofovir alafenamida): folheto informativo. Foster City, CA: Gilead Sciences, Inc.; Dezembro 2019.
14. Tivicay (dolutegravir): folheto informativo. Research Triangle Park, NC. GlaxoSmithKline; Junho 2020.
15. Iacob SA, Iacob DG. Ibalizumab visando os receptores CD4, uma molécula emergente na terapia do HIV. Microbiol frontal. 2017;8:2323.
16. Emu B, Fessel J, Schrader S, et al. Estudo de fase 3 do ibalizumab para o HIV-1 multirresistente. N Engl J Med. 2018;379:645-654.
17. Li Z, Zhou N, Sun Y, et al. Atividade do inibidor de ligação ao HIV-1 BMS-626529, o componente ativo do prodrug BMS-663068, contra vírus CD4 independentes e envelopes HIV-1 resistentes a outros inibidores de entrada. Quimioterapia de Agentes Antimicrobianos. 2013:57(9):4172-4180.
18. Kozal M, Aberg J, Pialoux G. Fostemsavir em adultos com infecção por HIV-1 multirresistente. N Engl J Med. 2020;382(13):1232-1243.
19. Cahn P, Fink V, Patterson P. Fostemsavir: um novo inibidor de fixação CD4. Curr Opinião HIV AIDS. 2018;13(4):341-345.
20. Biktarvy (bictecgravir/emtricitabine/tenofovir alafenamida) biktarvy (bictecgravir/emtricitabine/tenofovir alafenamida) biktarvy. Foster City, CA: Gilead Sceinces, Inc.; Fevereiro 2018.
21. Gallant J, Lazzarin A, Mills M, et al. Bictegravir, emtricitabina e tenofovir alafenamida versus dolutegravir, abacavir e lamivudina para o tratamento inicial da infecção pelo HIV-1 (GS-US-380-1489): um ensaio duplo-cego, multicêntrico, fase 3, randomizado e controlado de não-inferioridade. Lanceta. 2017;390(10107):2063-2072.
22. Sax PE, Pozniak A, Montes M, et al. Coformulated bictegravir, emtricitabine, e tenofovir alafenamide versus dolutegravir com emtricitabine e tenofovir alafenamide, para tratamento inicial da infecção pelo HIV-1 (GS-US-380-1490): um ensaio randomizado, duplo-cego, multicêntrico, fase 3, não-inferioritário. Lanceta. 2017;390(10107):2073-2082.
23. Malina JM, Ward D, Brar I, et al. Mudando para dose fixa bictegravir, emtricitabina e tenofovir alafenamida de dolutegravir mais abacavir elamivudina em adultos virologicamente suprimidos com HIV-1: resultados de 48 semanas de um ensaio randomizado, duplo-cego, multicêntrico, controlado ativamente, fase 3, não-inferioridade. Lanceta HIV. 2018;5(7):E357-E365.
24. Daar ES, De Jesus E, Ruane P, et al. Eficácia e segurança da comutação para dose fixa de bictegravir, emtricitabina, e tenofovir alafenamida de regimes baseados em inibidores de protease em adultos virologicamente suprimidos com HIV-1: resultados de 48 semanas de um ensaio randomizado, aberto, multicêntrico, fase 3, não-inferioridade. Lanceta HIV. 2018;5(7):e347-e356.
25. Dovato (dolutegravir/lamivudine) bula. Research Triangle Park, NC: GlaxoSmithKline. Março 2020.
26. Scott LJ. Dolutegravir/lamivudine regime de mesa única: uma revisão na infecção pelo HIV-1. Drogas. 2020;80(1):61-72.
27. Cahn P, Madero JS, Arribas JR, et al. Equipe de Estudo GEMINI. Dolutegravir plus lamivudine versus dolutegravir plus tenofovir disoproxil fumarate and emtricitabine in antiretroviral-naive adultas com infecção pelo HIV-1 (GEMINI-1 e GEMINI-2): semana 48 resultados de dois ensaios multicêntricos, duplo-cego, randomizados, não-inferiorizados, fase 3. Lanceta. 2019;393(10167):143-155.
28. Mayer KH, Molina JM, Thompson MA, et al. Emtricitabine and tenofovir alafenamide vs. emtricitabine and tenofovir disoproxil fumarate for HIV pre-exposure prophylaxis (DISCOVER): resultados primários de um ensaio randomizado, duplo-cego, multicêntrico, controlado ativamente, fase 3 não-inferiority. Lanceta. 2020;396(10246):239-254.
29. Hill A, Hughes SL, Gotham D, Pozniak AL. Tenofovir alafenamida versus tenofovir disoproxil fumarato: existe uma verdadeira diferença na eficácia e segurança? J Virus Erad. 2018;4(2):72-79.