Die VSEPR-Theorie ist in der Lage, die Formen von Molekülen zu erklären und vorherzusagen, die einsame Paare enthalten. In einem solchen Fall wird davon ausgegangen, dass sowohl die einsamen Paare als auch die Bindungspaare sich gegenseitig abstoßen und ausweichen. Da das SnCl2-Molekül zum Beispiel zwei Bindungen enthält, könnte man erwarten, dass es wie BeCl2 linear ist. Wenn wir jedoch das Lewis-Diagramm zeichnen, finden wir ein einsames Paar sowie zwei Bindungspaare in der Valenzschale des Sn-Atoms:
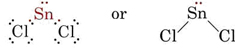_Chloride.jpg?revision=1&size=bestfit&width=235&height=48)
Ein einsames Paar beeinflusst auch die Struktur von Ammoniak, NH3. Da dieses Molekül der Oktettregel gehorcht, ist das N-Atom von vier Elektronenpaaren umgeben:
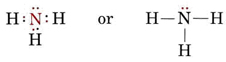
Wenn diese Paare alle gleichwertig wären, würden wir erwarten, dass der Winkel zwischen ihnen der regelmäßige Tetraederwinkel von 109,5° ist. Experimentell wurde festgestellt, dass der Winkel etwas kleiner ist, nämlich 107°. Dies liegt wiederum daran, dass das einsame Paar „dicker“ ist als die Bindungspaare und diese enger zusammenpressen kann.
Die elektronische Struktur des H2O-Moleküls ähnelt der des NH3, außer dass ein Bindungspaar durch ein einsames Paar ersetzt wurde:
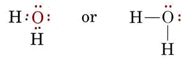
Beispiel \(\PageIndex{1}\) : Molekülgeometrie
Skizzieren und beschreiben Sie die Geometrie der folgenden Moleküle: (a) GaCl3, (b) AsCl3 und (c) AsOCl3.
Lösung
a) Da das Element Gallium zur Gruppe III gehört, hat es drei Valenzelektronen. Das Lewis-Diagramm für GaCl3 lautet daher
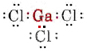
Da es drei Bindungspaare und keine einsamen Paare um das Ga-Atom gibt, schließen wir, dass die drei Cl-Atome trigonal angeordnet sind und dass alle vier Atome in derselben Ebene liegen.
b) Arsen gehört zur Gruppe V und hat daher fünf Valenzelektronen. Die Lewis-Struktur für AsCl3 lautet daher
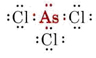
Da ein einsames Paar vorhanden ist, hat dieses Molekül die Form einer trigonalen Pyramide, wobei der As-Kern etwas oberhalb eines gleichseitigen Dreiecks von Cl-Kernen liegt.
c) Das Lewis-Diagramm für AsOCl3 ähnelt dem von AsCl3.

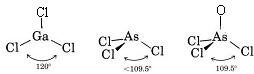
Die VSEPR-Theorie kann auch auf Moleküle angewendet werden, die fünf und sechs Valenzelektronenpaare enthalten, von denen einige einsame Paare sind. Wir haben solche Spezies hier nicht berücksichtigt, da die meisten Verbindungen in die von uns beschriebenen Kategorien fallen.
Mitwirkende
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff und Adam Hahn.