Das chemische Element Kobalt wird zu den Übergangsmetallen gezählt. Es wurde im Jahr 1735 von Georg Brandt entdeckt.

Datenbereich
| Klassifizierung: | Kobalt ist ein Übergangsmetall |
| bläulich-weiß | |
| Zustand: | |
| 2930 oC, 3203 K | |
| Elektronen: | 27 |
| 27 | |
| Neutronen im häufigsten Isotop: | 32 |
| Elektronenschalen: | 2,8,15,2 |
Mehr anzeigen: Wärme, Energie, Oxidation, Reaktionen,
Verbindungen, Radien, Leitfähigkeiten
| Atomvolumen: | 6.7 cm3/mol |
| Struktur: | |
| Schmelzwärme | |
| 1. Ionisierungsenergie | 758.4 kJ mol-1 |
| 2.Ionisierungsenergie | 1646 kJ mol-1 |
| 3.Ionisierungsenergie | 3232.2 kJ mol-1 |
| Elektronenaffinität | 63.8 kJ mol-1 |
| 0 | |
| 5 | |
| 3 | |
| Polarisierbarkeitsvolumen | |
| Reaktion mit 15 M HNO3 | |
| Reaktion mit 6 M NaOH | |
| Hydrid(e) | |
| 135 pm | |
| Ionischer Radius (3+-Ion) | |
| Ionenradius (1- Ion) | |
| – | |
| Gefrier-/Schmelzpunkt: | 1495 oC, 1768 K |
Entdeckung des Kobalts
Seit dem Altertum wurden Kobaltverbindungen zur Herstellung von blauem Glas und Keramik verwendet.
Das Element wurde erstmals vom schwedischen Chemiker George Brandt im Jahr 1735 isoliert. Er wies nach, dass das Vorhandensein des Elements Kobalt für die blaue Farbe des Glases verantwortlich ist und nicht, wie bisher angenommen, Wismut.
Um 1741 schrieb er: „Wie es sechs Arten von Metallen gibt, so habe ich auch mit zuverlässigen Experimenten gezeigt … dass es auch sechs Arten von Halbmetallen gibt: ein neues Halbmetall, nämlich Kobalt regulus neben Quecksilber, Wismut, Zink und den regulus von Antimon und Arsen.“
Das Wort Kobalt leitet sich vom deutschen ‚Kobold‘ ab, was Kobold oder Elf bedeutet. Das folgende Bild von Kobalt stammt von Ben Mills.


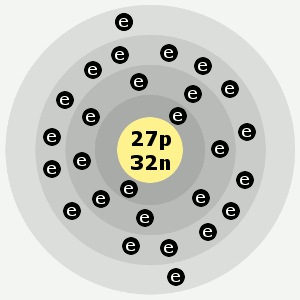
Elektronenschalen von Kobalt
Aussehen und Eigenschaften
Schädliche Wirkungen:
Kobalt und seine Verbindungen gelten als leicht giftig bei Hautkontakt und als mäßig giftig beim Verschlucken.
Eigenschaften:
Kobalt ist ein bläulich-weißes, glänzendes, hartes, sprödes Metall. Es ist ferromagnetisch.
Das Metall ist chemisch aktiv und bildet viele Verbindungen. Kobalt bleibt bis zur höchsten Temperatur aller magnetischen Elemente magnetisch (es hat einen Curie-Punkt von 1121oC).
Verwendungen von Kobalt
Kobalt wird in Legierungen für Teile von Flugzeugtriebwerken und in Legierungen mit korrosions- und verschleißfesten Anwendungen verwendet.
Kobalt wird häufig in Batterien und in der Galvanotechnik verwendet.
Kobaltsalze werden verwendet, um Glas und Keramik blau und grün zu färben.
Radioaktives 60Co wird bei der Behandlung von Krebs eingesetzt.
Kobalt ist für viele Lebewesen lebensnotwendig und ist ein Bestandteil von Vitamin B12.
Kobalt wird auch in Samarium-Kobalt-Permanentmagneten verwendet. Diese werden in Gitarren-Tonabnehmern und Hochgeschwindigkeitsmotoren verwendet.
Häufigkeit und Isotope
Häufigkeit Erdkruste: 25 Gewichtsteile pro Million, 8 Teile pro Million in Mol
Häufigkeit Sonnensystem: 4 Teile pro Million nach Gewicht, 0,7 Teile pro Million nach Molen
Kosten, rein: $21 pro 100g
Kosten, lose: $4,40 pro 100g
Quelle: Kobalt kommt in der Natur nicht als freies Element vor. Es ist in Mineralerzen enthalten. Die wichtigsten Kobalterze sind Kobaltit (CoAsS), Erythrit (hydratisiertes Arsenat von Kobalt), Glaukodot (Co,Fe)AsS und Skutterudit (Co,Ni)As3. Kobalt wird im Allgemeinen als Nebenprodukt des Nickel- und Kupferbergbaus gewonnen.
Isotope: Kobalt hat 22 Isotope, deren Halbwertszeiten bekannt sind, mit den Massenzahlen 50 bis 72. Natürlich vorkommendes Kobalt besteht aus seinem einen stabilen Isotop, 59Co.

- Edward Smedley, Hugh James Rose, Henry John Rose, Encyclopaedia Metropolitana; or Universal Dictionary of Knowledge., 1845, Volume 4, p693 William Clowes and Sons.
Zitieren Sie diese Seite
Zitieren Sie diese Seite
Für eine Online-Verknüpfung, kopieren Sie bitte eine der folgenden Angaben:
<a href="https://www.chemicool.com/elements/cobalt.html">Cobalt</a>
oder
<a href="https://www.chemicool.com/elements/cobalt.html">Cobalt Element Facts</a>
Um diese Seite in einem akademischen Dokument zu zitieren, verwenden Sie bitte die folgende MLA-konforme Zitierweise:
"Cobalt." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/cobalt.html>.