VSEPR-teoria pystyy selittämään ja ennustamaan yksinäisiä pareja sisältävien molekyylien muodot. Tällöin sekä yksinäisten parien että sidosparien katsotaan hylkivän ja välttelevän toisiaan. Koska esimerkiksi SnCl2-molekyylissä on kaksi sidosta, sen voisi olettaa olevan BeCl2:n tavoin lineaarinen. Jos kuitenkin piirretään Lewis-diagrammi, löydetään Sn-atomin valenssikuoresta sekä yksinäinen pari että kaksi sidosparia:
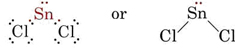_Chloride.jpg?revision=1&size=bestfit&width=235&height=48)
Yksinäinen pari vaikuttaa myös ammoniakin, NH3:n, rakenteeseen. Koska tämä molekyyli noudattaa oktettisääntöä, N-atomia ympäröi neljä elektroniparia:
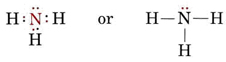
Jos nämä parit olisivat kaikki ekvivalentteja, odottaisimme niiden välisen kulman olevan säännöllinen tetraedrikulma 109,5°. Kokeellisesti on havaittu, että kulma on hieman pienempi, nimittäin 107°. Tämäkin johtuu siitä, että yksinäinen pari on ”paksumpi” kuin sidosparit ja pystyy puristamaan ne lähemmäksi toisiaan.
H2O-molekyylin elektronirakenne muistuttaa NH3:n elektronirakennetta sillä erotuksella, että yksi sidospari on korvattu yksinäisellä parilla:
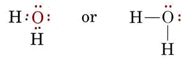
Esimerkki \(\PageIndex{1}\) : Molekyyligeometria
Kuvaile ja kuvaa seuraavien molekyylien geometria: (a) GaCl3, (b) AsCl3 ja (c) AsOCl3.
Ratkaisu
a) Koska alkuaine gallium kuuluu ryhmään III, sillä on kolme valenssielektronia. GaCl3:n Lewis-diagrammi on siis
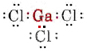
Koska Ga-atomin ympärillä on kolme sidosparia eikä yhtään yksinäistä paria, päättelemme, että kolme Cl-atomia on sijoitettu trigonaalisesti ja että kaikki neljä atomia ovat samassa tasossa.
b) Arseeni kuuluu ryhmään V ja sillä on siis viisi valenssielektronia. AsCl3:n Lewis-rakenne on siis
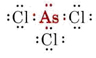
Koska yksinäinen pari on läsnä, tämän molekyylin muoto on trigonaalinen pyramidi, jossa As-ydin on hieman Cl-ytimien muodostaman tasasivuisen kolmion yläpuolella.
c) AsOCl3:n Lewis-diagrammi on samanlainen kuin AsCl3:n.

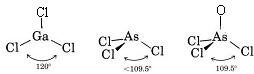
VSEPR-teoriaa voidaan soveltaa myös molekyyleihin, joissa on viisi ja kuusi valenssielektroniparia, joista osa on yksinäisiä pareja. Emme ole sisällyttäneet tällaisia lajeja tähän, koska suurin osa yhdisteistä kuuluu kuvaamiimme luokkiin.
Tekijät
-
Ed Vitz (Kutztownin yliopisto), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (Minnesota Rochesterin yliopisto), Tim Wendorff ja Adam Hahn.