Kemiallinen alkuaine koboltti luokitellaan siirtymämetalliin. Sen löysi vuonna 1735 George Brandt.

Tietovyöhyke
| Luokitus: | Koboltti on siirtymämetalli |
| Väri: | sinertävän valkoinen |
| Atomipaino: | 58.9332 |
| Tila: | kiinteä |
| Sulamispiste: | 1495 oC, 1768 K |
| Kiehumispiste: | 27 |
| Runsaimman isotoopin neutronit: | 32 |
| Elektronikuoret: | 2,8,15,2 |
| Elektronikonfiguraatio: | 3d7 4s2 |
| Tiheys @ 20oC: | 8.90 g/cm3 |
Näytä lisää: Lämmöt, energiat, hapettuminen, reaktiot,
Yhdisteet, säteet, johtavuudet
| Atomin tilavuus: | 6.7 cm3/mol |
| Rakenne: | hcp: heksagonaalinen tiivis pkd |
| Kovuus: | 5.0 mohs |
| Ominaislämpökapasiteetti | 0.42 J g-1 K-1 |
| Sulamislämpö | 16.190 kJ mol-1 |
| Höyrystymislämpö | 426 kJ mol-1 |
| Höyrystymislämpö | 373.3 kJ mol-1 |
| 1. ionisaatioenergia | 758.4 kJ mol-1 |
| 2. ionisaatioenergia | 1646 kJ mol-1 |
| 3. ionisaatioenergia | 3232.2 kJ mol-1 |
| Elektroniaffiniteetti | 63.8 kJ mol-1 |
| Minimi hapetusluku | -1 |
| Min. yleinen hapetusluku. | 0 |
| Maksimi hapetusluku | 5 |
| Maks. yleinen hapetusluku | 3 |
| Elektronegatiivisuus (Paulingin asteikko) | 1.88 |
| Polarisoituvuus tilavuus | 7.5 Å3 |
| Reaktio ilman kanssa | lievä, w/ht ? Co3O4 |
| Reaktio 15 M HNO3 | voimakas, ? Co(NO3)2, NOx |
| Reaktio 6 M HCl | melkoinen, ? H2, CoCl2 |
| Reaktio 6 M NaOH | – |
| Oksidi(s) | CoO, Co3O4 |
| Hydridi(s) | Ei |
| Kloridi(s) | CoCl2 |
| Atom. säde | 135 pm |
| Ionisäde (1+ -ioni) | – |
| Ionisäde (2+ -ioni) | 83.8 pm |
| Ionisäde (3+-ioni) | 71.8 pm |
| Ionisäde (1-ioni) | – |
| Ionisäde (2-ioni) | – |
| Ionisäde (3-… | – |
| Lämmönjohtavuus | 100 W m-1 K-1 |
| Sähkönjohtavuus | 17.9 x 106 S m-1 |
| Pakkas-/sulamispiste: | 1495 oC, 1768 K |
Koboltin löytäminen
Vanhoista ajoista lähtien kobolttiyhdisteitä on käytetty sinisen lasin ja keramiikan valmistukseen.
Elementin eristi ensimmäisen kerran ruotsalainen kemisti George Brandt vuonna 1735. Hän osoitti, että koboltin läsnäolo aiheutti lasin sinisen värin, ei vismutin, kuten aiemmin luultiin.
Noin noin vuonna 1741 hän kirjoitti: ”Kuten on olemassa kuusi erilaista metallia, niin olen myös osoittanut luotettavilla kokeilla… että on olemassa myös kuusi erilaista puolimetallia: uusi puolimetalli, nimittäin koboltti regulus elohopean, vismutin, sinkin sekä antimonin ja arseenin regulusten lisäksi.”
Sana koboltti tulee saksan koboldista, joka tarkoittaa menninkäistä tai haltijaa. Alla oleva kuva koboltista on Ben Millsin kuva.


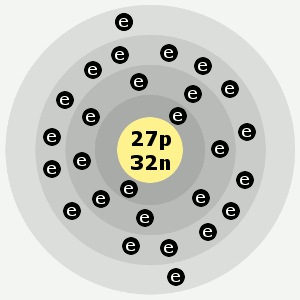
Koboltin elektronikuoret
Eritysmuoto ja ominaisuudet
Haitalliset vaikutukset:
Kobolttia ja sen yhdisteitä pidetään lievästi myrkyllisinä ihokosketusnäytteenä ja kohtalaisen myrkyllisinä nieltynä.
Ominaisuudet:
Koboltti on sinertävän valkoinen, kiiltävä, kova ja hauras metalli. Se on ferromagneettinen.
Metalli on kemiallisesti aktiivinen muodostaen monia yhdisteitä. Koboltti pysyy magneettisena kaikista magneettisista alkuaineista korkeimpaan lämpötilaan asti (sen Curie-piste on 1121oC).
Koboltin käyttötarkoitukset
Kobolttia käytetään lentokoneiden moottoreiden osien seoksissa ja korroosion- ja kulutuksenkestävissä seoksissa.
Kobolttia käytetään laajalti paristoissa ja galvanoinnissa.
Kobolttisuoloja käytetään antamaan sinistä ja vihreää väriä lasille ja keramiikalle.
Radioaktiivista 60Co:ta käytetään syövän hoidossa.
Koboltti on elintärkeä monille eläville olentoille, ja se on B12-vitamiinin komponentti.
Kobolttia käytetään myös samarium-koboltti- eli kobolttikromatografiassa. Niitä käytetään kitaranvahvistimissa ja suurnopeusmoottoreissa.
Runsaus ja isotoopit
Runsaus maankuori: 25 miljoonasosaa painosta, 8 miljoonasosaa mooleista
Runsaus aurinkokunta: 4 miljoonasosaa painosta, 0,7 miljoonasosaa mooleista
Kustannus, puhdas: 21 dollaria 100 grammalta
Kustannus, irtotavarana: 4,40 dollaria 100 grammalta
Lähde: Kobolttia ei esiinny vapaana alkuaineena luonnossa. Sitä esiintyy mineraalimalmeissa. Tärkeimmät koboltin malmit ovat kobalttiitti (CoAsS), erytriitti (koboltin hydratoitu arsenaatti), glaukodiitti (Co,Fe)AsS ja skutterudiitti (Co,Ni)As3. Kobolttia tuotetaan yleensä nikkeli- ja kuparikaivostoiminnan sivutuotteena.
Isotoopit: Koboltilla on 22 isotooppia, joiden puoliintumisajat tunnetaan ja joiden massanumerot ovat 50-72. Luonnossa esiintyvä koboltti koostuu sen yhdestä stabiilista isotoopista, 59Co.

- Edward Smedley, Hugh James Rose, Henry John Rose, Encyclopaedia Metropolitana; or Universal Dictionary of Knowledge.., 1845, Volume 4, p693 William Clowes and Sons.
Cite this Page
Cite this Page
Verkkolinkitystä varten kopioi ja liitä jompikumpi seuraavista:
<a href="https://www.chemicool.com/elements/cobalt.html">Cobalt</a>
tai
<a href="https://www.chemicool.com/elements/cobalt.html">Cobalt Element Facts</a>
Lainataksesi tätä sivua akateemisessa asiakirjassa, käytä seuraavaa MLA:n mukaista lainausta:
"Cobalt." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/cobalt.html>.
.