Les sels biliaires et les acides biliaires sont des dérivés polaires du cholestérol, et représentent la principale voie d’élimination du stéroïde dans l’organisme.
Ce sont des molécules aux structures similaires mais non identiques, et aux caractéristiques physiques et biologiques diverses.
Elles sont synthétisées dans le foie, stockées dans la vésicule biliaire, sécrétées dans le duodénum, et enfin, pour la plupart, réabsorbées dans l’iléon.
Parce qu’au pH physiologique, ces molécules sont présentes sous forme d’anions, les termes acide biliaire et sels biliaires sont utilisés ici comme synonymes.
CONTENUS
- Structure chimique des sels biliaires
- Primaire, conjugués et secondaires
- Fonction des acides biliaires
- Circulation entéro-hépatique des sels biliaires
- Métabolisme intestinal des acides biliaires
- Fibres solubles et réabsorption des sels biliaires
- Synthèse des acides biliaires primaires
- La voie classique ou neutre
- La voie alternative ou acide
- Voies mineures
- Sels biliaires : régulation de la synthèse
- Structure chimique des sels biliaires
- Sels biliaires primaires, conjugués et secondaires
- Fonction des acides biliaires
- Circulation entérohépatique des sels biliaires
- Métabolisme intestinal des acides biliaires
- Fibres solubles et réabsorption des sels biliaires
- Synthèse des acides biliaires primaires
- La voie classique ou neutre
- La voie alternative ou acide
- Voies mineures
- Sels biliaires : régulation de la synthèse
Structure chimique des sels biliaires
Les sels biliaires présentent des similitudes et des différences avec la molécule de cholestérol.
Comme le stéroïde, ils possèdent un noyau composé de quatre cycles fusionnés : trois cycles cyclohexane, étiquetés A, B et C, et un cycle cyclopentane, étiqueté D. Cette structure est le perhydrocyclopentanophénanthrène, plus communément appelé noyau stéroïde.
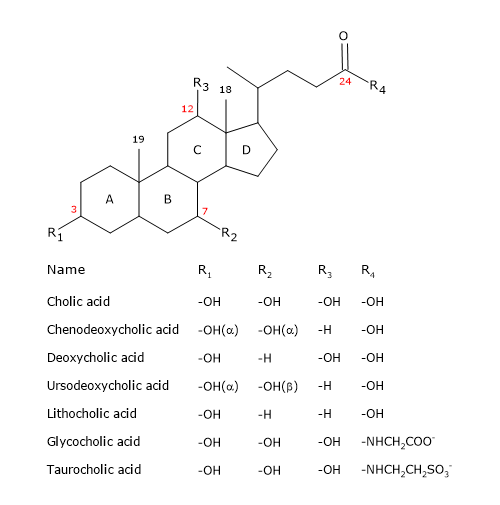
Chez les vertébrés supérieurs, ils ont 24 atomes de carbone, car la chaîne latérale est plus courte de trois carbones que l’originale. Chez les vertébrés inférieurs, les acides biliaires ont 25, 26 ou 27 atomes de carbone. La chaîne latérale se termine par un groupe carboxyle, ionisé à pH 7, qui peut être lié à l’acide aminé glycine ou taurine (voir ci-dessous).
En plus du groupe hydroxyle en position 3, ils ont des groupes hydroxyle en position 7 et/ou 12.
Tout cela les rend beaucoup plus polaires que le cholestérol.
Les cycles A et B étant fusionnés en configuration cis, la structure plane du noyau stéroïdien est courbe et il est possible d’identifier :
- un côté concave, hydrophile car les groupes hydroxyles et le groupe carboxyle de la chaîne latérale, avec ou sans l’acide aminé lié, sont orientés vers lui ;
- un côté convexe, hydrophobe car les groupes méthyles présents en position 18 et 19 sont orientés vers lui.
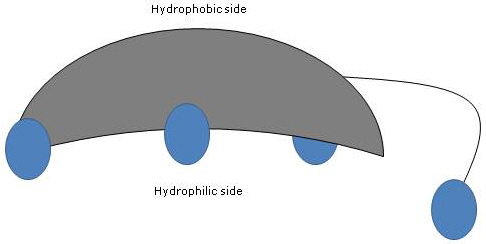
Donc, possédant à la fois des groupes polaires et non polaires, ce sont des molécules amphiphiles et d’excellents tensioactifs. Cependant, leur structure chimique les rend différents de nombreux autres tensioactifs, souvent composés d’une région de tête polaire et d’une queue non polaire.
Sels biliaires primaires, conjugués et secondaires
Les acides biliaires primaires sont ceux synthétisés directement à partir du cholestérol dans les hépatocytes. Chez l’homme, les plus importants sont l’acide cholique et l’acide chénodésoxycholique, qui constituent 80% de l’ensemble des acides biliaires. Avant d’être sécrétés dans l’arbre biliaire, ils sont presque entièrement conjugués, jusqu’à 98%, avec la glycine ou la taurine, pour former respectivement des glycoconjugués et des tauroconjugués. En particulier, environ 75% de l’acide cholique et de l’acide chénodésoxycholique sont conjugués avec la glycine, pour former l’acide glycocholique et l’acide glycochenodésoxycholique, les 25% restants avec la taurine, pour former l’acide taurocholique et l’acide taurochenodésoxycholique.
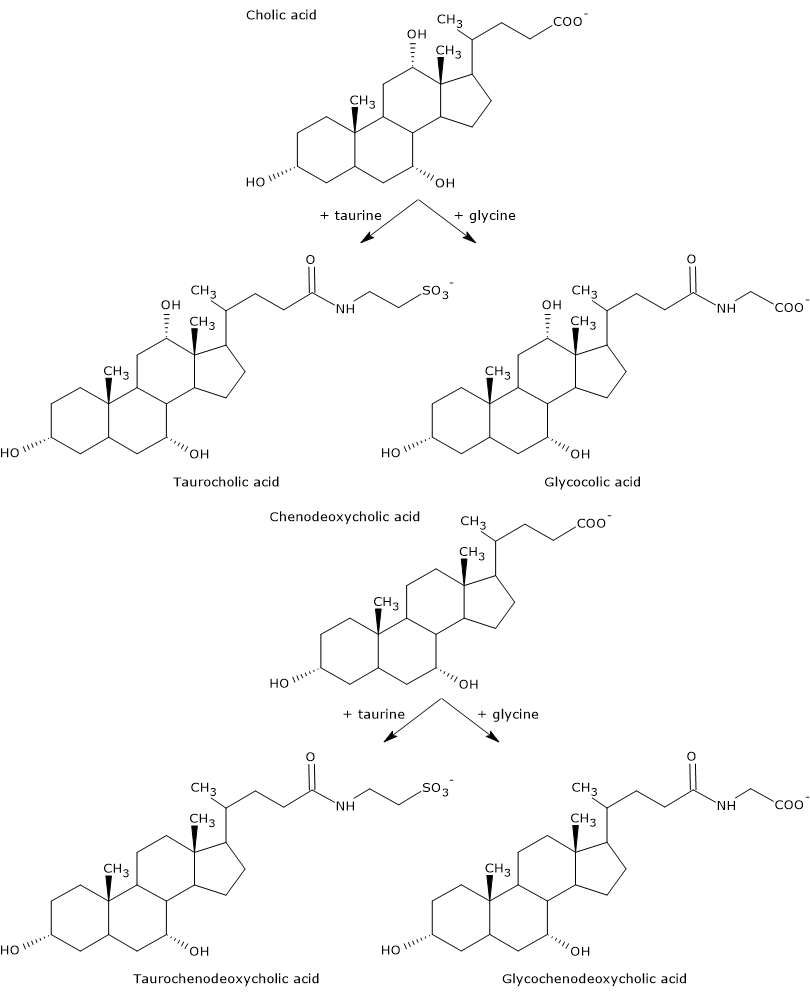
Les acides biliaires conjugués sont des molécules comportant plus de groupes hydrophiles que les acides biliaires non conjugués, donc avec un pouvoir émulsifiant accru. En fait, la conjugaison diminue le pKa des acides biliaires, d’environ 6, une valeur typique des molécules non conjuguées, à environ 4 pour l’acide glycocholique, et environ 2 pour l’acide taurocholique. Cela fait que les acides biliaires conjugués sont ionisés dans une gamme plus large de pH pour former les sels correspondants.
L’hydrophilie de l’acide commun et des sels biliaires diminue dans l’ordre suivant : glycine-conjuguée < taurine-conjuguée < acide lithocholique < acide désoxycholique < acide chénodésoxycholique < acide cholique < acideursodésoxycholique.
Enfin, la conjugaison diminue également la cytotoxicité des acides biliaires primaires.
Les acides biliaires secondaires sont formés à partir des acides biliaires primaires qui n’ont pas été réabsorbés par l’intestin grêle. Une fois arrivés dans le côlon, ils peuvent subir plusieurs modifications par le microbiote intestinal pour former des acides biliaires secondaires (voir ci-dessous). Ils constituent les 20% restants du pool d’acides biliaires de l’organisme.
Une autre façon de catégoriser les sels biliaires est basée sur leur conjugaison avec la glycine et la taurine et leur degré d’hydroxylation. Sur cette base, trois catégories sont identifiées.
- Les trihydroxy conjugués, comme l’acide taurocholique et l’acide glycocholique.
- Les dihydroxy conjugués, comme l’acide glycodésoxycholique, l’acide glycochenodésoxycholique, l’acide taurochenodésoxycholique et l’acide taurodésoxycholique. Ils représentent environ 60% des sels biliaires présents dans la bile.
- Formes non conjuguées, telles que l’acide cholique, l’acide désoxycholique, l’acide chénodéoxycholique et l’acide lithocholique.
Fonction des acides biliaires
Toutes leurs fonctions physiologiques sont réalisées sous la forme conjuguée.
- Ils constituent la principale voie d’élimination du cholestérol du corps humain.
En effet, l’homme ne possède pas les enzymes permettant de rompre les cycles cyclohexane ou cyclopentane du noyau stéroïde, ni d’oxyder le cholestérol en CO2 et en eau.
L’autre mécanisme d’élimination du stéroïde de l’organisme est sous forme de cholestérol per se dans la bile. - Les sels biliaires sont des tensioactifs puissants. Et en particulier, les di- et trihydroxy conjugués sont les meilleurs tensioactifs parmi les acides biliaires, beaucoup plus efficaces que leurs homologues non conjugués, car ils ont plus de groupes polaires.
Une fois en contact avec les lipides apolaires dans la lumière de l’intestin grêle, la surface apolaire convexe interagit avec les lipides apolaires, tels que les triglycérides, les esters de cholestérol et les esters de vitamines liposolubles, tandis que la surface polaire concave interagit avec le milieu aqueux environnant. Cela augmente la dispersion des lipides apolaires dans le milieu aqueux, car cela permet la formation de minuscules gouttelettes lipidiques, augmentant la surface pour :
l’activité lipasique, principalement la lipase pancréatique, (les sels biliaires jouent également un rôle direct dans l’activation de cette enzyme) ;
l’activité estérasique intestinale.
Substantiellement, ils facilitent l’absorption des produits de la digestion des lipides, ainsi que des vitamines liposolubles par la muqueuse intestinale grâce à la formation de micelles mixtes.
Les acides biliaires exercent une fonction similaire dans la vésicule biliaire où, formant des micelles mixtes avec les phospholipides, ils empêchent la précipitation du cholestérol.
Note : En conséquence de l’arrangement des groupes polaires et non polaires, les acides biliaires forment des micelles en solution aqueuse, généralement constituées de moins de 10 monomères, tant que leur concentration est supérieure à la concentration micellaire dite critique ou CMC.
- Au niveau intestinal, ils modulent la sécrétion des enzymes pancréatiques et de la cholécystokinine.
- Dans l’intestin grêle et le gros intestin, ils ont une puissante activité antimicrobienne, principalement l’acide désoxycholique, en particulier contre les bactéries à Gram positif. Cette activité peut être due à des dommages oxydatifs de l’ADN, et/ou à l’endommagement de la membrane cellulaire. Ils jouent donc un rôle important dans la prévention de la prolifération bactérienne, mais aussi dans la régulation de la composition du microbiote intestinal.
- Depuis quelques années, il devient apparent leur rôle régulateur dans le contrôle du métabolisme énergétique, et en particulier pour la manipulation hépatique du glucose.
Circulation entérohépatique des sels biliaires
Après une prise de graisse, les cellules entéroendocrines du duodénum sécrètent la cholécystokinine dans la circulation sanguine. La liaison de l’hormone aux récepteurs des cellules musculaires lisses de la vésicule biliaire favorise leur contraction ; l’hormone provoque également la relaxation du sphincter d’Oddi. Tout ceci aboutit à la sécrétion de la bile, et donc des acides biliaires dans le duodénum.
Dans les conditions physiologiques, le pool de sels biliaires humains est constant, et égal à environ 3-5 g, ce qui est rendu possible par deux processus :
- leur réabsorption intestinale ;
- leur synthèse de novo (voir ci-dessous).
Jusqu’à 95% des sels biliaires sécrétés sont réabsorbés à partir de l’intestin, non pas en même temps que les produits de la digestion des lipides, mais par un processus appelé circulation entéro-hépatique.
C’est un système de recyclage extrêmement efficace, qui semble se produire au moins deux fois pour chaque repas, et qui comprend le foie, l’arbre biliaire, l’intestin grêle, le côlon, et la circulation portale par laquelle les molécules réabsorbées retournent au foie. Cette recirculation est nécessaire car la capacité du foie à synthétiser les acides biliaires est limitée et insuffisante pour satisfaire les besoins intestinaux si les sels biliaires étaient excrétés dans les fèces en grande quantité.
La plupart des sels biliaires sont réabsorbés dans l’iléon distal, la partie inférieure de l’intestin grêle, par un transporteur sodium-dépendant situé dans la bordure en brosse des entérocytes, appelé transporteur d’acide biliaire sodium-dépendant ou ASBT, qui effectue le cotransport d’une molécule d’acide biliaire et de deux ions sodium.
A l’intérieur de l’entérocyte, on pense que les acides biliaires sont transportés à travers le cytosol vers la membrane basolatérale par la protéine de liaison des acides biliaires iléaux ou IBABP. Ils traversent la membrane basolatérale par le transporteur de solutés organiques alpha-beta ou OSTα/OSTβ, passent dans la circulation portale et, liés à l’albumine, atteignent le foie.
Il faut noter qu’un faible pourcentage d’acides biliaires atteint le foie par l’artère hépatique.
Au niveau hépatique, leur extraction est très efficace, avec une fraction d’extraction de premier passage allant de 50 à 90%, pourcentage qui dépend de la structure des acides biliaires. L’absorption des acides biliaires conjugués est principalement médiée par un système de transport actif dépendant du Na+, c’est-à-dire le polypeptide de cotransportation du taurocholate dépendant du sodium ou NTCP. Cependant, une absorption indépendante du sodium peut également se produire, réalisée par des protéines de la famille des polypeptides de transport d’anions organiques ou OATP, principalement OATP1B1 et OATP1B3.
L’étape limitant la vitesse dans la circulation entéro-hépatique est leur sécrétion canaliculaire, largement médiée par la pompe d’exportation des sels biliaires ou BSEP, dans un processus ATP-dépendant. Cette pompe transporte les sels biliaires monoanioniques, qui sont les plus abondants. Les acides biliaires conjugués à l’acide glucuronique ou au sulfate, qui sont dianioniques, sont transportés par différents transporteurs, tels que MRP2 et BCRP.
Note : Les taux sériques d’acides biliaires varient en fonction de la vitesse de leur réabsorption, et sont donc plus élevés pendant les repas, lorsque la circulation entéro-hépatique est plus active.
Métabolisme intestinal des acides biliaires
Les acides biliaires qui échappent à l’absorption iléale passent dans le côlon où ils subissent en partie des modifications par le microbiote intestinal et sont transformés en acides biliaires secondaires.
Les principales réactions sont énumérées ci-dessous.
- Déconjugaison
Sur la chaîne latérale, une hydrolyse de la liaison N-acyl amide en C24 peut se produire, avec libération d’acides biliaires non conjugués et de glycine ou de taurine. Cette réaction est catalysée par des hydrolases bactériennes présentes à la fois dans l’intestin grêle et dans le côlon. - 7α-Déshydroxylation
Quantitativement, c’est la réaction la plus importante, réalisée par des déshydratases bactériennes coliques qui éliminent le groupe hydroxyle en position 7 pour former des acides biliaires 7-désoxy. En particulier, l’acide désoxycholique est formé à partir de l’acide cholique, et l’acide lithocholique, un acide biliaire secondaire toxique, à partir de l’acide chénodésoxycholique.
Il convient de noter que la 7α-déhydroxylation, contrairement à l’oxydation et à l’épimérisation (voir ci-dessous), ne peut se produire que sur des acides biliaires non conjugués, et que la déconjugaison est donc un préalable essentiel. - Oxydation et épimérisation
Ils s’agit de réactions impliquant les groupes hydroxyles en positions 3, 7 et 12, catalysées par les hydroxysteroïdes déshydrogénases bactériennes. Par exemple, l’acide ursodésoxycholique dérive de l’épimérisation de l’acide chénodésoxycholique.
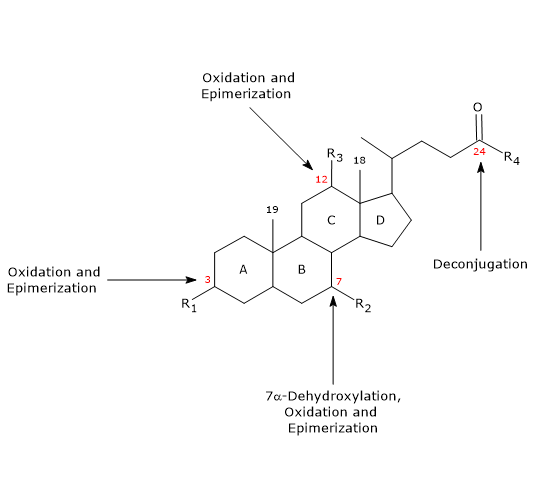
Certains des acides biliaires secondaires sont ensuite réabsorbés du côlon et retournent au foie. Dans les hépatocytes, ils sont reconjugués, si nécessaire, et resécrétés. Ceux qui ne sont pas réabsorbés, sont excrétés dans les fèces.
Alors que les oxydations et les déconjugaisons sont réalisées par un large spectre de bactéries anaérobies, la 7α-déhydroxylation est réalisée par un nombre limité d’anaérobies coliques.
Les 7α-déhydroxylations et les déconjugaisons augmentent le pKa des acides biliaires, et donc leur hydrophobie, permettant un certain degré d’absorption passive à travers la paroi colique.
L’augmentation de l’hydrophobie est également associée à une augmentation de la toxicité de ces molécules. Et une concentration élevée d’acides biliaires secondaires dans la bile, le sang et les fèces a été associée à la pathogenèse du cancer du côlon.
Fibres solubles et réabsorption des sels biliaires
La réabsorption des sels biliaires peut être réduite par l’action chélatrice des fibres solubles, comme celles que l’on trouve dans les fruits frais, les légumineuses, l’avoine et le son d’avoine, qui les lient, diminuant leur absorption. A son tour, cela augmente la synthèse de novo des acides biliaires, en régulant à la hausse l’expression de la 7α-hydroxylase et de la stérol 12α-hydroxylase (voir ci-dessous), et réduit ainsi la concentration de cholestérol hépatocytaire.
La déplétion du cholestérol hépatique augmente l’expression du récepteur LDL, et réduit ainsi la concentration plasmatique de cholestérol LDL. D’autre part, elle stimule la synthèse de l’HMG-CoA réductase, l’enzyme clé de la biosynthèse du cholestérol.
Note : Certains médicaments anti-cholestérol agissent en fixant les acides biliaires dans l’intestin, empêchant ainsi leur réabsorption.
Synthèse des acides biliaires primaires
Quantitativement, les acides biliaires sont le produit majeur du métabolisme du cholestérol.
Comme dit précédemment, la circulation entéro-hépatique et leur synthèse de novo maintiennent une taille constante du pool d’acides biliaires. En particulier, la synthèse de novo permet le remplacement des sels biliaires excrétés dans les visages, environ 5-10% du pool corporel, soit ~ 0,5 g/jour.
Ci-après, la synthèse de l’acide cholique et de l’acide chénodésoxycholique, ainsi que leur conjugaison avec les acides aminés taurine et glycine, est décrite.
Il existe deux voies principales de synthèse des acides biliaires : la voie classique et la voie alternative. En outre, certaines autres voies mineures seront également décrites.
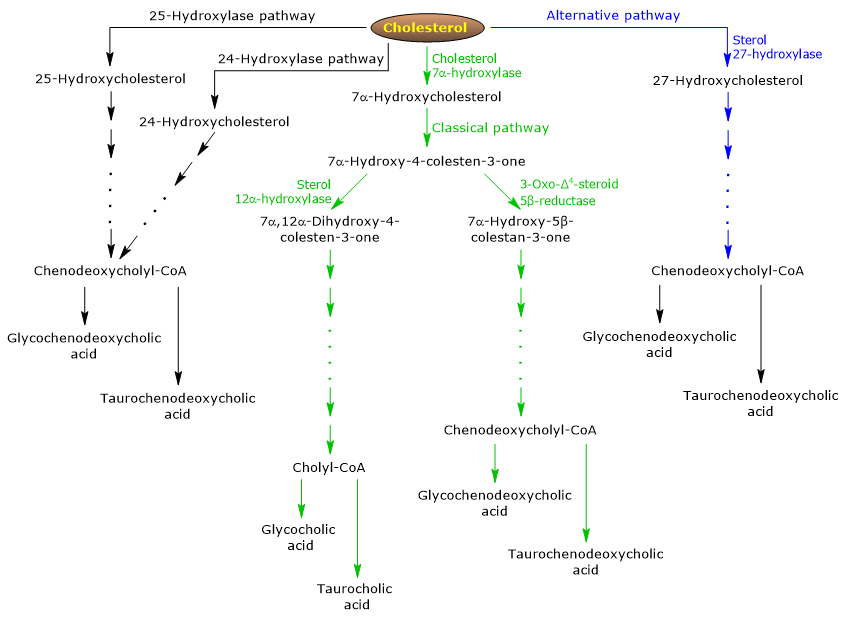
La voie classique ou neutre
Chez l’homme, jusqu’à 90% des sels biliaires sont produits par la voie classique (voir fig. 5), également appelée voie « neutre » puisque les intermédiaires sont des molécules neutres.
C’est une voie métabolique présente uniquement dans le foie, qui consiste en des réactions catalysées par des enzymes localisées dans le cytosol, le réticulum endoplasmique, les peroxysomes et les mitochondries, et dont les produits finaux sont les conjugués de l’acide cholique et de l’acide chénodésoxycholique.
- La première réaction est l’hydroxylation en position 7 du cholestérol, pour former le 7α-hydroxycholestérol. Cette réaction est catalysée par la cholestérol 7α-hydroxylase ou CYP7A1 (C.E. 1.14.14.23). Il s’agit d’une enzyme localisée dans le réticulum endoplasmique, qui catalyse l’étape limitant le taux de la voie.
Cholestérol + NADPH + H+ + O2 → 7α-Hydroxycholestérol + NADP+ + H2O
- Le 7α-Hydroxycholestérol subit une oxydation du groupe 3β-hydroxyle et le déplacement de la double liaison de la position 5,6 à la position 4,5, pour former la 7α-hydroxy-4-cholesten-3-one. La réaction est catalysée par la 3β-hydroxy-Δ5-C27-stéroïde oxydoréductase ou HSD3B7 (E.C. 1.1.1.181), une enzyme localisée dans le réticulum endoplasmique.
- La 7α-Hydroxy-4-cholesten-3-one peut suivre deux voies :
pour entrer dans la voie qui conduit à la synthèse de l’acide cholique, par la réaction catalysée par la 7α-hydroxy-4-cholesten-3-one 12α-monooxygénase ou stérol 12α-hydroxylase ou CYP8B1 (E.C. 1.14.18.8), une enzyme localisée dans le réticulum endoplasmique;
pour entrer dans la voie qui conduit à la synthèse de l’acide chénodésoxycholique, par la réaction catalysée par la 3-oxo-Δ4-stéroïde 5β-réductase ou AKR1D1 (E.C. 1.3.1.3), une enzyme cytosolique.
Il convient de souligner que l’activité de la stérol 12α-hydroxylase détermine le rapport entre l’acide cholique et l’acide chénodésoxycholique et, finalement, la capacité détergente du pool d’acides biliaires. Et en fait, la régulation de la transcription du gène de la stérol 12α-hydroxylase est l’une des principales étapes de régulation de la voie classique.
Par conséquent, si la 7α-hydroxy-4-cholesten-3-one procède par la réaction catalysée par la stérol 12α-hydroxylase, les réactions suivantes se produiront .
- La 7α-hydroxy-4-cholestène-3-one est hydroxylée en position 12 par la stérol 12α-hydroxylase, pour former la 7α,12α-dihydroxy-4-cholestène-3-one.
- La 7α,12α-dihydroxy-4-cholesten-3-one subit une réduction de la double liaison en position 4,5, dans la réaction catalysée par la 3-oxo-Δ4-stéroïde 5β-réductase, pour former la 5β-cholestan-7α,12α-diol-3-one.
- 5β-Cholestan-7α,12α-diol-3-one subit une réduction du groupe hydroxyle en position 4, dans la réaction catalysée par la 3α-hydroxystéroïde déshydrogénase ou AKR1C4 (EC 1.1.1.213), une enzyme cytosolique, pour former le 5β-cholestan-3α,7α,12α-triol.
- 5β-Cholestan-3α,7α,12α-triol subit une oxydation de la chaîne latérale via trois réactions catalysées par la stérol 27-hydroxylase ou CYP27A1 (EC 1.14.15.15). Il s’agit d’une enzyme mitochondriale également présente dans les tissus extrahépatiques et les macrophages, qui introduit un groupe hydroxyle en position 27. Le groupe hydroxyle est oxydé en aldéhyde, puis en acide carboxylique, pour former l’acide 3α,7α,12α-trihydroxy-5β-cholestanoïque.
- L’acide 3α,7α,12α-trihydroxy-5β-cholestanoïque est activé en son ester coenzyme A, le 3α,7α,12α-trihydroxy-5β-cholestanoyl-CoA, dans la réaction catalysée soit par l’acyl-CoA synthétase à très longue chaîne ou VLCS (EC 6.2.1.-), soit la bile acid CoA synthetase ou BACS (EC 6.2.1.7), toutes deux localisées dans le réticulum endoplasmique.
- 3α,7α,12α-Trihydroxy-5β-cholestanoyl-CoA est transporté vers les peroxysomes où il subit cinq réactions successives, chacune catalysée par une enzyme différente. Dans les deux dernières réactions, la chaîne latérale est raccourcie à quatre atomes de carbone, et finalement le cholylCoA est formé.
- Dans la dernière étape, la conjugaison, via une liaison amide, du groupe acide carboxylique de la chaîne latérale avec l’acide aminé glycine ou taurine se produit. La réaction est catalysée par la N-acyltransférase acide biliaire-CoA:acide aminé ou la BAAT (EC 2.3.1.65), qui est principalement localisée dans les peroxysomes.
Les produits de la réaction sont donc les acides biliaires conjugués : acide glycocholique et acide taurocholique.
Si la 7α-hydroxy-4-cholesten-3-one ne passe pas par la réaction catalysée par la stérol 12α-hydroxylase, elle entre dans la voie qui conduit à la synthèse des conjugués de l’acide chénodésoxycholique, par les réactions décrites ci-dessous.
- 7α-Hydroxy-4-cholesten-3-one est converti en 7α-hydroxy-5β-cholestan-3-one dans la réaction catalysée par la 3-oxo-Δ4-stéroïde 5β-réductase.
- 7α-Hydroxy-5β-cholestan-3-one est converti en 5β-cholestan-3α,7α-diol dans la réaction catalysée par la 3α-hydroxystéroïde déshydrogénase.
Puis, les acides biliaires conjugués acide glycochénodésoxycholique et acide taurochénodésoxycholique sont formés par des modifications similaires à celles observées pour la conjugaison de l’acide cholique, et catalysées majoritairement par les mêmes enzymes.
Note : Les acides biliaires non conjugués formés dans l’intestin doivent atteindre le foie pour être reconjugués.
La voie alternative ou acide
Elle est prévalente chez le fœtus et le nouveau-né, alors que chez l’adulte elle conduit à la synthèse de moins de 10% des sels biliaires.
Cette voie (voir fig. 5) diffère de la voie classique en ce que :
- les produits intermédiaires sont des molécules acides, d’où le nom alternatif de « voie acide » ;
- l’oxydation de la chaîne latérale est suivie de modifications du noyau stéroïdien, et non l’inverse ;
- les produits finaux sont des conjugués de l’acide chénodésoxycholique.
La première étape implique la conversion du cholestérol en 27-hydroxycholestérol dans la réaction catalysée par la stérol 27-hydroxylase.
Le 27-hydroxycholestérol peut suivre deux voies .
Route A
- Le 27-hydroxycholestérol est converti en acide 3β-hydroxy-5-cholesténoïque dans une réaction catalysée par la stérol 27-hydroxylase.
- L’acide 3β-hydroxy-5-cholesténoïque est hydroxylé en position 7 dans la réaction catalysée par l’oxysterol 7α-hydroxylase ou CYP7B1 (EC 1.14.13.100), une enzyme localisée dans le réticulum endoplasmique, pour former l’acide 3β-7α-dihydroxy-5-colesténoïque.
- L’acide 3β-7α-dihydroxy-5-cholesténoïque est converti en acide 3-oxo-7α-hydroxy-4-cholesténoïque, dans la réaction catalysée par la 3β-hydroxy-Δ5-C27-stéroïde oxydoréductase.
- L’acide 3-Oxo-7α-hydroxy-4-cholesténoïque, à la suite de modifications de la chaîne latérale, forme l’acide chénodésoxycholique, puis ses conjugués.
Route B
- 27-L’hydroxycholestérol est converti en 7α,27-dihydroxycholestérol dans la réaction catalysée par l’oxysterol 7α-hydroxylase et la cholestérol 7α-hydroxylase.
- Le 7α,27-dihydroxycholestérol est converti en 7α,26-dihydroxy-4-cholestène-3-one dans la réaction catalysée par la 3β-hydroxy-Δ5-C27-stéroïde oxydoréductase ;
La 7α, 26-dihydroxy-4-cholestène-3-one peut être transformée directement en conjugués de l’acide chénodésoxycholique, ou peut être convertie en acide 3-oxo-7α-hydroxy-4-colesténoïque, puis subir des modifications de la chaîne latérale et d’autres réactions qui conduisent à la synthèse des conjugués de l’acide chénodésoxycholique.
Voies mineures
Il existe également des voies mineures (voir fig. 5) qui contribuent à la synthèse des sels biliaires, mais dans une moindre mesure que les voies classiques et alternatives.
Par exemple :
- Une cholestérol 25-hydroxylase (EC 1.14.99.38) est exprimée dans le foie.
- Une cholestérol 24-hydroxylase ou CYP46A1 (EC 1.14.14.25) est exprimée dans le cerveau, et donc, bien que cet organe ne puisse pas exporter le cholestérol, il exporte les oxystérols.
- Une 7α-hydroxylase non spécifique a également été découverte. Elle est exprimée dans tous les tissus et semble être impliquée dans la génération d’oxystérols, qui peuvent être transportés vers les hépatocytes pour être convertis en acide chénodésoxycholique.
De plus, la stérol 27-hydroxylase est exprimée dans divers tissus, et donc ses produits de réaction doivent être transportés vers le foie pour être convertis en sels biliaires.
Sels biliaires : régulation de la synthèse
La régulation de la synthèse des acides biliaires se fait par un mécanisme de rétroaction négative, notamment sur l’expression de la cholestérol 7α-hydroxylase et de la stérol 12α-hydroxylase.
Lorsqu’un excès d’acides biliaires, libres et conjugués, se produit, ces molécules se lient au récepteur nucléaire farnesoid X receptor ou FRX, l’activant : l’acide biliaire le plus efficace est l’acide chénodésoxycholique, alors que d’autres, comme l’acide ursodésoxycholique, ne l’activent pas.
Le FRX induit l’expression du répresseur transcriptionnel small heterodimer partner ou SHP, qui interagit à son tour avec d’autres facteurs de transcription, comme le liver receptor homolog-1 ou LRH-1, et le hepatocyte nuclear factor-4α ou HNF-4α. Ces facteurs de transcription se lient à une séquence dans la région promotrice des gènes de la 7α-hydroxylase et de la 12α-hydroxylase, région appelée éléments de réponse aux acides biliaires ou BARE, inhibant leur transcription.
L’une des raisons pour lesquelles la synthèse des sels biliaires est étroitement régulée est que beaucoup de leurs métabolites sont toxiques.
Chiang J.Y.L. Acides biliaires : régulation de la synthèse. J Lipid Res 2009;50(10):1955-66. doi:10.1194/jlr.R900010-JLR200
Gropper S.S., Smith J.L. Advanced nutrition and human metabolism. 6h Edition. Cengage Learning, 2012
Moghimipour E., Ameri A., et Handali S. Absorption-enhancing effects of bile salts. Molecules 2015;20(8) ; 14451-73. doi:10.3390/molecules200814451
Monte M.J., Marin J.J.G., Antelo A., Vazquez-Tato J. Acides biliaires : chimie, physiologie et physiopathologie. World J Gastroenterol 2009;15(7):804-16. doi:10.3748/wjg.15.804
Rawn J.D. Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990
Rosenthal M.D., Glew R.H. Biochimie médicale – Le métabolisme humain dans la santé et la maladie. John Wiley J. & Sons, Inc, Publication, 2009
Sundaram S.S., Bove K.E., Lovell M.A. et Sokol R.J. Mécanismes de la maladie : erreurs innées de synthèse des acides biliaires. Nat Clin Pract Gastroenterol Hepatol 2008;5(8):456-68. doi:10.1038/ncpgasthep1179
.