L’élément chimique chlore est classé parmi les halogènes et les non-métaux. Il a été découvert en 1774 par Carl Wilhelm Scheele.

Zone de données
| Classification : | Le chlore est un halogène et un non-métal |
| Couleur: | jaune verdâtre |
| Poids atomique: | 35.453 |
| Etat: | gazeux |
| Point de fusion: | -101 oC , 172 K |
| Point d’ébullition : | -34 oC , 239 K |
| Électrons: | 17 |
| Protons : | 17 |
| Neutrons dans l’isotope le plus abondant: | 18 |
| Electrons : | 2,8,7 |
| Configuration des électrons : | 1s2 2s2 2p6 3s2 3p5 |
| Densité à 20oC : | 0.003214 g/cm3 |
Afficher plus, y compris : Chaleur, énergies, oxydation, réactions,
composés, rayons, conductivités
| Volume atomique: | 22,7 cm3/mol | ||
| Structure: | couches de Cl2 dans un solide | ||
| Dureté : | |||
| Capacité thermique spécifique | 0,48 J g-1 K-1 | ||
| Chaleur de fusion | 6.406 kJ mol-1 de Cl2 | ||
| Chaleur d’atomisation | 122 kJ mol-1 | ||
| Chaleur de vaporisation | 20.41 kJ mol-1 de Cl2 | ||
| 1ère énergie d’ionisation | 1251.1 kJ mol-1 | ||
| 2ème énergie d’ionisation | 2297.3 kJ mol-1 | ||
| 3ème énergie d’ionisation | 3821.8 kJ mol-1 | ||
| Affinité électronique | 349 kJ mol-1 | ||
| Nombre d’oxydation minimal | -1 | ||
| Min. d’oxydation commune | -1 | ||
| Nombre maximal d’oxydation | 7 | ||
| Nombre maximal d’oxydation commune | . | 7 | |
| Electronégativité (échelle de Pauling) | 3,16 | ||
| Volume de polarisabilité | 2.2 Å3 | ||
| Réaction avec l’air | aucune | ||
| Réaction avec 15 M HNO3 | doux, ⇒ HClOx, NOxCl, NOx | ||
| Réaction avec 6 M HCl | doux, ⇒ HOCl, Cl- | ||
| Réaction avec 6 M NaOH | douce, ⇒ OCl-, Cl- | ||
| Oxyde(s) | Cl2O, ClO2, Cl2O7 | ||
| Hydrure(s) | HCl | ||
| Chlorure(s) | Cl2 | ||
| Rayon atomique | 100 pm | ||
| Rayon ionique (ion 1+) | |||
| . ionique (ion 1+) | – | ||
| Rayon ionique (ion 2+) | – | ||
| Rayon ionique (ion 3+) | – | ||
| Rayon ionique (ion 1- ion) | 167 pm | ||
| Rayon ionique (2- ion) | – | ||
| Rayon ionique (3- ion) | – | ||
| Conductivité thermique | 0.0089 W m-1 K-1 | ||
| Conductivité électrique | – | ||
| Point de congélation/fusion : | -101 oC , 172 K |

Chlore dans une éprouvette (Photo : Ben Mills)
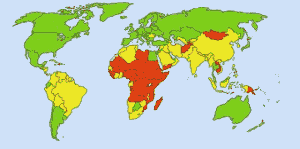
Eau potable sûre : Image : Ionut_Cojocaru. Dans les zones vertes, tout le monde peut avoir de l’eau potable. Dans les zones rouges, au moins 25 % des personnes ne peuvent pas obtenir d’eau traitée. Les zones jaunes sont intermédiaires. Avant l’utilisation systématique du chlore dans les approvisionnements en eau aux États-Unis, la fièvre typhoïde faisait 25 000 morts par an. Aujourd’hui, 98 % des approvisionnements publics en eau sont traités au chlore ou à un composé chloré. La fièvre typhoïde fait désormais environ une victime par an, en moyenne. (4)

Carl Wilhelm Scheele, qui a découvert le chlore en 1774.
Découverte du chlore
Le chlore a été produit pour la première fois en 1774 par Carl Wilhelm Scheele en Suède. Scheele a recueilli le gaz libéré par la réaction de la pyrolusite avec spiritus salis – un terme alchimique signifiant esprit/souffle de sel. Le nouveau gaz avait, selon Scheele, « une odeur suffocante très perceptible, qui était des plus oppressantes pour les poumons… et donne à l’eau un goût légèrement acide… l’air qu’elle contient acquiert une couleur jaune… » (1)
Scheele a également noté la grande réactivité et les qualités de blanchiment du nouveau gaz qu’il avait fabriqué : « … tous les métaux ont été attaqués… l’alcali fixe a été transformé en sel commun… toutes les fleurs végétales – rouges, bleues et jaunes – sont devenues blanches en peu de temps ; la même chose s’est produite aussi avec les plantes vertes… les insectes sont immédiatement morts… ». (1)
Malgré l’exactitude de ses observations, Scheele pensait à tort que le nouveau gaz était une forme déphlostiganisée de l’acide muriatique.
Le célèbre chimiste français Antoine Lavoisier pensait que le nouveau gaz devait être appelé acide oxymuriatique d’après l’élément murium non encore découvert. (2)
* La confusion sur la véritable identité du chlore a été causée par la théorie du phlogiston ; le phlogiston avait été accepté par les chimistes pendant la majeure partie des années 1700 – jusqu’à ce que Lavoisier lui-même le démystifie. Le phlogiston était une « substance » utilisée pour expliquer ce qui était alors inexplicable. De manière pratique, il avait un poids négatif quand il le fallait et » expliquait » des réactions telles que la rouille et la combustion.
Lavoisier a été l’architecte de la chute du phlogiston, en montrant que la chimie de l’oxygène était une meilleure explication dans les réactions chimiques que le phlogiston. (3)
En 1810, le consensus scientifique était que l’élément que nous appelons maintenant chlore était en fait un composé qui contenait de l’oxygène. Le chimiste anglais Sir Humphry Davy a constaté que le consensus était erroné ; il n’a pas pu faire réagir le nouveau gaz jaune-vert avec une électrode en charbon, ce qui lui a fait croire qu’il ne pouvait pas contenir d’oxygène. Dans des réactions avec du phosphore et de l’ammoniac, il a démontré que le nouveau gaz ne contenait pas d’oxygène. Il a utilisé une énorme pile voltaïque de 2000 plaques pour voir s’il pouvait extraire l’oxygène des composés de phosphore et de soufre du gaz, mais là encore, il n’a trouvé aucun oxygène. (1a)
En 1811, Davy a conclu que le nouveau gaz était en fait un nouvel élément. (1b) Il le nomma chlore, du mot grec « chloros », qui signifie vert pâle ou jaune-vert.
Faits intéressants sur le chlore
- La première réaction en chaîne découverte n’était pas une réaction nucléaire ; c’était une réaction en chaîne chimique. Elle a été découverte en 1913 par Max Bodenstein, qui a vu un mélange de gaz de chlore et d’hydrogène exploser lorsqu’il était déclenché par la lumière. Le mécanisme de la réaction en chaîne a été entièrement expliqué en 1918 par Walther Nernst.
- Les océans de la Terre contiennent une grande quantité de chlore. Si ce chlore était libéré sous forme de gaz, son poids serait 5x plus important que l’atmosphère totale actuelle de la Terre. (Nos océans contiennent environ 2,6 x 1016 tonnes métriques de chlore, principalement sous forme de chlorure de sodium.)
- Le chlore n’est pas seulement abondant dans nos océans ; il est le sixième élément le plus abondant dans la croûte terrestre.
- L’exposition à de petites quantités de chlore, même pendant une courte période, peut être mortelle. Des décès sont attendus à 1 partie sur mille de chlore dans l’air (ou parfois à des concentrations encore plus faibles). (5)
- Le chlore est plus lourd que l’air. Lorsqu’il est libéré, il forme une nappe toxique qui dérive avec le vent. Le chlore a été utilisé comme arme chimique pendant la Première Guerre mondiale, d’abord en 1915 par l’armée allemande, puis par les Alliés occidentaux. Cette arme n’a pas été aussi « efficace » qu’on l’avait espéré, car le chlore est facilement détecté par son odeur forte. Il est également soluble dans l’eau, et les soldats pouvaient donc se protéger des pires de ses effets en respirant à travers des vêtements humides.

Apparence et caractéristiques
Effets nocifs :
Le chlore est un gaz toxique qui irrite la peau, les yeux et le système respiratoire.
Caractéristiques :
Le chlore est un gaz jaune verdâtre, diatomique, dense, à l’odeur forte (odeur d’eau de Javel).
Il ne se trouve pas à l’état libre dans la nature car il se combine facilement avec presque tous les autres éléments.
Le chlore est présent dans la nature principalement sous forme de sel commun (NaCl), de carnallite , et de sylvite (KCl).
Sous sa forme liquide et solide, c’est un puissant agent de blanchiment, d’oxydation et de désinfection.
Utilisations du chlore
Le chlore est utilisé pour produire de l’eau potable sûre.
Les composés chlorés sont surtout utilisés pour l’assainissement, le blanchiment de la pâte à papier, les désinfectants et le traitement des textiles.
Le chlore est également utilisé pour la fabrication de chlorates et il est important en chimie organique, formant des composés tels que le chloroforme, le tétrachlorure de carbone, le chlorure de polyvinyle et le caoutchouc synthétique.
Les autres utilisations des composés chlorés comprennent les colorants, les produits pétroliers, les médicaments, les antiseptiques, les insecticides, les produits alimentaires, les solvants, les peintures et les plastiques.
Abondance et isotopes
Abondance croûte terrestre : 145 parties par million en poids, 85 parties par million en moles
Abondance système solaire : 8 parties par million en poids, 0,3 partie par million en moles
Coût, pur : 0,15 $ par 100g
Coût, en vrac : $ par 100g
Source : Le chlore gazeux est produit commercialement par l’électrolyse du chlorure de sodium (NaCl) de l’eau de mer ou de la saumure des mines de sel.
Isotopes : Le chlore possède 16 isotopes dont les demi-vies sont connues, avec des numéros de masse de 31 à 46. Le chlore naturel est un mélange de ses deux isotopes stables 35Cl et 37Cl avec des abondances naturelles de 75,8% et 24,3% respectivement.

- Henry M. Leicester, Herbert S. Klickstein, A Source Book in Chemistry, 1400-1900., (1969) Harvard University Press. p111 ; 1a. p241. ; 1b. p257.
- J.W. Mellor, A Comprehensive Treatise on Inorganic and Theoretical Chemistry., 1922, vol 2, Longmans, Green and Co., p21.
- Antoine Lavoisier, Mémoires de l’ Academie royale des sciences 1783., 1786, p505-538.
- L’arbre à chlore.
- OSHA, directive sur la sécurité et la santé au travail pour le chlore.
Citer cette page
Pour un lien en ligne, veuillez copier et coller l’un des éléments suivants:
<a href="https://www.chemicool.com/elements/chlorine.html">Chlorine</a>
ou
<a href="https://www.chemicool.com/elements/chlorine.html">Chlorine Element Facts</a>
Pour citer cette page dans un document académique, veuillez utiliser la citation conforme à la norme MLA suivante:
"Chlorine." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/chlorine.html>.
.