L’élément chimique cobalt est classé parmi les métaux de transition. Il a été découvert en 1735 par George Brandt.

Zone de données
| Classification : | Le cobalt est un métal de transition |
| Couleur: | blanc bleuté |
| Poids atomique: | 58.9332 |
| Etat: | solide |
| Point de fusion: | 1495 oC, 1768 K |
| Point d’ébullition : | 2930 oC, 3203 K |
| Electrons: | 27 |
| Protons : | 27 |
| Neutrons dans l’isotope le plus abondant: | 32 |
| Electrons : | 2,8,15,2 |
| Configuration électronique: | 3d7 4s2 |
| Densité à 20oC: | 8.90 g/cm3 |
Afficher plus : Chaleur, énergies, oxydation, réactions,
Composés, rayons, conductivités
| Volume atomique: | 6.7 cm3/mol |
| Structure: | hcp : hexagonal fermé pkd |
| Dureté: | 5,0 mohs |
| Capacité thermique spécifique | 0.42 J g-1 K-1 |
| Chaleur de fusion | 16,190 kJ mol-1 |
| Chaleur d’atomisation | 426 kJ mol-1 |
| Chaleur de vaporisation | 373.3 kJ mol-1 |
| Energie de première ionisation | 758.4 kJ mol-1 |
| 2ème énergie d’ionisation | 1646 kJ mol-1 |
| 3ème énergie d’ionisation | 3232.2 kJ mol-1 |
| Affinité électronique | 63,8 kJ mol-1 |
| Nombre d’oxydation minimal | -1 |
| Nombre d’oxydation minimal commun. | 0 |
| Nombre maximal d’oxydation | 5 |
| Nombre maximal d’oxydation commune | 3 |
| Electronégativité (échelle de Pauling) | 1.88 |
| Volume de polarisabilité | 7,5 Å3 |
| Réaction avec l’air | légère, w/ht ? Co3O4 |
| Réaction avec 15 M HNO3 | vigoureux, ? Co(NO3)2, NOx |
| Réaction avec 6 M HCl | doux, ? H2, CoCl2 |
| Réaction avec NaOH 6 M | – |
| Oxyde(s) | CoO, Co3O4 |
| Hydrure(s) | Non |
| Chlorure(s) | CoCl2 |
| Atomique rayon | 135 pm |
| Rayon ionique (ion 1+) | – |
| Rayon ionique (ion 2+) | 83.8 pm |
| Rayon ionique (ion 3+) | 71.8 pm |
| Rayon ionique (1 ion) | – |
| Rayon ionique (2 ion) | – |
| Rayon ionique (3 ion) | – |
| . ion) | – |
| Conductivité thermique | 100 W m-1 K-1 |
| Conductivité électrique | 17.9 x 106 S m-1 |
| Point de congélation/fusion: | 1495 oC, 1768 K |
Découverte du cobalt
Depuis l’Antiquité, les composés du cobalt ont été utilisés pour produire du verre bleu et des céramiques.
L’élément a été isolé pour la première fois par le chimiste suédois George Brandt en 1735. Il a montré que c’était la présence de l’élément cobalt qui provoquait la couleur bleue du verre, et non le bismuth comme on le pensait auparavant.
Vers 1741, il écrivait : « De même qu’il y a six sortes de métaux, j’ai également démontré par des expériences fiables… qu’il y a aussi six sortes de demi-métaux : un nouveau demi-métal, à savoir le cobalt regulus en plus du mercure, du bismuth, du zinc, et des regulus d’antimoine et d’arsenic. »
Le mot cobalt est dérivé de l’allemand « kobold », qui signifie lutin ou elfe. L’image du cobalt ci-dessous est de Ben Mills.


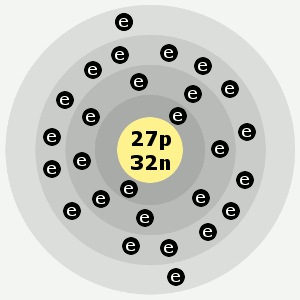
Les enveloppes électroniques du cobalt
Apparence et caractéristiques
Effets nocifs:
Le cobalt et ses composés sont considérés comme légèrement toxiques par contact cutané et modérément toxiques par ingestion.
Caractéristiques:
Le cobalt est un métal blanc bleuté, lustré, dur et cassant. Il est ferromagnétique.
Le métal est actif chimiquement, formant de nombreux composés. Le cobalt reste magnétique jusqu’à la température la plus élevée de tous les éléments magnétiques (il a un point de Curie de 1121oC).
Utilisations du cobalt
Le cobalt est utilisé dans les alliages pour les pièces de moteurs d’avion et dans les alliages à usage résistant à la corrosion et à l’usure.
Le cobalt est largement utilisé dans les batteries et en galvanoplastie.
Les sels de cobalt sont utilisés pour donner des couleurs bleues et vertes au verre et aux céramiques.
Le 60Co radioactif est utilisé dans le traitement du cancer.
Le cobalt est essentiel à de nombreux êtres vivants et est un composant de la vitamine B12.
Le cobalt est également utilisé dans les aimants permanents en samarium-cobalt. Ceux-ci sont utilisés dans les micros de guitare et les moteurs à haute vitesse.
Abondance et isotopes
Abondance croûte terrestre : 25 parties par million en poids, 8 parties par million en moles
Abondance système solaire : 4 parties par million en poids, 0,7 partie par million en moles
Coût, pur : 21 $ par 100g
Coût, en vrac : 4,40 $ par 100g
Source : Le cobalt ne se trouve pas en tant qu’élément libre dans la nature. On le trouve dans les minerais. Les principaux minerais de cobalt sont la cobaltite (CoAsS), l’érythrite (arséniate hydraté de cobalt), le glaucodot (Co,Fe)AsS, et la skutterudite (Co,Ni)As3. Le cobalt est généralement produit comme sous-produit de l’extraction du nickel et du cuivre.
Isotopes : Le cobalt possède 22 isotopes dont les demi-vies sont connues, avec des numéros de masse de 50 à 72. Le cobalt naturel est constitué de son seul isotope stable, le 59Co.

- Edward Smedley, Hugh James Rose, Henry John Rose, Encyclopaedia Metropolitana ; ou Dictionnaire universel des connaissances…, 1845, Volume 4, p693 William Clowes and Sons.
Citer cette page
Citer cette page
Pour un lien en ligne, veuillez copier et coller l’un des éléments suivants:
<a href="https://www.chemicool.com/elements/cobalt.html">Cobalt</a>
ou
<a href="https://www.chemicool.com/elements/cobalt.html">Cobalt Element Facts</a>
Pour citer cette page dans un document académique, veuillez utiliser la citation conforme à la norme MLA suivante:
"Cobalt." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/cobalt.html>.
.