Nom générique : fer dextran
Formation posologique : injection
Médicament examiné par Drugs.com. Dernière mise à jour le 1 décembre 2019.
- Aperçu
- Effets secondaires
- Dosage
- Professionnel
- Interactions
- Plus
Des réactions de type anaphylactique, y compris des décès, ont suivi l’administration parentérale de fer dextran injectable.
- Disposer d’un équipement de réanimation et d’un personnel formé à la détection et au traitement des réactions de type anaphylactique à portée de main pendant l’administration d’Infed®.
- Administrer une dose test d’Infed® avant la première dose thérapeutique. Si aucun signe ou symptôme de réaction de type anaphylactique ne suit la dose test, administrer la dose thérapeutique complète d’Infed®.
- Pendant toutes les administrations d’Infed®, observer les signes ou symptômes de réactions de type anaphylactique. Des réactions fatales ont suivi la dose test d’injection de fer dextran. Des réactions fatales sont également survenues dans des situations où la dose d’essai était tolérée.
- Utiliser Infed® uniquement chez les patients chez qui les examens cliniques et de laboratoire ont établi un état de carence en fer non accessible à un traitement oral par le fer.
- Les patients ayant des antécédents d’allergie médicamenteuse ou de multiples allergies médicamenteuses peuvent présenter un risque accru de réactions de type anaphylactique à Infed®.
- DESCRIPTION:
- PHARMACOLOGIE CLINIQUE:
- INDICATIONS ET USAGE:
- CONTRAINDICATIONS:
- MISES EN GARDE:
- PRECAUTIONS:
- REACTIONS INDÉSIRABLES:
- Surdosage:
- DOSAGE ET ADMINISTRATION:
- COMMENT FOURNIR :
- Étiquette type
- Plus d’informations sur Infed (fer dextran)
- Ressources pour les consommateurs
- Ressources pour les professionnels
- Guides thérapeutiques associés
DESCRIPTION:
Infed (fer dextran injectable USP) est un complexe liquide stérile brun foncé, légèrement visqueux d’hydroxyde ferrique et de dextran pour une utilisation intraveineuse ou intramusculaire.
Chaque mL contient l’équivalent de 50 mg de fer élémentaire (sous forme de complexe fer dextran), environ 0,9 % de chlorure de sodium, dans de l’eau pour injection. De l’hydroxyde de sodium et/ou de l’acide chlorhydrique peuvent avoir été utilisés pour ajuster le pH. Le pH de la solution est compris entre 4,5 et 7,0.
Classe thérapeutique : Hématinique
PHARMACOLOGIE CLINIQUE:
Généralités : Après une injection intramusculaire, le fer dextran est absorbé à partir du site d’injection dans les capillaires et le système lymphatique. Le fer dextran circulant est éliminé du plasma par les cellules du système réticulo-endothélial, qui divisent le complexe en ses composants de fer et dextran. Le fer est immédiatement lié aux fractions protéiques disponibles pour former l’hémosidérine ou la ferritine, les formes physiologiques du fer, ou dans une moindre mesure la transferrine. Ce fer qui est soumis à un contrôle physiologique reconstitue l’hémoglobine et les réserves de fer épuisées.
Le dextrane, un polyglucose, est soit métabolisé, soit excrété. Des quantités négligeables de fer sont perdues par les voies urinaire ou alimentaire après l’administration de fer dextran.
La majeure partie des injections intramusculaires de fer dextran est absorbée dans les 72 heures ; la majeure partie du fer restant est absorbée au cours des 3 à 4 semaines suivantes.
Diverses études portant sur le fer dextran 59Fe administré par voie intraveineuse à des sujets déficients en fer, dont certains avaient des maladies coexistantes, ont donné des valeurs de demi-vie allant de 5 heures à plus de 20 heures. La valeur de 5 heures a été déterminée pour le fer dextran 59Fe à partir d’une étude qui a utilisé des méthodes de laboratoire pour séparer le fer dextran 59Fe circulant du 59Fe lié à la transferrine. La valeur de 20 heures reflète une demi-vie déterminée en mesurant le 59Fe total, à la fois circulant et lié. Il faut comprendre que ces valeurs de demi-vie ne représentent pas la clairance du fer de l’organisme. Le fer n’est pas facilement éliminé du corps et l’accumulation de fer peut être toxique.
Des études in vitro ont montré que l’élimination du fer dextran par dialyse est négligeable.1,2 Six membranes de dialyseur différentes ont été étudiées (polysulfone, cuprophane, acétate de cellulose, triacétate de cellulose, polyméthylméthacrylate et polyacrylonitrile), y compris celles considérées comme à haute efficacité et à haut flux.
INDICATIONS ET USAGE:
Les injections intraveineuses ou intramusculaires d’Infed sont indiquées pour le traitement des patients présentant une carence en fer documentée chez qui l’administration orale est insatisfaisante ou impossible.
CONTRAINDICATIONS:
Hypersensibilité au produit. Toutes les anémies non associées à une carence en fer.
MISES EN GARDE:
Risque de réactions de type anaphylactique : Des réactions de type anaphylactique, y compris des décès, ont suivi l’administration parentérale de fer dextran. Toujours avoir à portée de main du matériel de réanimation et du personnel formé à la détection et au traitement des réactions de type anaphylactique pendant l’administration de Infed. Avant la première dose thérapeutique, administrer une dose test d’Infed de 0,5 mL. (Voir POSOLOGIE ET ADMINISTRATION.) Bien que les réactions soient généralement évidentes en quelques minutes, il faut observer les patients pendant au moins une heure avant d’administrer la dose thérapeutique. Pendant toutes les administrations de Infed, observez les patients pour déceler tout signe ou symptôme de réaction de type anaphylactique. Des réactions fatales ont suivi la dose d’essai de fer dextran et sont également survenues dans des situations où la dose d’essai était tolérée. N’utilisez Infed que chez les patients chez qui les examens cliniques et de laboratoire ont établi un état de carence en fer ne pouvant être traité par un traitement oral à base de fer.
Les facteurs qui affectent le risque de réactions de type anaphylactique aux produits à base de fer dextran ne sont pas entièrement connus, mais des données cliniques limitées suggèrent que le risque peut être augmenté chez les patients ayant des antécédents d’allergie médicamenteuse ou d’allergies médicamenteuses multiples. De plus, l’utilisation concomitante de médicaments inhibiteurs de l’enzyme de conversion de l’angiotensine peut augmenter le risque de réactions à un produit à base de fer dextran. L’étendue du risque de réactions de type anaphylactique suite à l’exposition à un produit à base de fer dextran spécifique est inconnue et peut varier selon les produits.
Les produits à base de fer dextran diffèrent par leurs caractéristiques chimiques et peuvent différer par leurs effets cliniques. Les produits à base de fer dextran ne sont pas cliniquement interchangeables.
Réactions retardées : Les doses intraveineuses importantes, telles qu’utilisées avec les perfusions à dose totale (TDI), ont été associées à une incidence accrue d’effets indésirables. Les effets indésirables sont fréquemment des réactions retardées (1 à 2 jours) caractérisées par un ou plusieurs des symptômes suivants : arthralgie, mal de dos, frissons, vertiges, fièvre modérée à élevée, céphalées, malaise, myalgie, nausées et vomissements. L’apparition se produit habituellement 24 à 48 heures après l’administration et les symptômes disparaissent généralement en 3 à 4 jours. L’étiologie de ces réactions n’est pas connue. La possibilité d’une réaction retardée doit être prise en compte lors de l’estimation du risque/bénéfice du traitement.
La dose quotidienne maximale ne doit pas dépasser 2 ml de fer dextran non dilué.
Risque chez les patients présentant des affections sous-jacentes : Infed doit être utilisé avec une extrême prudence chez les patients présentant une altération grave de la fonction hépatique. Il ne doit pas être utilisé pendant la phase aiguë d’une maladie rénale infectieuse.
Les effets indésirables ressentis après l’administration d’Infed peuvent exacerber les complications cardiovasculaires chez les patients présentant une maladie cardiovasculaire préexistante.
Carcinogenèse : Un risque de cancérogenèse peut accompagner l’injection intramusculaire de complexes fer-hydrates de carbone. On a constaté que ces complexes, dans des conditions expérimentales, produisaient des sarcomes lorsque de fortes doses ou de petites doses injectées de façon répétée au même endroit étaient administrées à des rats, des souris et des lapins, et peut-être à des hamsters.
La longue période de latence entre l’injection d’un carcinogène potentiel et l’apparition d’une tumeur rend impossible une mesure précise du risque chez l’homme. Cependant, plusieurs rapports dans la littérature décrivent des tumeurs au point d’injection chez l’homme qui avait reçu auparavant des injections intramusculaires de complexes fer-hydrate de carbone.
PRECAUTIONS:
Généralités : Une thérapie injustifiée avec du fer parentéral entraînera un stockage excessif du fer avec la possibilité conséquente d’une hémosidérose exogène. Une telle surcharge en fer est particulièrement susceptible de se produire chez les patients atteints d’hémoglobinopathies et d’autres anémies réfractaires qui pourraient être diagnostiquées à tort comme des anémies ferriprives.
Infed doit être utilisé avec prudence chez les personnes ayant des antécédents d’allergies et/ou d’asthme importants. Des cas d’anaphylaxie et d’autres réactions d’hypersensibilité ont été rapportés après des doses d’essai sans incident ainsi que des doses thérapeutiques de fer dextran injectable. Par conséquent, administrez une dose test avant la première dose thérapeutique d’Infed. (Voir l’encadré MISES EN GARDE et POSOLOGIE ET ADMINISTRATION : ADMINISTRATION.)
L’épinéphrine doit être immédiatement disponible en cas de réactions d’hypersensibilité aiguës. (Dose habituelle pour adulte : 0,5 mL d’une solution 1:1000, par injection sous-cutanée ou intramusculaire). Remarque : Les patients utilisant des agents bêta-bloquants peuvent ne pas répondre adéquatement à l’épinéphrine. L’isoprotérénol ou des agents bêta-agonistes similaires peuvent être nécessaires chez ces patients.
Les patients atteints de polyarthrite rhumatoïde peuvent présenter une exacerbation aiguë de la douleur et du gonflement des articulations après l’administration d’Infed.
Des rapports dans la littérature provenant de pays autres que les États-Unis (en particulier, la Nouvelle-Zélande) ont suggéré que l’utilisation de fer dextran intramusculaire chez les nouveau-nés a été associée à une incidence accrue de septicémie gram-négative, principalement due à E. Coli.
Information pour les patients : Les patients doivent être informés des effets indésirables potentiels associés à l’utilisation d’Infed.
Interactions médicamenteuses/essais de laboratoire : On a signalé que de fortes doses de fer dextran (5 ml ou plus) donnaient une couleur brune au sérum d’un échantillon de sang prélevé 4 heures après l’administration.
Le médicament peut entraîner des valeurs faussement élevées de la bilirubine sérique et des valeurs faussement diminuées du calcium sérique. Les déterminations du fer sérique (en particulier par des tests colorimétriques) peuvent ne pas être significatives pendant 3 semaines après l’administration de fer dextran.
La ferritine sérique atteint un pic environ 7 à 9 jours après une dose intraveineuse d’Infed et revient lentement à la ligne de base après environ 3 semaines.
L’examen de la moelle osseuse pour les réserves de fer peut ne pas être significatif pendant des périodes prolongées après un traitement par fer dextran car du fer dextran résiduel peut rester dans les cellules réticuloendothéliales.
Les scintigraphies osseuses impliquant le 99m Tc-diphosphonate ont été rapportées pour montrer une zone d’activité dense et en croissant dans les fesses, suivant le contour de la crête iliaque, 1 à 6 jours après des injections intramusculaires de fer dextran.
Des scintigraphies osseuses avec des agents de recherche osseuse marqués au 99m Tc, en présence de taux élevés de ferritine sérique ou après des perfusions de fer dextran, ont été rapportées pour montrer une réduction de la captation osseuse, une activité rénale marquée et une accumulation excessive dans le pool sanguin et les tissus mous.
Carcinogenèse, mutagenèse, altération de la fertilité : Voir MISES EN GARDE.
Grossesse : Le fer dextran s’est révélé tératogène et embryocide chez les souris, les rats, les lapins, les chiens et les singes lorsqu’il est administré à des doses d’environ 3 fois la dose maximale humaine.
Aucun effet fœtal indésirable constant n’a été observé chez les souris, les rats, les lapins, les chiens et les singes à des doses de 50 mg de fer/kg ou moins. Une toxicité fœtale et maternelle a été rapportée chez les singes à une dose intraveineuse totale de 90 mg de fer/kg sur une période de 14 jours. Des effets similaires ont été observés chez les souris et les rats lors de l’administration d’une dose unique de 125 mg de fer/kg. Des anomalies fœtales chez les rats et les chiens ont été observées à des doses de 250 mg de fer/kg et plus. Les animaux utilisés dans ces tests n’étaient pas déficients en fer. Il n’existe pas d’études adéquates et bien contrôlées chez la femme enceinte. Infed ne doit être utilisé pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour le ftus.
Transfert placentaire : Diverses études animales et études chez l’homme enceinte ont démontré des résultats non concluants en ce qui concerne le transfert placentaire du fer dextran en tant que fer dextran. Il semble qu’une partie du fer atteigne le fœtus, mais la forme sous laquelle il traverse le placenta n’est pas claire.
Mères allaitantes : La prudence est de mise lorsque Infed est administré à une femme qui allaite. Des traces de fer dextran non métabolisé sont excrétées dans le lait maternel.
Utilisation pédiatrique : Utilisation non recommandée chez les nourrissons de moins de 4 mois. (Voir POSOLOGIE ET ADMINISTRATION.)
REACTIONS INDÉSIRABLES:
Sévères/mortelles : Des réactions anaphylactiques ont été signalées lors de l’utilisation du fer dextran injectable ; à l’occasion, ces réactions ont été mortelles. Ces réactions, qui surviennent le plus souvent dans les premières minutes suivant l’administration, ont été généralement caractérisées par l’apparition soudaine d’une difficulté respiratoire et/ou d’un collapsus cardiovasculaire. Étant donné que des réactions anaphylactiques mortelles ont été signalées après l’administration de fer dextran injectable, le médicament ne doit être administré que lorsque les techniques de réanimation et le traitement du choc anaphylactique et anaphylactoïde sont facilement accessibles. (Voir l’encadré MISES EN GARDE et PRÉCAUTIONS : GÉNÉRALES, relatives à la disponibilité immédiate de l’adrénaline).)
Cardiovasculaire : Douleurs thoraciques, oppression thoracique, choc, arrêt cardiaque, hypotension, hypertension, tachycardie, bradycardie, bouffées vasomotrices, arythmies. (Des bouffées vasomotrices et une hypotension peuvent survenir lors d’injections trop rapides par voie intraveineuse.)
Dermatologique : Urticaire, prurit, purpura, éruption cutanée, cyanose.
Gastro-intestinal : Douleurs abdominales, nausées, vomissements, diarrhée.
Hématologique/lymphatique : Leucocytose, lymphadénopathie.
Musculosquelettique/tissus mous : Arthralgie, arthrite (peut représenter une réactivation chez les patients atteints de polyarthrite rhumatoïde quiescente – Voir PRÉCAUTIONS : GÉNÉRALES), myalgie ; mal de dos ; abcès stérile, atrophie/fibrose (site d’injection intramusculaire) ; décoloration (coloration) brune de la peau et/ou des tissus sous-jacents, endolorissement ou douleur au niveau ou à proximité des sites d’injection intramusculaire ; cellulite ; gonflement ; inflammation ; phlébite locale au niveau ou à proximité du site d’injection intraveineuse.
Neurologique : Convulsions, crises, syncope, céphalées, faiblesse, absence de réponse, paresthésie, épisodes fébriles, frissons, vertiges, désorientation, engourdissement, perte de connaissance.
Respiratoire : Arrêt respiratoire, dyspnée, bronchospasme, respiration sifflante.
Urologique : Hématurie.
Réactions retardées : Arthralgie, mal de dos, frissons, vertiges, fièvre, céphalées, malaise, myalgie, nausées, vomissements. (Voir MISES EN GARDE).
Divers : Épisodes fébriles, sueurs, frissons, frissons, malaise, altération du goût.
Surdosage:
Le surdosage en fer dextran est peu susceptible d’être associé à des manifestations aiguës. Des doses de fer dextran supérieures aux besoins pour la restauration de l’hémoglobine et la reconstitution des réserves de fer peuvent entraîner une hémosidérose. La surveillance périodique des taux de ferritine sérique peut être utile pour reconnaître une accumulation progressive délétère de fer résultant d’une altération de l’absorption du fer par le système réticulo-endothélial dans des conditions médicales concomitantes telles que l’insuffisance rénale chronique, la maladie de Hodgkin et la polyarthrite rhumatoïde. La DL50 du fer dextran n’est pas inférieure à 500 mg/kg chez la souris.
DOSAGE ET ADMINISTRATION:
Le fer oral doit être interrompu avant l’administration de Infed.
Dosage:
I. Anémie ferriprive : Le dosage hématologique périodique (hémoglobine et hématocrite) est une technique simple et précise de surveillance de la réponse hématologique, et doit être utilisé comme guide dans le traitement. Il faut savoir que le stockage du fer peut être décalé par rapport à l’apparition d’une morphologie sanguine normale. Le fer sérique, la capacité totale de fixation du fer (TIBC) et le pourcentage de saturation de la transferrine sont d’autres tests importants pour détecter et surveiller l’état de carence en fer.
Après l’administration du complexe fer dextran, la preuve d’une réponse thérapeutique peut être observée en quelques jours sous la forme d’une augmentation du nombre de réticulocytes.
Bien que la ferritine sérique soit généralement un bon guide des réserves en fer de l’organisme, la corrélation entre les réserves en fer de l’organisme et la ferritine sérique peut ne pas être valable chez les patients sous dialyse rénale chronique qui reçoivent également un complexe de fer dextran.
Bien qu’il existe des variations significatives dans la corpulence et la répartition du poids chez les hommes et les femmes, le tableau et la formule ci-joints représentent un moyen pratique d’estimer le fer total nécessaire. Ce besoin total en fer reflète la quantité de fer nécessaire pour rétablir la concentration d’hémoglobine à un niveau normal ou proche de la normale, plus un apport supplémentaire pour assurer une reconstitution adéquate des réserves de fer chez la plupart des individus dont le taux d’hémoglobine est modérément ou sévèrement réduit. Il faut se rappeler que l’anémie ferriprive n’apparaît pas avant que les réserves de fer ne soient pratiquement épuisées. La thérapie, par conséquent, devrait viser non seulement la reconstitution du fer de l’hémoglobine, mais aussi des réserves de fer.
Les facteurs contribuant à la formule sont indiqués ci-dessous.
 Sur la base des facteurs ci-dessus, les individus ayant un taux d’hémoglobine normal auront environ 33 mg de fer sanguin par kilogramme de poids corporel (15 mg/lb).
Sur la base des facteurs ci-dessus, les individus ayant un taux d’hémoglobine normal auront environ 33 mg de fer sanguin par kilogramme de poids corporel (15 mg/lb).
Note : Le tableau et la formule qui l’accompagne ne s’appliquent qu’aux déterminations de la posologie chez les patients souffrant d’anémie ferriprive ; ils ne doivent pas être utilisés pour déterminer la posologie chez les patients nécessitant un remplacement du fer pour une perte de sang.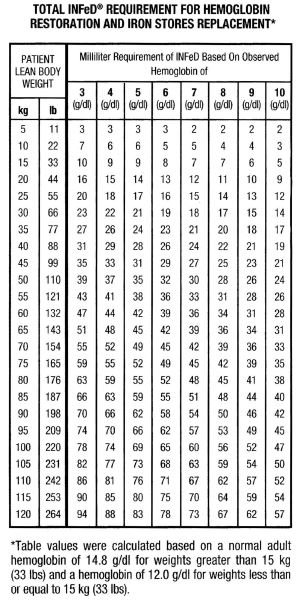
La quantité totale d’Infed en mL nécessaire pour traiter l’anémie et reconstituer les réserves de fer peut être approximée comme suit :
II. Remplacement du fer en cas de perte de sang : Certains individus subissent des pertes de sang de façon intermittente ou répétitive. De telles pertes de sang peuvent se produire périodiquement chez les patients atteints de diathèses hémorragiques (télangiectasie familiale ; hémophilie ; saignement gastro-intestinal) et sur une base répétitive à partir de procédures telles que l’hémodialyse rénale.
La thérapie de fer chez ces patients devrait être dirigée vers le remplacement de la quantité équivalente de fer représentée dans la perte de sang. Le tableau et la formule décrits sous I. Anémie ferriprive ne sont pas applicables aux valeurs de remplacement simple du fer.
Les estimations quantitatives de la perte sanguine périodique de l’individu et de l’hématocrite pendant l’épisode de saignement fournissent une méthode pratique pour le calcul de la dose de fer nécessaire.
La formule présentée ci-dessous est basée sur l’approximation que 1 mL de globules rouges normocytaires et normochromes contient 1 mg de fer élémentaire :
Ferre de remplacement (en mg) = Perte sanguine (en mL) x hématocrite
Exemple : Perte sanguine de 500 mL avec un hématocrite de 20%
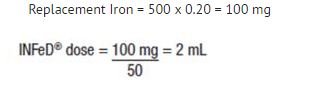
Administration :
La quantité totale d’Infed nécessaire au traitement de l’anémie ferriprive ou au remplacement du fer en cas de perte sanguine est déterminée à partir du tableau ou de la formule appropriée. (Voir POSOLOGIE).
1. Injection intraveineuse – AVANT LA PREMIÈRE DOSE THÉRAPEUTIQUE INTRAVEINEUSE, ADMINISTRER UNE DOSE TEST INTRAVEINEUSE DE 0,5 ML. ADMINISTREZ LA DOSE D’ESSAI À UN RYTHME PROGRESSIF PENDANT AU MOINS 30 SECONDES. Bien que les réactions anaphylactiques connues après l’administration d’Infed se manifestent généralement en quelques minutes, voire plus tôt, il est recommandé d’attendre une heure ou plus avant d’administrer le reste de la dose thérapeutique initiale.
Des doses individuelles de 2 ml ou moins peuvent être administrées quotidiennement jusqu’à ce que la quantité totale calculée nécessaire soit atteinte. Infed est administré non dilué à un débit lent et progressif ne dépassant pas 50 mg (1 mL) par minute.
2. Injection intramusculaire – AVANT LA PREMIÈRE DOSE THÉRAPEUTIQUE INTRAMUSCULAIRE d’Infed, ADMINISTRER UNE DOSE TEST INTRAMUSCULAIRE DE 0,5 ML. (Voir l’encadré MISES EN GARDE et PRÉCAUTIONS.) La dose d’essai doit être administrée dans la fesse en utilisant la même technique que celle décrite dans le dernier paragraphe de cette section. Bien que les réactions anaphylactiques connues à la suite de l’administration d’Infed se manifestent généralement en quelques minutes ou plus tôt, il est recommandé d’attendre au moins une heure ou plus avant d’administrer le reste de la dose thérapeutique initiale.
Si aucune réaction indésirable n’est observée, Infed peut être administré selon le calendrier suivant jusqu’à ce que la quantité totale calculée nécessaire soit atteinte. La dose de chaque jour ne doit normalement pas dépasser 0,5 ml (25 mg de fer) pour les nourrissons de moins de 5 kg (11 lb) ; 1,0 ml (50 mg de fer) pour les enfants de moins de 10 kg (22 lb) ; et 2,0 ml (100 mg de fer) pour les autres patients.
Infed doit être injecté uniquement dans la masse musculaire du quadrant supérieur externe de la fesse – jamais dans le bras ou d’autres zones exposées – et doit être injecté profondément, avec une aiguille de 2 ou 3 pouces de calibre 19 ou 20. Si le patient est debout, il doit supporter son poids sur la jambe opposée au site d’injection, ou s’il est alité, il doit être en position latérale avec le site d’injection vers le haut. Pour éviter l’injection ou la fuite dans le tissu sous-cutané, une technique en Z (déplacement de la peau latéralement avant l’injection) est recommandée.
NOTE : Ne pas mélanger Infed avec d’autres médicaments ou l’ajouter à des solutions de nutrition parentérale pour perfusion intraveineuse.
Les produits médicamenteux parentéraux doivent être inspectés visuellement pour détecter les particules et la décoloration avant l’administration, chaque fois que la solution et le récipient le permettent.
COMMENT FOURNIR :
Infed (Iron Dextran Injection USP) contenant 50 mg de fer élémentaire par mL, est disponible en flacons ambrés à dose unique de 2 mL (pour usage intramusculaire ou intraveineux) en cartons de 10 (NDC 0023-6082-10).
Réservez à 20 -25°C (68 -77°F) .
Rx Only

Pour toutes les questions médicales, contactez:
Allergan
Medical Communications
1-800-678-1605
Distribué par :
Allergan USA, Inc.
Madison, NJ 07940
Fabriqué par:
Patheon Italia S.p.A.
Ferentino, Italie 03013
© 2019 Allergan. Tous droits réservés.
Infed® est une marque déposée d’Allergan Sales, LLC.
Allergan® et son design sont des marques d’Allergan, Inc.
Contenu mis à jour : Novembre 2018
v.1.1USPI6082
Étiquette type


| Infed injection de fer dextran |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Étiqueteur – Injectables généraux & Vaccins, Inc. (108250663)
Plus d’informations sur Infed (fer dextran)
- Effets secondaires
- pendant la grossesse ou l’allaitement
- Informations sur la posologie
- Interactions médicamenteuses
- Prix & Coupons
- En Español
- Classe de médicaments : Produits à base de fer
Ressources pour les consommateurs
- Information pour les patients
- Infed (Lecture avancée)
Ressources pour les professionnels
- Information posologique
- Fer… Dextran hydrogéné (FDA)
Autres marques Dexferrum
Guides thérapeutiques associés
- Anémie associée à l’insuffisance rénale chronique
- Anémie ferriprive
Avis médical
.