ABSZTRAKT: A HIV kezelésére rendelkezésre álló antiretrovirális (ARV) gyógyszerek köre 2018 óta bővült. Új hatásmechanizmusú, új típusú ARV-gyógyszerek kerültek engedélyezésre, köztük az ibalizumab-uiyk és a fostemsavir. A korábban már elérhető gyógyszerek kombinált tablettáinak jóváhagyására is sor került, mint például a biktegravir/emtricitabin/tenofovir-alafenamid és a dolutegravir/lamivudin. Végül, bővültek maguknak a korábban rendelkezésre álló ARV-gyógyszereknek a jóváhagyott indikációi, mint például az emtricitabin/tenofovir-alafenamid a preexpozíciós profilaxisban való használatra.
US Pharm. 2020:45(10):17-25.
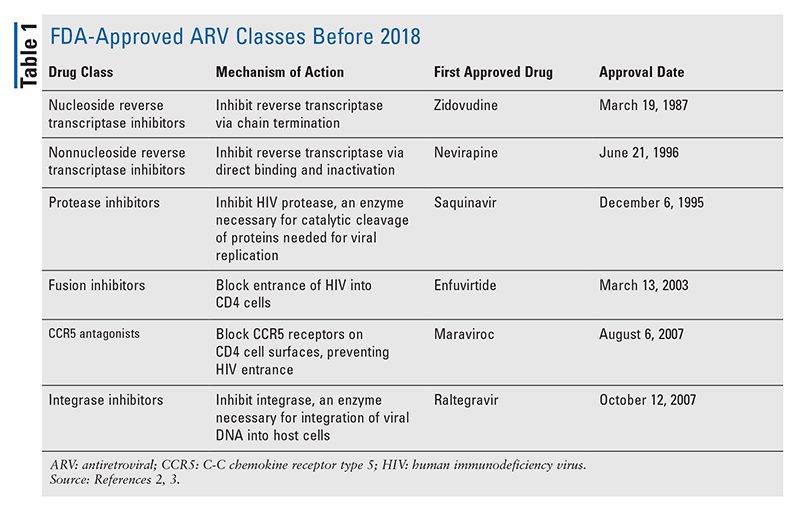
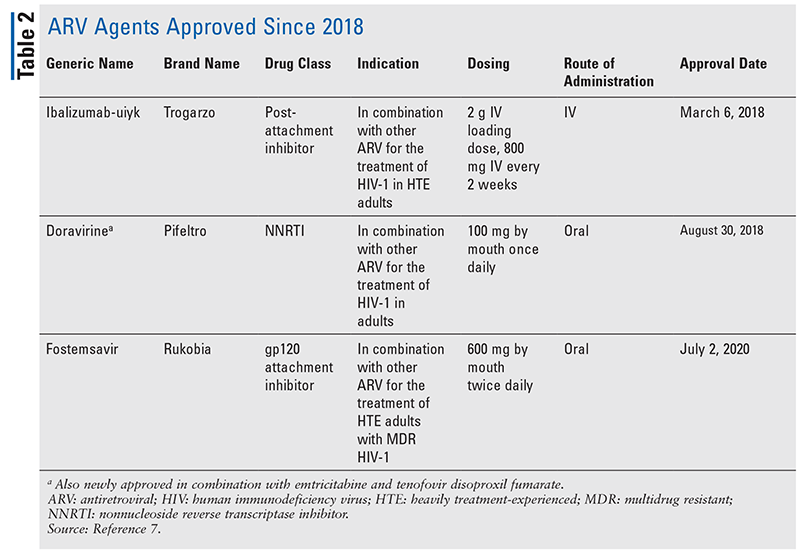
A HIV kezelésére szolgáló antiretrovirális (ARV) szerek fő támaszai évek óta nagyrészt ugyanabból a maroknyi gyógyszerosztályból állnak. A HIV kezelését először nukleozid reverz transzkriptáz-gátlókkal (NRTI-k), az ARV-k első FDA által jóváhagyott osztályával próbálták meg. Fokozatosan újabb és újabb osztályokat fedeztek fel és tettek elérhetővé különböző, gyakran összetett kezelési sémákban (1. TÁBLÁZAT).1-3 A raltegravir 2007-es jóváhagyását követően az új HIV-gyógyszerek jóváhagyása nagyrészt a rendelkezésre álló gyógyszerek és új kombinációs gyógyszerek újrahasznosítására vonatkozott. Ez 2018-ban változott meg az ibalizumab-uiyk jóváhagyásával, amely több mint egy évtized óta az első új ARV szer.4 Az ibalizumab-uiykot gyorsan követte egy új nem nukleozid reverz transzkriptáz-gátló (NNRTI), a doravirin még abban az évben, majd 2020-ban egy új kötődésgátló, a fostemsavir (2. TÁBLÁZAT).5-7
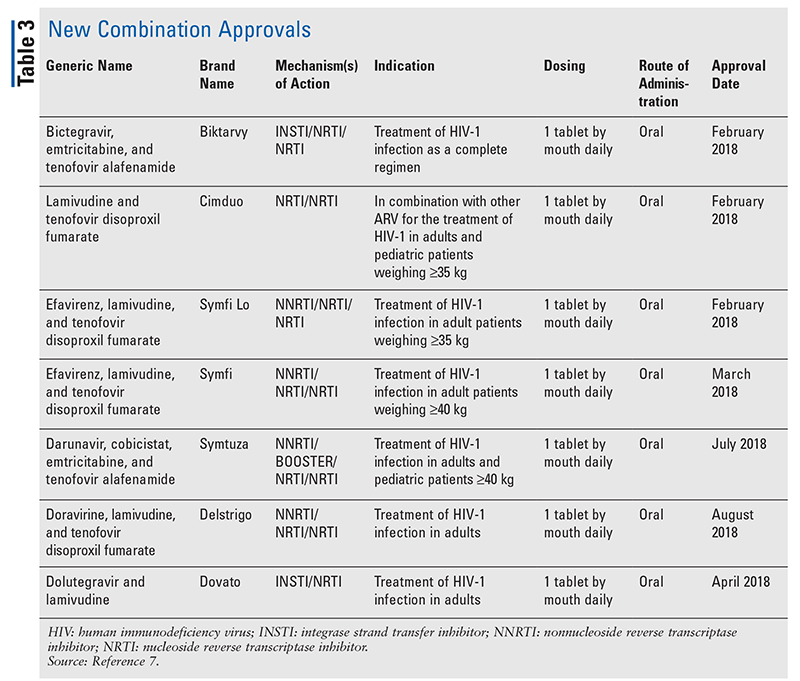
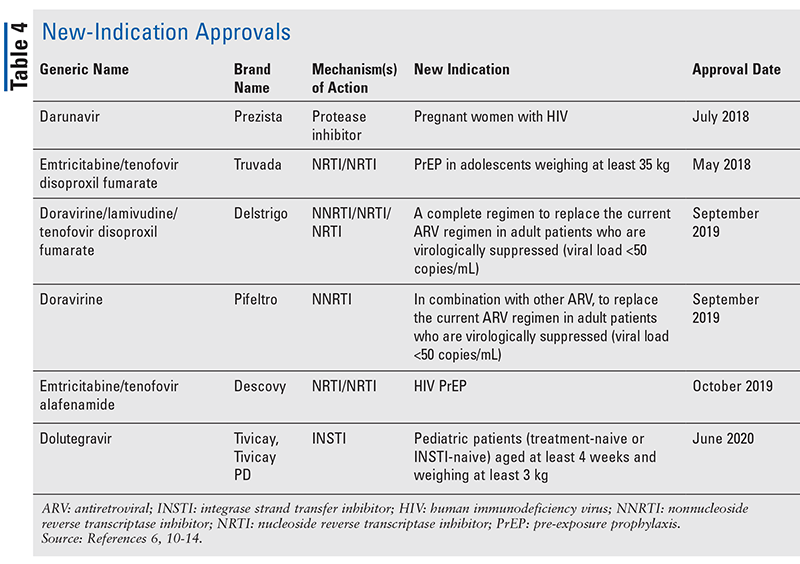
Míg az új gyógyszerek gyakran a legizgalmasabb új gyógyszerengedélyek, az ARV-k más módon is javultak. Tekintettel számos HIV-kezelés óriási tablettaterhére, az újonnan engedélyezett kombinált ARV-gyógyszerek (3. TÁBLÁZAT) nagyban megkönnyíthetik a betegek életét. Az ilyen szerek használata és a szükséges tablettaterhelés korlátozása bizonyítottan javította az adherenciát és az általános eredményeket.8,9 A korábban rendelkezésre álló ARV-gyógyszerek engedélyezett indikációi is bővültek (4. TÁBLÁZAT), ami új lehetőségeket kínál bizonyos betegcsoportok és indikációk számára.10-14
Bár 2018 óta számos új engedélyt adtak ki, ez a cikk az újonnan engedélyezett gyógyszerek közül négyet és egy új indikációt mutat be. Ezeket a jóváhagyásokat azért választottuk ki, hogy bemutassunk egy mintát az elérhetővé váló új szerek széles skálájából, valamint kiemeljünk néhány új lehetőséget, amelyek egyedülálló lehetőséget kínálnak a HIV kezelésében.
Ibalizumab-Uiyk (Trogarzo)
Az Ibalizumab-uiyk egy injektálható rekombináns monoklonális antitest, amely a CD4 sejtek felszíni fehérjéihez kötődve olyan konformációs változásokat eredményez, amelyek megakadályozzák a HIV-1 fúziójához és a sejtbe való bejutáshoz szükséges posztkötődési lépéseket. Ez az egyetlen monoklonális gyógyszer, amelyet a HIV kezelésére használnak. Egyedi kötési specificitása miatt az ibalizumab-uiyk anélkül gátolja a vírus bejutását, hogy immunszupressziót okozna, ami sok monoklonális gyógyszer esetében gondot jelent.4,15 Más ARV-kkel kombinációban javallott a kezelésben súlyosan megtapasztalt (HTE), multidrog-rezisztens (MDR) HIV-1-ben szenvedő felnőttek kezelésére, akiknél a jelenlegi ARV-terápiás kezelés sikertelen.4
Az ibalizumab-uiyk engedélyezése 40 HTE HIV-betegen végzett vizsgálaton alapult, akiknél a vírusterhelés meghaladta az 1000 kópiát/ml-t, és dokumentáltan rezisztensek voltak legalább egy NRTI-vel, NNRTI-vel és egy proteázgátlóval szemben. A betegeknek legalább 6 hónapos kezelésen kellett átesniük, és a közelmúltban sikertelen volt a terápia. A vizsgálat három időszakot foglalt magában, kezdve egy 6 napos időszakkal, amikor a kiindulási vírusterhelést megállapították és megerősítették (kontroll időszak). A 7. napon a betegek 2000 mg ibalizumab-uiyk betöltő adagot kaptak a szokásos ART-kezelésük mellett (funkcionális monoterápiás időszak). A 14. napon a vírusterhelést újraértékelték, és a kezeléseket figyelemmel kísérték és módosították, hogy biztosítsák a megfelelő aktivitást a HIV-fertőzésükkel szemben. Az ibalizumab-uiyk 800 mg-ot 2 hetente intravénásan adták be a vizsgálat befejezéséig (fenntartó időszak). Az elsődleges végpont a vírusterhelés csökkenésének arányában mutatkozó különbséget értékelte a kontroll időszak és a funkcionális monoterápiás időszak között, konkrétan összehasonlítva azon betegek százalékos arányát, akiknél a teljes vírusterhelés ³0,5 log10-es csökkenést mutatott. A kontrollidőszakban a betegek 3%-ánál tapasztaltak ilyen csökkenést, míg a funkcionális monoterápiás időszakban a betegek 83%-a érte el a megadott vírusterhelés-csökkenést. A 25 hét végére a betegek 43%-a érte el a <50 kópia/ml vírusterhelést.16
A vizsgálat alapján az ibalizumab-uiyk engedélyezett adagolása egyszeri 2000 mg-os intravénás feltöltő adag, amelyet kéthetente 800 mg-os intravénás fenntartó adag követ.4,16 Az első infúzió beadása után 1 órán át gondos megfigyelés szükséges az infúzióval kapcsolatos reakciók miatt, a későbbi infúziófigyelés pedig a kezdeti adag tolerálása után 15 percre csökken.4 Úgy tűnik, hogy az ibalizumab-uiyk egyébként jól tolerálható; az ibalizumab-uiykkal kapcsolatos legtöbb mellékhatás az émelygés, a szédülés és a hasmenés volt.4,16
Fostemsavir (Rukobia)
A fostemsavir egy új ARV, amelyet kombinációs terápiára javallott HTE felnőtteknél, ismert MDR HIV-1-ben szenvedő betegeknél, különösen olyan betegeknél, akiknél a jelenlegi ART potenciális rezisztencia, intolerancia vagy biztonsági megfontolások miatt nem alkalmazható.4 Ez az első FDA által jóváhagyott kötődésgátló. A temsavir aktív molekulává történő enzimatikus aktiválást követően a gp120-hoz, a vírus CD4-sejtekhez való kötődéséhez szükséges vírusburkoló glikoproteinhez kötődik. Ez megakadályozza a vírus bejutását a CD4-sejtekbe, hatékonyan leállítva a vírusszaporodást. Ennek az újszerű mechanizmusnak köszönhetően a fostemsavir nem valószínű, hogy a legtöbb más ARV-val kapcsolatos szelektív nyomás révén rezisztenciát váltana ki önmagával szemben.6,17
A fostemsavir biztonságosságát és hatékonyságát egy randomizált, kettős vak, placebokontrollos klinikai vizsgálatban (BRIGHTE) vizsgálták 371 HTE HIV-1 beteg bevonásával.16,17 A fő kohorszba tartozó betegeket mind a kiindulási ART-kezelésükkel, mind a naponta kétszer 600 mg fosztemszavirral vagy placebóval együtt kezelték összesen 8 napig. A 8. napi értékeléskor a fosztemszavirral kezelt betegek szignifikánsan alacsonyabb HIV-RNS-vírusszintet mutattak a szérumban. Ezt a kezdeti kezelési időszakot követően minden beteg átállt a napi kétszer 600 mg fostemsavirra. A 24 hétre a vizsgálatban résztvevők 53%-a ért el ténylegesen kimutatható vírusszuppressziót, és a szuppresszió a 96. hétre 60%-ra javult.17,18
A fostemsavir leggyakrabban jelentett mellékhatása a hányinger volt. Súlyosabb reakciókat, beleértve a májenzimek emelkedését, jelentettek hepatitis B vagy C koinfekcióban szenvedő betegeknél.17,18 Más tanulmányok a fejfájás, kiütés és hasmenés kisebb gyakoriságáról számoltak be. A temsavir aktív metabolitját a CYP3A4 metabolizálja, ezért az olyan erős induktorokat, mint a karbamazepin, a rifampin és az orbáncfű, kerülni kell a csökkent szérum temsavir-koncentráció megelőzése érdekében.17-19
Biktegravir/Emtricitabin/Tenofovir-Alafenamid (Biktarvy)
A biktegravir/emtricitabin/tenofovir-alafenamid (BIC/FTC/TAF) egy fix dózisú, naponta egyszer alkalmazandó kombinációs tabletta, amely egy új integrázgátlót és két nukleozid/nukleotid reverz transzkriptáz-gátlót tartalmaz. A Biktarvy egyes összetevői a biktegravir 50 mg (integráz-szálátviteli gátló ), az emtricitabin 200 mg (NRTI) és a tenofovir-alafenamid 25 mg (NRTI). A BIC/FTC/TAF teljes kezelésként javallott olyan HIV-1 fertőzött felnőtteknél, akik korábban nem részesültek ART kezelésben, vagy olyan betegek jelenlegi ART kezelésének kiváltására, akik legalább 3 hónapja stabil ARV-kezeléssel virológiailag szupprimáltak (vírusszám 50 £/ml), és nem volt a kezelés sikertelensége vagy az egyes összetevőkkel szembeni rezisztencia. A legjelentősebb, hogy ez egy egytablettás, teljes kezelés, amely nem igényel más ARV-t.20
A BIC/FTC/TAF-et négy klinikai vizsgálatot követően 2018-ban engedélyezték. A klinikai vizsgálatok közül kettőben a BIC/FTC/TAF hatékonyságát és biztonságosságát vizsgálták olyan betegeknél, akik korábban nem részesültek ART-ben: Az 1489. vizsgálat (randomizált, BIC/FTC/TAF vs. abakavir/dolutegravir/lamivudin, és az 1490. vizsgálat (randomizált, BIC/FTC/TAF vs. dolutegravir + emtricitabin/tenofovir alafenamid ).21,22 Az 1489-es vizsgálatban a BIC/FTC/TAF csoport 92%-a és az ABC/DTG/3TC csoport 93%-a érte el a <50 kópia/ml vírusterhelés elsődleges végpontját (-0,6%-os kezelési különbség; 95%-os konfidenciaintervallum , -4,8% és 3,6% között). Az 1490-es vizsgálatban a BIC/FTC/TAF csoport 89%-a és a DTG + FTC/TAF csoport 93%-a érte el a <50 kópia/ml vírusterhelés elsődleges végpontját (-3,5%-os kezelési különbség; 95%-os CI, -7,9% és 1,0% között).21,22
A másik két vizsgálat a BIC/FTC/TAF hatékonyságát és biztonságosságát vizsgálta olyan virológiailag szupprimált betegeknél, akiket a jelenlegi ART-kezelésükről BIC/FTC/TAF-re állítottak volna át: Az 1844. vizsgálat (randomizált, dolutegravir plusz abakavir/lamivudin vagy ABC/DTG/3TC-ről BIC/FTC/TAF-re történő váltás) és az 1878. vizsgálat (nyílt vizsgálat, atazanavirról vagy erősített darunavirról plusz abakavir/emtricitabin vagy emtricitabin/tenofovir-diszoproxil-fumarátról BIC/FTC/TAF-re történő váltás).23,24 Az 1844-es vizsgálatban a virológiai szuppressziós státuszukat elvesztő betegek elsődleges végpontja (vírusterhelés ³50 kópia/ml) a BIC/FTC/TAF csoport 1%-ában és az eredeti kezelési séma csoportjának <1%-ában fordult elő (0,7%-os kezelési különbség, 95% CI, -1,0% és 2,8% között). Az 1878-as vizsgálatban a virológiai szuppressziós státuszukat elvesztő betegek elsődleges végpontja a BIC/FTC/TAF csoport 2%-ánál és az eredeti kezelési séma csoportjának 2%-ánál volt megfigyelhető (a kezelési különbség 0,0%, 95%-os CI, -2,5% és 2,5% között).23,24
A BIC/FTC/TAF-et naponta egyszer, szájon át, étkezéssel vagy anélkül adagolják. A betegeknél leggyakrabban észlelt mellékhatások a hasmenés, hányinger és fejfájás voltak.20-24
Dolutegravir/Lamivudin (Dovato)
A kombinált dolutegravir/lamivudin (DTG/3TC), egy INSTI és NRTI, 2019-ben került engedélyezésre. Ez az első két hatóanyagból álló, fix dózisú teljes kezelés a kezelésre nem hajlamos felnőtt betegek HIV-1-fertőzésének kezelésére. Ez ellentétben áll a hagyományosan előírt három hatóanyagú standard kezelési séma lehetőségeivel. Ez lehetőséget kínálhat azoknál a betegeknél, akik mellékhatások vagy elkerülhetetlen gyógyszerkölcsönhatások miatt nem tolerálják az elterjedtebb három gyógyszeres kezelési sémák egyikét sem.25,26
A dolutegravir/lamivudin kombináció hatékonyságát és biztonságosságát két azonos vizsgálat, a GEMINI-1 és a GEMINI-2 bizonyította.27 Ezekbe a vizsgálatokba összesen 1433 HIV-1-fertőzött, kezelésben nem részesülő felnőttet vontak be, akiket randomizáltak a két hatóanyagú, 50 mg dolutegravir plusz 150 mg lamivudin, vagy a három hatóanyagú, dolutegravir plus emtricitabin plus tenofovir-diszoproxil-fumarát kombinációra. A <50 kópia/ml vírusterhelés elérésének elsődleges végpontjánál a DTG/3TC nem bizonyult rosszabbnak – a két gyógyszerrel kezelt 716 beteg 91%-ánál és a három gyógyszerrel kezelt 717 beteg 93%-ánál (a kezelési különbség -1,7%; 95% CI, -4,4%-1,1%) -, amikor a két vizsgálat eredményeit összevonták. Az összevont vizsgálatok azt is kimutatták, hogy számszerűen kevesebb betegnél fordultak elő gyógyszerrel kapcsolatos nemkívánatos események a két gyógyszeres kezelésben, mint a három gyógyszeres kezelésben (716-ból 126, illetve 717-ből 169 betegnél). A nem rosszabb hatékonyság és a hasonló tolerálhatósági profil miatt az Egészségügyi és Emberi Szolgálatok Minisztériuma a fix dózisú DTG/3TC kombinációt a HIV/AIDS-irányelvekbe a legtöbb HIV-fertőzött számára ajánlott kezdeti kezelésként tudta felvenni.27
A dolutegravir/lamivudin kombinációt naponta egyszer, szájon át, étkezéssel vagy anélkül kell adagolni. A betegeknél leggyakrabban észlelt mellékhatások a fejfájás, hányinger, hasmenés, fáradtság és álmatlanság. Annak ellenére, hogy két hatóanyagot tartalmazó kombinált tabletta, nem szükséges más ARV-gyógyszerekkel együtt adagolni, mivel ez egy teljes terápiás séma.25-27
Emtricitabin/Tenofovir Alafenamid a preexpozíciós profilaxishoz (PrEP)
2012 óta az egyetlen FDA által jóváhagyott lehetőség a PrEP-re az FTC/TDF volt.11 Ez 2019-ben megváltozott az emtricitabin/tenofovir alafenamid (FTC/TAF) kombinált készítmény13 , egy szerkezetileg hasonló kombinált gyógyszer jóváhagyásával. Ez most már javallott a PrEP-ben való alkalmazásra olyan nem fertőzött betegeknél, akiknél magas a HIV szexuális úton történő átvitelének kockázata. Ez kizárja a receptív hüvelyi közösülés kockázatának kitett betegeket, mivel ezt a populációt még nem vizsgálták.
A PrEP engedélyezése a közelmúltban végzett DISCOVER vizsgálaton alapul, amely egy randomizált, kettős vak vizsgálat, amely az FTC/TAF-et a standard FTC/TDF-fel hasonlította össze a HIV-1 fertőzés megszerzésének kockázatának csökkentése szempontjából a férfiakkal szexuális kapcsolatot létesítő, HIV-1 fertőzés kockázatának kitett férfiak és transznemű nők körében.7 A vizsgálatot randomizált, kettős vak, párhuzamos csoportos vizsgálatként végezték, legalább 48 hetes követési idővel, és a résztvevők legalább 50%-ának 96 hetes követési ideje volt a randomizálás után. A vizsgálatba 5399 résztvevőt vontak be, akiket 1:1 arányban randomizáltak bármelyik csoportba. A vizsgálat elsődleges célja a HIV-1-fertőzés 100 személyévre jutó előfordulásának felmérése volt. Az FTC/TAF-karban részt vevő 2694 résztvevő közül 7 betegnél (0,16/100 személyév) fordult elő HIV-1-fertőzés. Az FTC/TDF kar 2693 résztvevője között a HIV-1 incidenciája 15 betegnél fordult elő (0,34/100 személyév). Ezek az előfordulások azt mutatják, hogy az FTC/TAF nem volt rosszabb az FTC/TDF-nél a HIV-fertőzés kockázatának kitett vizsgálati résztvevőknél, és végül lehetővé tették az FDA számára, hogy az FTC/TAF indikációi közé felvegye a PrEP-et.13
Az FTC/TAF helye a HIV-terápiában valószínűleg még mindig nem tisztázott. Bár a HIV-kezelés más területein már találtak rá alkalmazást, az alternatívával szembeni előnyét ebben a környezetben még nem sikerült véglegesen meghatározni. Bár hasonló, a TAF a csontsűrűség-változások és a veseműködési zavarok – a TDF-hez társuló káros hatások – kisebb előfordulását kínálhatja. Ez a különbség azonban nem jól megalapozott, egyes adatok arra utalnak, hogy az olyan kezelésekben, amelyek nem tartalmaznak farmakokinetikai emlékeztetőt, például kobicisztátot vagy ritonavir-t, ez az előny klinikailag nem feltétlenül jelentős. 27-29
Következtetés
A HIV összetettsége és a rezisztencia kialakulásának lehetősége miatt az ARV-terápia gyorsan megterhelővé válhat a betegek számára. 2018 és napjaink között az orvostársadalom a HIV kezelésére szolgáló, az FDA által jóváhagyott ARV-terápiák széles körű bővülését tapasztalta. Ezek a terápiák magukban foglalnak új fix dózisú, kombinált tablettákat; új gyógyszereket, amelyek a korábban forgalomban lévőktől eltérő mechanizmusokon keresztül hatnak; és még a korábban már létező gyógyszerek új indikációit is. Ezek az új gyógyszerek máris hatással vannak a jelenlegi kezelési irányelvekre, és hozzájárulhatnak ahhoz, hogy a betegek hosszabb és egészségesebb életet éljenek.
A cikk tartalma kizárólag tájékoztató jellegű. A tartalom nem helyettesíti a szakmai tanácsadást. A cikkben szereplő bármely információra való hagyatkozás kizárólag a saját felelősségére történik.
1. Vella S, Schwartländer B, Sow SP, et al. Az antiretrovirális terápia és a világ korlátozott erőforrásokkal rendelkező területein történő alkalmazásának története. AIDS. 2012;26(10):1231-1241.
2. Arts EJ, Hazuda DJ. A HIV-1 antiretrovirális gyógyszeres terápia. Cold Spring Harb Perspect Med. 2012;2(4):a007161.
3. Chaudhuri S, Symons JA, Deval J. Innováció és trendek a vírusellenes gyógyszerek fejlesztésében és jóváhagyásában: 1987-2017 és azon túl. Antiviral Res. 2018;155:76-88.
4. Trogarzo (ibalizumab-uiyk) betegtájékoztató. Montreal, Quebec: Theratechnologies Inc; 2018. március.
5. Pifeltro (doravirin) betegtájékoztató. Whitehouse Station, NJ: Merck & Co, Inc; 2019. március.
6. Rukobia (fosztemsavir) betegtájékoztató. Research Triangle Park, NC: GlaxoSmithKline; 2020. július.
7. Pan F, Chernew ME, Fendrick AM. A fix dózisú kombinált gyógyszerek hatása a vényköteles gyógyszerek adherenciájára. J Gen Intern Med. 2008;23(5):611-614.
8. Verma AA, Khuu W, Tadrous M,et al. Fix adagú kombinált antihipertenzív gyógyszerek, adherence, and clinical outcomes: a population-based retrospective cohort study. PLoS Med. 2018;15(6):e1002584.
9. National Institutes of Health. HIVinfo. Az FDA által jóváhagyott HIV-gyógyszerek. hivinfo.nih.gov/understanding-hiv/fact-sheets/fda-approved-hiv-medicines. Hozzáférés 2020. szeptember 22.
10. Prezista (darunavir) betegtájékoztató. Titusville, NJ: Janssen Therapeutics; 2019. május.
11. Truvada (emtricitabin/tenofovir-diszoproxil-fumarát) betegtájékoztató. Foster City, Kalifornia: Gilead Sciences, Inc; 2004. június/2020.
12. Delstrigo (doravirin/lamivudin/tenofovir-diszproxil-fumirát) betegtájékoztató. White House Starion, NJ: Merck & Co, Inc; 2018. augusztus.
13. Descovy (emtricitabin/tenofovir alafenamid) betegtájékoztató. Foster City, Kalifornia: Gilead Sciences, Inc; 2019. december.
14. Tivicay (dolutegravir) betegtájékoztató. Research Triangle Park, NC. GlaxoSmithKline; 2020. június.
15. Iacob SA, Iacob DG. A CD4-receptorokat célzó ibalizumab, egy új molekula a HIV-terápiában. Front Microbiol. 2017;8:2323.
16. Emu B, Fessel J, Schrader S, et al. Az ibalizumab 3. fázisú vizsgálata a multidrog-rezisztens HIV-1 kezelésére. N Engl J Med. 2018;379:645-654.
17. Li Z, Zhou N, Sun Y, et al. A BMS-626529 nevű HIV-1 csatolási gátló, a BMS-663068 nevű prodrug aktív komponensének aktivitása CD4-független vírusok és más belépési gátlókkal szemben rezisztens HIV-1 burok ellen. Antimicrob Agents Chemother. 2013:57(9):4172-4180.
18. Kozal M, Aberg J, Pialoux G. Fostemsavir multidrog-rezisztens HIV-1 fertőzésben szenvedő felnőtteknél. N Engl J Med. 2020;382(13):1232-1243.
19. Cahn P, Fink V, Patterson P. Fostemsavir: egy új CD4-kötődésgátló. Curr Opin HIV AIDS. 2018;13(4):341-345.
20. Biktarvy (bictecgravir/emtricitabin/tenofovir alafenamid) betegtájékoztató. Foster City, CA: Gilead Sceinces, Inc; 2018. február.
21. Gallant J, Lazzarin A, Mills M, et al. Biktegravir, emtricitabin és tenofovir-alafenamid versus dolutegravir, abakavir és lamivudin a HIV-1 fertőzés kezdeti kezelésére (GS-US-380-1489): kettős vak, multicentrikus, 3. fázisú, randomizált, kontrollált, nem alsóbbrendűségi vizsgálat. Lancet. 2017;390(10107):2063-2072.
22. Sax PE, Pozniak A, Montes M, et al. Coformulated bictegravir, emtricitabine, and tenofovir alafenamide versus dolutegravir with emtricitabine and tenofovir alafenamide, for initial treatment of HIV-1 infection (GS-US-380-1490): a randomised, double-blind, multicentre, phase 3, non-inferiority trial. Lancet. 2017;390(10107):2073-2082.
23. Malina JM, Ward D, Brar I, et al. Fix dózisú biktegravirre, emtricitabinra és tenofovir-alafenamidra váltás a dolutegravir plusz abakavir éslamivudinról virológiailag szupprimált HIV-1-es felnőtteknél: egy randomizált, kettős vak, multicentrikus, aktívan kontrollált, 3. fázisú, nem alsóbbrendűségi vizsgálat 48 hetes eredményei. Lancet HIV. 2018;5(7):E357-E365.
24. Daar ES, De Jesus E, Ruane P, et al. Efficacy and safety of switching to fixed-dose bictegravir, emtricitabine, and tenofovir alafenamide from boosted protease inhibitor-based regiments in virologically suppressed adults with HIV-1: 48-week results of a randomised, open-label, multicentre, phase 3, non-inferiority trial. Lancet HIV. 2018;5(7):e347-e356.
25. Dovato (dolutegravir/lamivudin) betegtájékoztató. Research Triangle Park, NC: GlaxoSmithKline. March 2020.
26. Scott LJ. Dolutegravir/lamivudin egytablettás kezelés: áttekintés HIV-1 fertőzésben. Gyógyszerek. 2020;80(1):61-72.
27. Cahn P, Madero JS, Arribas JR, et al. GEMINI Study Team. Dolutegravir plusz lamivudin versus dolutegravir plusz tenofovir-diszoproxil-fumarát és emtricitabin antiretrovirális szerrel kezelt, HIV-1-fertőzött felnőtteknél (GEMINI-1 és GEMINI-2): két multicentrikus, kettős vak, randomizált, nem alsóbbrendűségi, 3. fázisú vizsgálat 48. heti eredményei. Lancet. 2019;393(10167):143-155.
28. Mayer KH, Molina JM, Thompson MA, et al. Emtricitabine and tenofovir alafenamide vs. emtricitabine and tenofovir disoproxil fumarate for HIV pre-exposure prophylaxis (DISCOVER): primary results from a randomised, double-blind multicentre, active-controlled, phase 3 non-inferiority trial. Lancet. 2020;396(10246):239-254.
29. Hill A, Hughes SL, Gotham D, Pozniak AL. Tenofovir-alafenamid versus tenofovir-diszoproxilfumarát: van-e valódi különbség a hatékonyság és a biztonságosság tekintetében? J Virus Erad. 2018;4(2):72-79.