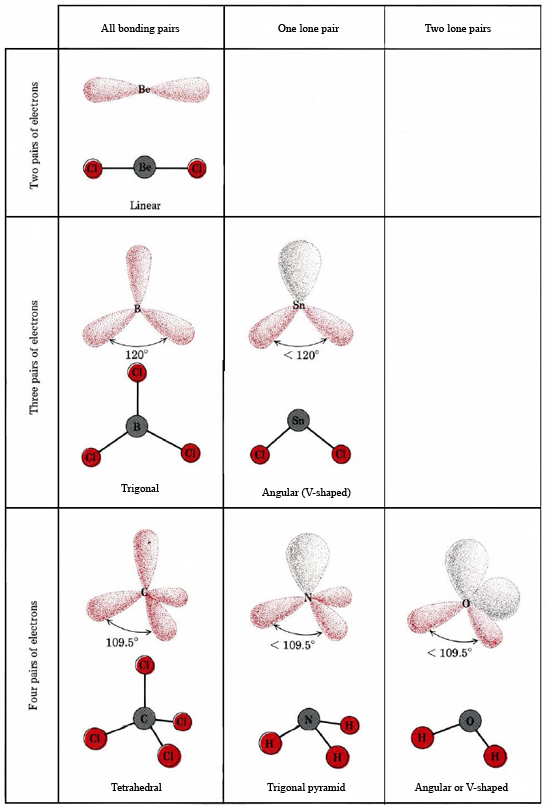
A VSEPR elmélet képes megmagyarázni és megjósolni a magányos párokat tartalmazó molekulák alakját. Ilyen esetben a magányos párokat, valamint a kötéspárokat úgy tekintjük, hogy taszítják és elkerülik egymást. Például, mivel az SnCl2 molekulában két kötés van, elvárható, hogy lineáris legyen, mint a BeCl2. Ha azonban megrajzoljuk a Lewis-diagramot, akkor az Sn atom valenciahéjában egy magányos párt, valamint két kötéspárt találunk:
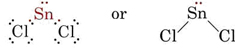_Chloride.jpg?revision=1&size=bestfit&width=235&height=48)
A magányos pár az ammónia, NH3 szerkezetét is befolyásolja. Mivel ez a molekula az oktett-szabálynak engedelmeskedik, az N atomot négy elektronpár veszi körül:
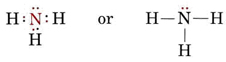
Ha ezek a párok mind egyenértékűek lennének, azt várnánk, hogy a köztük lévő szög a 109,5°-os szabályos tetraéderes szög legyen. Kísérletileg azt találták, hogy a szög valamivel kisebb, nevezetesen 107°. Ennek oka ismét az, hogy a magányos pár “kövérebb”, mint a kötéspárok, és képes azokat közelebb szorítani egymáshoz.
A H2O-molekula elektronszerkezete hasonló az NH3-éhoz, kivéve, hogy az egyik kötéspár helyébe egy magányos pár lép:
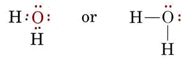
Példa \(\PageIndex{1}\) : Molekulageometria
Vázolja fel és írja le a következő molekulák geometriáját: (a) GaCl3, (b) AsCl3 és (c) AsOCl3.
Solution
a) Mivel a gallium elem a III. csoportba tartozik, három valenciaelektronja van. A GaCl3 Lewis-diagramja így néz ki
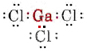
Mivel a Ga atom körül három kötéspár van, és nincs magányos pár, arra következtetünk, hogy a három Cl atom trigonálisan helyezkedik el, és mind a négy atom egy síkban van.
b) Az arzén az V. csoportba tartozik, ezért öt valenciaelektronja van. Az AsCl3 Lewis-szerkezete tehát
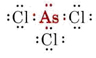
Mivel egy magányos pár van jelen, ennek a molekulának az alakja egy trigonális piramis, ahol az As atommag kicsit a Cl atommagok egyenlő oldalú háromszöge fölött helyezkedik el.
c) Az AsOCl3 Lewis-diagramja hasonló az AsCl3-éhoz.

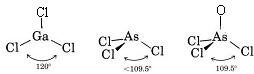
A VSEPR-elmélet olyan molekulákra is alkalmazható, amelyek öt és hat valenciaelektronpárt tartalmaznak, amelyek közül néhány magányos pár. Az ilyen fajokat itt nem vettük figyelembe, mert a vegyületek többsége az általunk leírt kategóriákba esik.
Munkatársak
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, és Adam Hahn.