Tanulási célok
- Az alkánok, alkének, alkinek és aromás vegyületek azonosítása.
- Listázza a szénhidrogének néhány tulajdonságát.
A legegyszerűbb szerves vegyületek azok, amelyek csak két elemből: szénből és hidrogénből állnak. Ezeket a vegyületeket szénhidrogéneknek nevezzük. Magukat a szénhidrogéneket két típusra különböztetjük meg: alifás szénhidrogénekre és aromás szénhidrogénekre. Az alifás szénhidrogének olyan szénhidrogének, amelyek C atomokból álló láncokon alapulnak. Az alifás szénhidrogéneknek három típusa van. Az alkánok olyan alifás szénhidrogének, amelyek csak egyetlen kovalens kötéssel rendelkeznek. Az alkének olyan alifás szénhidrogének, amelyek legalább egy C-C kettős kötést tartalmaznak, az alkének pedig olyan alifás szénhidrogének, amelyek egy C-C hármas kötést tartalmaznak. Alkalmanként találkozhatunk olyan alifás szénhidrogénnel, amelynek gyűrűje C atomokból áll; ezeket a szénhidrogéneket cikloalkánoknak (vagy cikloalkéneknek vagy cikloalkineknek) nevezzük.
Az aromás szénhidrogének, mint például a benzol,lapos gyűrűs rendszerek, amelyek folyamatosan átfedő p-orbitálisokat tartalmaznak.A benzolgyűrűben lévő elektronok különleges energetikai tulajdonságokkal rendelkeznek, amelyek a benzolnak az alkánoktól jelentősen eltérő fizikai és kémiai tulajdonságokat adnak. Eredetileg az aromás kifejezést azért használták a vegyületek ezen osztályának leírására, mert különösen illatosak voltak. A modern kémiában azonban az aromás kifejezés egy nagyon stabil gyűrű jelenlétét jelöli, amely különböző és egyedi tulajdonságokkal ruházza fel a molekulát.
A legegyszerűbb alkánok C atomjai egyenes láncban kapcsolódnak; ezeket normál alkánoknak nevezzük. Nevüket a láncban lévő C-atomok száma szerint kapták. A legkisebb alkán a metán:
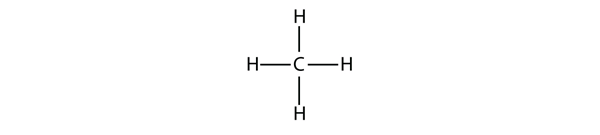
16.1. ábra A metán háromdimenziós ábrázolása

A négy kovalens kötés létrehozásához a C atom négy H atomhoz kötődik, így a metán molekuláris képlete CH4. A metán kétdimenziós ábrája azonban félrevezető; a négy kovalens kötés, amelyet a C atom létesít, háromdimenziósan egy tetraéder sarkai felé irányul. A metánmolekula jobb ábrázolása a 16.1. ábra “A metán háromdimenziós ábrázolása.”
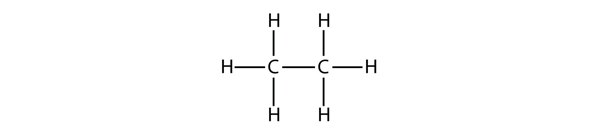
A következő legnagyobb alkánnak két C atomja van, amelyek kovalens kötésben vannak egymással. Ahhoz, hogy minden C atom négy kovalens kötést hozzon létre, minden C atomnak három H atomhoz kell kötődnie. Az így kapott molekula, amelynek képlete C2H6, az etán:
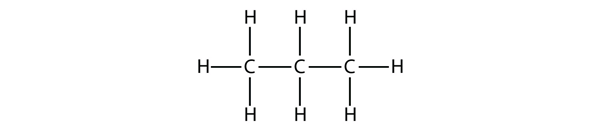
A propan gerincét három C atom veszi körül H atomokkal. Meg kell tudnod ellenőrizni, hogy a propán molekulaformulája C3H8:
Az eddig látott, alkánokat ábrázoló ábrák meglehetősen egyszerű Lewis-szerkezetek. Ahogy azonban a molekulák egyre nagyobbak lesznek, a Lewis-szerkezetek egyre bonyolultabbá válnak. Ennek egyik módja a sűrített szerkezet használata,amely felsorolja a molekula gerincének minden egyes C atomjának képletét. Például az etán kondenzált szerkezete CH3CH3, míg a propáné CH3CH2CH3. A 16.1. táblázat “Az első 10 alkán” tartalmazza az első 10 alkán molekuláris képletét, kondenzált szerkezeti képletét és nevét.
16. táblázat.1 Az első 10 alkán
| Molekuláris képlet | Sűrített szerkezeti képlet | Név |
|---|---|---|
| CH4 | CH4 | metán |
| C2H6 | CH3CH3 | etán |
| C3H8 | CH3CH2CH3 | propán |
| C4H10 | CH3CH2CH2CH2CH3 | bután |
| C5H12 | CH3CH2CH2CH2CH3 | pentán |
| C6H14 | CH3(CH2)4CH3 | hexán |
| C7H16 | CH3(CH2)5CH3 | heptán |
| C8H18 | CH3(CH2)6CH3 | oktán |
| C9H20 | CH3(CH2)7CH3 | nononán |
| C10H22 | CH3(CH2)8CH3 | dekán |
Mert az alkánoknak a kovalens kötések szabályai szerint a lehető legtöbb H atomjuk van, az alkánokat telített szénhidrogéneknek is nevezik.
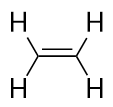
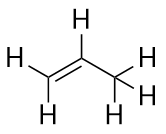
Az alkének C-C kettős kötéssel rendelkeznek. Mivel a lehetséges maximális H-atomszámnál kevesebb H-atomjuk van, telítetlen szénhidrogéneknek nevezik őket. A legkisebb alkénnek – az eténnek – két C atomja van, és köznapi nevén etilénnek is nevezik:
A következő legnagyobb alkénnek – a propénnek – három C atomja van, két C atom között C-C kettős kötéssel. Propilén néven is ismert:
Mit veszel észre az alkánok és alkének nevével kapcsolatban? Az alkének neve megegyezik a megfelelő alkánok nevével, kivéve, hogy az utótag (végződés) -én, nem pedig -án. A szerves kémiában gyakori a szülői láncnak nevezett szár használata a molekulában lévő C-atomok számának jelölésére, és a végződés használata a szerves vegyület típusának jelölésére, amint azt látni fogjuk.
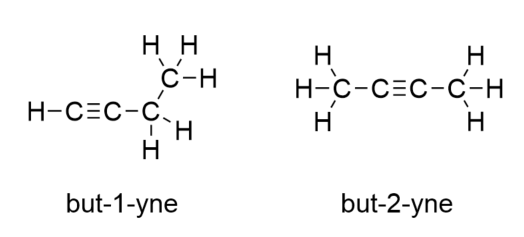
A következő alkén, a butén bevezetésével kezdjük látni a szerves molekulák egyik fő problémáját: a választási lehetőségeket. Négy C-atom esetén a C-C kettős kötés mehet az első és a második C-atom között vagy a második és a harmadik C-atom között:
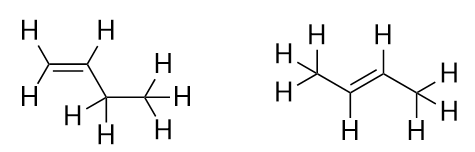
(A harmadik és a negyedik C-atom közötti kettős kötés ugyanaz, mintha az első és a második C-atom között lenne, csak megfordítva.) A szerves kémia elnevezési szabályai megkövetelik, hogy ez a két anyag különböző nevet kapjon. Az első molekula neve but-1-én, míg a második molekula neve but-2-én. Az alaplánc neve és az utótag közötti számot lokánsnak nevezik, és azt jelzi, hogy a kettős kötés melyik szénatomon keletkezett. A lehető legalacsonyabb számot használják a molekula egy tulajdonságának számozására; ezért a második molekulát but-3-éneknek nevezni helytelen lenne. A számok a szerves kémiai nevek gyakori részei, mert jelzik, hogy egy láncban melyik C-atom tartalmaz egy megkülönböztető jellemzőt. Ha a kettős kötés (vagy más funkciós csoport) az első szénatomon található, egyes szerzőknél bevett gyakorlat, hogy elhagyják a helyhatározót. Ha például a butént locant nélkül írnák, akkor azt kellene feltételeznünk, hogy az a but-1-ént jelenti, nem pedig a but-2-ént.
A but-1-én és a but-2-én vegyületeknek különböző fizikai és kémiai tulajdonságaik vannak, annak ellenére, hogy ugyanaz a molekuláris képletük – C4H8. Az azonos molekuláris képlettel rendelkező különböző molekulákat izomereknek nevezzük. Az izomerek gyakoriak a szerves kémiában, és hozzájárulnak annak bonyolultságához.
1. példa
A butén molekulák nevei alapján tegyen javaslatot ennek a molekulának a nevére.
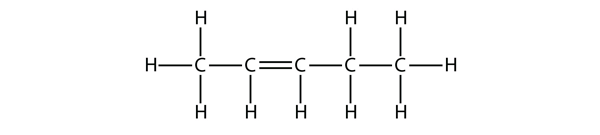
megoldás
Öt C-atom esetén a pentén nevet fogjuk használni, C-C kettős kötéssel pedig alkénről van szó, tehát ez a molekula pentén. A C-atomok számozásánál a 2-es számot használjuk, mert ez a lehető legalacsonyabb címke. Ezt a molekulát tehát pent-2-éneknek nevezzük.
Teszteld magad
A buténmolekulák nevei alapján tegyél javaslatot ennek a molekulának a nevére.
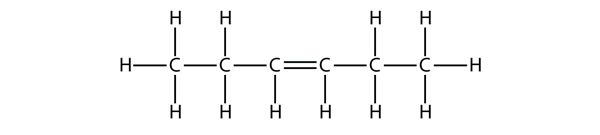
Válasz
hex-3-én
A C-C hármas kötéssel rendelkező alkineket az alkénekhez hasonlóan nevezzük, kivéve, hogy nevük -yn-re végződik. A legkisebb alkin az etin, amelyet acetilén néven is ismerünk:
![]()
A propin ilyen szerkezetű:
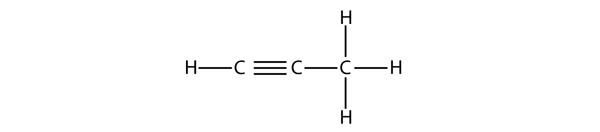
A butin esetében a hármas kötés helyzetének számozását kell kezdenünk, ugyanúgy, mint az alkéneknél:
A benzol hat C-atomból álló gyűrűben lévő aromás vegyület, amelyben váltakozó egyszerű és kettős C-C kötések váltakoznak:
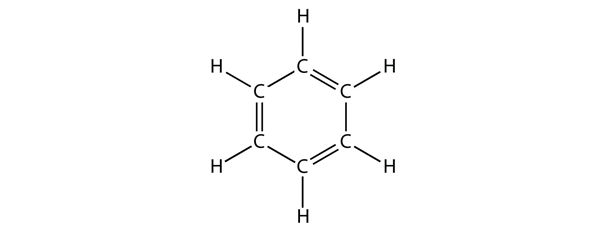
A váltakozó egyszerű és kettős C-C kötések különleges stabilitást kölcsönöznek a benzolgyűrűnek, és nem úgy reagál, mint egy alkén, ahogy azt várni lehetne.
Milyen alapvetőek is a szénhidrogének a szerves kémiában, tulajdonságaik és kémiai reakcióik meglehetősen hétköznapiak. A legtöbb szénhidrogén a C- és H-atomok közeli elektronegativitása miatt nem poláris. Ezért H2O-ban és más poláros oldószerekben csak kevéssé oldódnak. A kis szénhidrogének, például a metán és az etán szobahőmérsékleten gázok, míg a nagyobb szénhidrogének, például a hexán és az oktán folyadékok. Még a nagyobb szénhidrogének, mint a hentriakontán (C31H64), szobahőmérsékleten szilárd halmazállapotúak, és lágy, viaszos állagúak.
A szénhidrogének inkább nem reagálnak, de részt vesznek néhány klasszikus kémiai reakcióban. Az egyik gyakori reakció a halogénatommal történő szubsztitúció egy szénhidrogén és egy elemi halogén egyesítésével. Néha fényt használnak a reakció elősegítésére, mint például ebben a metán és klór közötti reakcióban:
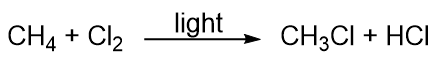
A halogének alkénekkel és alkinekkel is reagálhatnak, de a reakció más. Ezekben az esetekben a halogénmolekulák a C-C kettős vagy hármas kötéssel reagálnak, és a többszörös kötésben részt vevő minden egyes C atomra kapcsolódnak. Ezt a reakciót addíciós reakciónak nevezzük. Egy példa
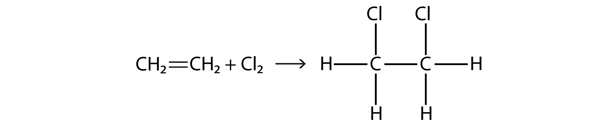
A reakció körülményei általában enyhék; sok esetben a halogén spontán reagál az alkénnel vagy alkinnal.
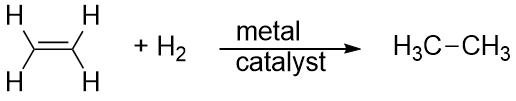
A hidrogén is adódhat a többszörös kötésen keresztül; ezt a reakciót hidrogénezési reakciónak nevezzük. Ebben az esetben azonban a reakció körülményei nem biztos, hogy enyheek; nagy nyomású H2-gázra lehet szükség. Általában platina- vagy palládiumkatalizátort alkalmaznak, hogy a reakció ésszerű ütemben menjen végbe:
A szénhidrogének messze leggyakoribb reakciója az égetés, amely során a szénhidrogén O2-vel egyesülve CO2 és H2O keletkezik. A szénhidrogének égése energiafelszabadulással jár, és társadalmunkban az energiatermelés elsődleges forrása (16.2. ábra “Égés”). A C8H18-mal ábrázolható benzin égési reakciója például a következő:
2 C8H18 + 25 O2 → 16 CO2 + 18 H2O + ~5060 kJ
16.2. ábra Égés
