Egy 40-es éveiben járó nő az elmúlt héten többszörös, egyre gyakoribb “rohamokkal” jelentkezett. Szédülést érez, majd nem reagál. Általában körülbelül egy percig tart, majd megszűnik. Mellkasi fájdalma nem volt. Gyermekkorában rohamai voltak, de ezekben a rohamokban nincs rohamtevékenység.
A monitor ezt mutatja:

Ventrikuláris tachycardia, frekvencia kb. 220 ütés/perc
A ritmus alatt éber volt, védte a légutakat, sápadtság, diaforézis és hűvös végtagok. Pulzusai megvoltak. Légzési nehézség nem volt.
Egy 12 elvezetéses EKG-t rögzítettek:
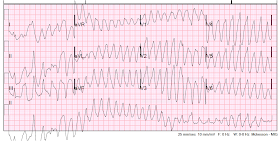
VT, és ez “polimorfikus” VT, mivel a komplexeknek többféle morfológiája van. A frekvencia ismét körülbelül 220. A polimorf VT vagy torsade (hosszú QT-intervallummal társul), vagy nem torsade (a QT nem hosszú, gyakran ischaemia miatt)
A monitoron spontán átváltott más ritmusra, és újabb 12 elvezetés készült:

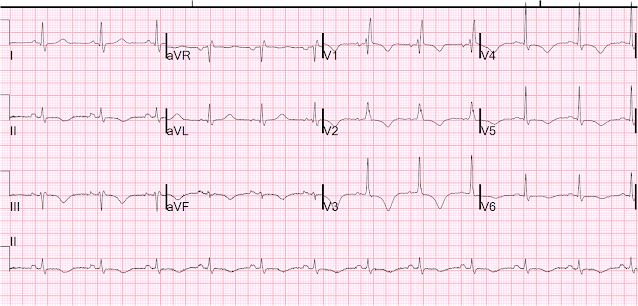
Bigeminia van. A szűk komplexeket P-hullámok előzik meg. A szinuszütésekhez tartozó QRS-ek jobb köteg ági blokk (RBBB), és nem tűnik nagyon hosszú QT-intervallumnak (400ms QT-t számoltam, osztva az azt megelőző R-R intervallum négyzetgyökével = 460ms). A közbeeső kamrai komplexek (PVC-k) nagyon bizarrnak tűnnek hosszú QT-intervallummal. A PVC-k nagy ST-emelkedést mutatnak (II, III, aVF) reciprok ST-depresszióval (aVL, prekordialis), ami inferoposterior STEMI-re utal, de ez egyértelműen mimika, mert a közbeeső sinus-komplexekben nincs ST-emelkedés.
Újra tachycardia lépett fel:
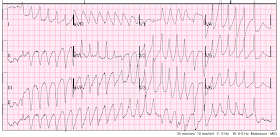
Újra polimorf VT.
Mit kell tenni?
Először is, milyen VT-ről van szó? Polimorf VT. A PMVT-t úgy definiálják, mint 100 feletti frekvenciájú, széles komplex kamrai ritmust, gyorsan változó QRS-tengellyel és/vagy morfológiával.
Polymorf VT
Etiológia
A polimorf VT vagy torsades de pointe (hosszú QT-vel társul az alap 12 elvezetéses EKG-n) vagy nem torsades (általában iszkémiával vagy más szerves szívbetegséggel társul). A QT-meghosszabbodás jelenléte a 12 elvezetéses EKG-n nem mindig nyilvánvaló. A Torsade de pointes jelentése “a pontok csavarodása”, és az izoelektromos vonal körüli tengelyváltozásra utal.
A PMVT morfológiája (azaz a pontok csavarodásának jelenléte) önmagában nem képes megkülönböztetni a hosszú QT miatt kialakuló PMVT-t (torsades) a más etiológiájú (nem torsades) PMVT-től. Gyakorlatilag lehetetlen megkülönböztetni a pulzus nélküli PMVT-t a kamrafibrillációtól, és vizsgálatok kimutatták, hogy a pulzus nélküli, torsádnak tűnő (a pontok “csavarodásával” járó) ritmusok többsége valójában kamrafibrilláció. Ennek a megkülönböztetésnek nincs jelentősége az azonnali kezelés (defibrilláció) szempontjából, de fontos következményei vannak a további ritmuszavarok megelőzése szempontjából.
Torsades A PMVT etiológiái
1. Szerzett: általában gyógyszereknek köszönhető. A lista hosszú. Szintén elektrolit-rendellenességek, különösen hypoK és hypoMg miatt. A korrigált QT-intervallum (Bazett-korrekció = QT osztva az előző R-R intervallum négyzetgyökével milliszekundumban) általában nagyobb, mint 600 ms. A szerzett hosszú QT-vel járó torsades sokkal valószínűbb bradycardia esetén, mivel a hosszú szünetet követő QT-intervallum még hosszabb. Ezért a torsades in acquired long QT-t “szünetfüggőnek” nevezik: ha hosszú szünet után szinuszütés következik (ami hosszabb QT-intervallumot hoz létre), akkor a repolarizáció során sokkal nagyobb valószínűséggel fordul elő korai PVC (“korai afterdepolarizáció”, EAD), amely torsades-t indít el. A szokásos sorrend: szinuszütés, majd korai PVC, majd hosszú szünet, mert a PVC korai volt, ami aztán különösen hosszú QT-t eredményez, majd egy újabb PVC “R on T”-vel, amely torsades-t indít.
2. Veleszületett, különösen veleszületett hosszú QT-szindróma. A veleszületett hosszú QT miatt kialakuló instabil PMVT sokkal ritkább. (26 év EM és 125 000 beteg során még soha nem láttam veleszületett hosszú QT miatt kialakult torsade PMVT-t). A torsade veleszületett okai közé tartozik a “katekolaminerg PMVT”, amelyben nincs látható QT-meghosszabbodás a 12 elvezetésen, de feltételezhetően hasonló etiológiájú. A veleszületett hosszú QT megelőző terápiája magában foglalja a béta-blokkolók alkalmazását (ugyanaz, mint a katekolaminerg PMVT esetében, mivel mindkettőnél a béta-stimuláció provokálja a torsádét); ez megkülönböztetendő a szerzett hosszú QT-től, amely béta-stimulációval (izopreterenol) kezelhető.
Nem találtam ajánlást béta-blokkolók alkalmazására a torsád akut kezelésére ebben a csoportban, de szinte lehetetlen megmondani, hogy az izoproterenol rontja vagy javítja-e a helyzetet egy adott, veleszületett hosszú QT-vel rendelkező beteg esetében (lásd elektrofiziológusunk megjegyzését a végén). Úgy tűnik, hogy a legtöbb tüneteket mutató, veleszületett hosszú QT-vel rendelkező beteg szinkópa vagy újraélesztett v fib után jelentkezik, és ritkán jelentkezik folyamatos torsáddal vagy instabilitással. Így ezeknek a betegeknek a kezelése elsősorban a jövőbeni syncope és hirtelen szívhalál felismerése és megelőzése, általában beültethető debribrillátorral a béta-blokkolók mellett. A veleszületett hosszú QT-ből eredő torsádokat QT-meghosszabbító gyógyszerek alkalmazása idézheti elő.
A PMVT nem torsádos etiológiái
Leggyakrabban iszkémiára vezethető vissza. Ezek szinte mindig nyílt, súlyos iszkémiás epizódok, mellkasi fájdalommal és/vagy egyértelmű iszkémiás EKG-eltérésekkel. Előre fennálló kardiomiopátia is okozhatja.
A polimorf VT kezelése
A legtöbb torsade önkorlátozó. Ha nem alakul át spontán, akkor defibrillációra van szükség, ha a beteg instabil. Ha mégis átalakul, akkor valószínűleg kiújul, és a terápia célja a kiújulás megelőzése.
Az akut torsades epizódok terápiája:
1. Kardioverzió vagy defibrilláció, ha aktív, különösen ha instabil
2. A kórokozó eltávolítása szerzett hosszú QT esetén
3. A hypoK korrekciója, akár enyhén szupranormális szintre is
4. 2-4 g MgSO4 adása még akkor is, ha a Mg-szint normális (percenként 3-10 mg-os csepegtetés hasznos lehet)
5. Kardioverzió vagy defibrilláció. Csak ha szerzett hosszú QT-ről van szó: béta-adrenerg stimuláció izoproterenollal
6. Ha ezek nem használnak, akkor a túlhajtásos pacing, általában 100 körüli frekvenciával, hogy megakadályozzuk a szüneteket, szinte mindig működik (a transzkután pacing jó átmeneti enyhülésre, mint híd a transzvénás pacinghoz).
7. A Lidocain is hasznos lehet, mert elnyomhatja a PVC-ket (korai afterdepolarizáció), amelyek torsádot indítanak el, ha a T-hullámon jelentkeznek.
8. Az amiodaron előnye megkérdőjelezhető, és esetlegesen ártalmas. Önmagában meghosszabbítja a QT-intervallumot, bár anélkül, hogy jelentősen növelné a torsádok kockázatát
9. Ne adjunk béta-blokkolókat, kivéve, ha a betegnél veleszületett hosszú QT-periódus diagnózisa áll fenn. Éppen ellenkezőleg: izoproterenol.
10. Ha veleszületett , akkor akut béta-blokád indikálható. Én először esmolollal próbálkoznék, mivel az kikapcsolható. Viszont nincs béta-2 blokádja, és nem világos számomra, hogy ez fontos és/vagy szükséges. Ha az esmolol nem használ, akkor intravénás propranololt kell adni. A propranolol és a nadolol a legjobb hosszú távú béta-blokkolók veleszületett hosszú QT esetén, a béta-1 szelektív metoprolol nem túl hatékony. Hogy ez a béta-szelektivitás miatt van-e, nem világos számomra.
Itt van egy lenyűgöző eset veleszületett hosszú QT-ről Torsade-val. Nagyszerű vita van a béta-blokád szerepéről és funkciójáról a veleszületett hosszú QT-ben.
Az akut nem torsade PMVT terápiája: hasonló a monomorf VT-hez
1. Kardioverzió vagy defibrilláció, ha aktív
2. Az elektrolit rendellenességek, különösen a hypoK vagy hypoMg korrigálása
3. A további epizódok megelőzése lidokainnal vagy amiodaronnal, esetleg béta-blokkolóval, például esmolollal (amit minden szerzett hosszú QT Torsade esetén kerülni kellene).
4. Anti-ischaemiás terápiák, egészen a revaszkularizációig bezárólag
5. Beültethető kardioverter-defibrillátor még sikeres revaszkularizáció esetén is szükséges lehet
Vissza az esetünkhöz
A kardioverzió csak akkor javallott, ha a beteg torsádban van, és csak átmenetileg fog működni, mivel a beteg ki-be jár a ritmusból. A további epizódok megelőzése alapvető fontosságú.
Ebben az esetben csak a PVC-ken látunk hosszú QT-t, de a natív RBBB-ütésekben nem. Gyakran a torsades “szünetfüggő”, és csak a hosszú szünetet követő komplexben látható. Mellkasi fájdalom nincs, és a szinusz EKG-komplexeken nem találunk iszkémiára utaló jeleket. Ahhoz, hogy a polimorf VT iszkémiára legyen visszavezethető, általában van valamilyen egyértelmű EKG-lelet az iszkémiára. Mindez tehát torsadesre utal, de nem diagnosztikus. A beteg nem szedett olyan ismert gyógyszert, amely meghosszabbítja a QT-intervallumot. Csak Graves-betegség volt a kórtörténetében, és arról számolt be, hogy minden gyógyszert abbahagyott.
Amikor nincs VT, a vérnyomás 190/80-ra emelkedett, a tapintható pulzus 90, az oxigénszaturáció 99.
A kezdeti K normálisnak bizonyult. A Mg-szint ekkor még nem volt ismert.
T = 12 perckor 2 gramm intravénás magnéziumot adtak.
T = 13 perckor 150 mg amiodaront adtak
T = 15 perckor 100 mg lidokaint adtak
T = 30 perckor nem volt javulás, és esmolol bolust és cseppet adtak. Isoproterenolt kell adni.
A katéteres laboratóriumot aktiválták. Újabb 2 gramm intravénás magnéziumot adtak.
t = 64 perc: A K visszatér 2,4 mEq/L-re (a kezdeti érték téves volt). Ez még erősebben utal Torsade-ra. KCl-t adtak a centrális vonalba. Amiodaron csepegtetés megkezdve. Rektális aszpirin adása.
t = 79 perc: Prokainamid 1500 mg 2 perc alatt. (A prokainamid hasznos lehet a nem-torsádos PMVT-ben, de valószínűleg meghosszabbítja a QT-t és instabilabbá teszi a torsádot. Emellett erős negatív inotróp, és rossz LV-funkció esetén veszélyes lehet.)
t = 97 perc: a beteget katéterlaborba vitték:
A beteget katéterlaborba vitték, és pacemakert helyeztek el. A ritmust túlhajtásos pacerezéssel rögzítették, majd lelassították. Diffúz koszorúér-betegség volt, de nem volt culprit lézió (nem volt akut koszorúér-szindróma). A troponin negatív volt.
Megállapították, hogy a beteg metadont szedett és metadontoxikus volt. Ez az egyik a sok gyógyszer közül, amely hosszú QT-t okoz. Ez Torsade de Pointes volt a metadon és a hipokalémia miatti hosszú QT miatt.
Itt a 12 elvezetés pacing alatt:
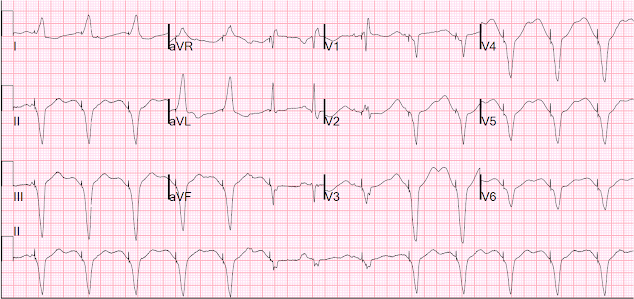
Pacing alatt
Itt egy másik a pacer kikapcsolásával, másnap:
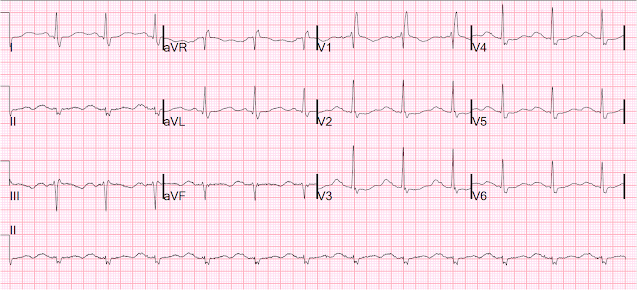
Sinus RBBB-vel és nagyon hosszú QT-vel
És a negyedik napon:
T-hullám inverzió, QT még mindig hosszú
A metadon rendkívül hosszú felezési ideje miatt napokig tartott, amíg a QT rövidült. Végül a beteg jól gyógyult.
Kommentár az izoproterenol alkalmazásáról veleszületett hosszú QT esetén:
Elektrofiziológusunknak (Rehan Karim) ezt a kérdést tettem fel:
“Biztos akarok lenni abban, hogy jól értem:
A veleszületett hosszú QT esetén a béta-blokkolás krónikusan javallott, és egy visszatérő VT-s betegnek, aki kórházban van, NEM adnánk izoproterenolt.
Csak a szerzett hosszú QT “szünetfüggő” és gyorsabb szívfrekvenciával javul, és béta-blokád NEM javallott. Inkább az izoproterenol javallott (és a túlhajtásos pacing).”
Kijavítana ebben?”
Más szavakkal:
Itt a válasza:
“Bárcsak elég világosak lennének a dolgok ahhoz, hogy mindent algoritmikus formátumba foglaljak… de sajnos nem ez a helyzet.”
Az tényleg attól függ, hogy milyen típusú veleszületett hosszú QT-vel van dolgunk, és még ha tudjuk is – a dolgok nem olyan egyértelműek.
Itt egy példa:
A veleszületett hosszú QT 3. típus egy nátriumcsatorna mutáció (SCN5A) – ami ugyanaz a gén, mint a Brugada-szindróma.
A hosszú QT 3. típusnál valóban van szünetfüggő Torsades. A béta-blokkolókat azonban még mindig használják ebben a helyzetben (miután természetesen pitvari pacingot vezettek be a bradycardia megelőzésére) – ez elsősorban a béta-blokkolók QT-diszperziót csökkentő hatása miatt van így.
Még bonyolultabb… az I-B osztályú nátriumcsatorna-blokkolót (Mexiletine) néha használják LQT-3 esetén.
Tudomásom szerint a béta-blokkolók valószínűleg nem olyan hatékonyak LQT-3 esetén, mint más formáknál – de még mindig használják.
Ezért nem hiszem, hogy a jelenlegi tudásunkkal igen/nem választ lehetne adni – a dolgokat klinikai perspektívában kell vizsgálni.
Ha valakinek egyértelműen szünetfüggő torsádja van, és nem pacedizálják – NEM fogok béta-blokkolót használni, hanem inkább izoproterenollal próbálom növelni a frekvenciát.
Dr. Karim hozzátette:
ez az egyik legzavaróbb téma – valójában a legtöbb genetikai aritmiát / chanellopátiát elég nagy kihívás klinikailag kezelni. Annyira hozzászoktunk, hogy több ezer beteg adatait látjuk a kardiológiai vizsgálatokban – és aztán olyan helyzetekbe kerülünk, ahol a betegségteher nem elég nagy ahhoz, hogy a nagy klinikai központok regiszterein kívül más adatokat kapjunk.