Une femme d’une quarantaine d’années a présenté de multiples « crises » au cours de la semaine passée, avec une fréquence croissante. Elle se sent étourdie, puis devient insensible. Cela dure généralement environ une minute puis se résout. Elle n’a pas eu de douleur thoracique. Elle a des antécédents de crises d’épilepsie dans son enfance, mais il n’y a pas d’activité épileptique pendant ces crises.
Le moniteur montre ceci :

Tachycardie ventriculaire, fréquence d’environ 220 battements par minute
Pendant ce rythme, elle était éveillée, protégeant ses voies respiratoires, avec une pâleur, une diaphorèse et des extrémités froides. Les pouls étaient présents. Il n’y avait pas de détresse respiratoire.
Un ECG à 12 dérivations a été enregistré :
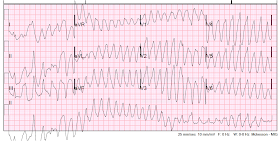
VT, et c’est une VT « Polymorphe » car il y a plusieurs morphologies aux complexes. La fréquence est à nouveau d’environ 220. La TV polymorphe est soit torsade (associée à un intervalle QT long), soit non torsade (QT non long, souvent dû à une ischémie)
Sur le moniteur, elle s’est spontanément convertie à un rythme différent, et un autre 12-lead a été obtenu :

Il y a une bigéminité. Les complexes étroits sont précédés par des ondes P. Le QRS associé aux battements sinusaux présente un bloc de branche droit (RBBB), et ne semble pas avoir d’intervalles QT très longs (j’ai calculé 400ms QT divisé par la racine carrée de l’intervalle R-R précédent = 460ms). Les complexes ventriculaires (PVC) intermédiaires semblent très bizarres avec un long QT. Les PVC ont une grande élévation ST (II, III, aVF) avec une dépression ST réciproque (aVL, précordiale), suggérant un STEMI inféropostérieur, mais il s’agit clairement d’une mimique car les complexes sinusaux intermédiaires n’ont pas d’élévation ST.
Elle est retournée en tachycardie :
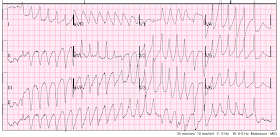
VT polymorphe à nouveau.
Que faut-il faire ?
D’abord, de quel type de VT s’agit-il ? VT polymorphe. Le PMVT est défini comme un rythme ventriculaire large complexe à une fréquence supérieure à 100 avec un axe QRS et/ou une morphologie qui change rapidement.
TV polymorphe
Étiologie
La TV polymorphe est soit des torsades de pointe (associées à un QT long sur l’ECG 12 dérivations de base), soit des non-torsades (généralement associées à une ischémie ou à une autre cardiopathie organique). La présence d’un allongement de l’intervalle QT sur l’ECG à 12 dérivations de base n’est pas toujours évidente. Torsade de pointes signifie « torsion des points » et fait référence au changement d’axe autour d’une ligne isoélectrique.
La morphologie de la TPMV (c’est-à-dire la présence d’une torsion des points) ne permet pas à elle seule de distinguer la TPMV due à un QT long (torsades) de celle due à d’autres étiologies (non-torsades). Il est pratiquement impossible de distinguer la TPMV sans pouls de la fibrillation ventriculaire, et des études ont montré que la majorité des rythmes sans pouls qui semblent être des torsades (avec « torsion des points ») sont en réalité une fibrillation ventriculaire. Cette distinction n’a pas d’implications pour la prise en charge immédiate (défibrillation) mais elle a des implications importantes pour prévenir d’autres dysrythmies.
Torsades Étiologies de la TPMV
1. Acquises : dues généralement à des médicaments. La liste est longue. Également due à des anomalies électrolytiques, en particulier l’hypoK et l’hypoMg. L’intervalle QT corrigé (correction de Bazett = QT divisé par la racine carrée de l’intervalle R-R précédent en millisecondes) est généralement supérieur à 600 ms. Les torsades dans un QT long acquis sont beaucoup plus probables en cas de bradycardie, car l’intervalle QT suivant une longue pause est encore plus long. Ainsi, les torsades sur QT long acquis sont dites « dépendantes de la pause » : s’il y a un battement sinusal après une longue pause (qui crée un intervalle QT plus long), alors une PVC précoce (« post-dépolarisation précoce », EAD) est beaucoup plus susceptible de se produire pendant la repolarisation et de déclencher des torsades. La séquence habituelle est la suivante : battement sinusal, puis PVC précoce, puis une longue pause parce que la PVC était précoce, ce qui entraîne alors un QT particulièrement long, puis une autre PVC avec « R sur T » qui initie des torsades.
2. Congénital, notamment le syndrome du QT long congénital. La TPMV instable due à un long QT congénital est beaucoup plus rare. (En 26 ans d’EM et 125 000 patients, je n’ai jamais vu un cas de torsade PMVT due à un long QT congénital). Les causes congénitales de torsade incluent la « PMVT catécholaminergique », dans laquelle il n’y a pas d’allongement visible de l’intervalle QT sur le tracé à 12 dérivations, mais on pense qu’elle a une étiologie similaire. Le traitement préventif du QT long congénital comprend l’utilisation de bêtabloquants (idem pour le PMVT catécholaminergique, car dans les deux cas, la stimulation bêta provoque la torsade) ; on distingue ainsi le QT long acquis, qui peut être traité par stimulation bêta (isopréténol).
Je n’ai pas trouvé de recommandations pour utiliser des bêtabloquants pour la gestion aiguë de la torsade dans ce groupe, mais il est presque impossible de dire si l’isopréténol aggravera ou améliorera les choses pour un patient donné avec un long QT congénital (voir le commentaire de notre électrophysiologiste à la fin). Il semble que la plupart des patients symptomatiques avec un QT long congénital se présentent après une syncope, ou une fibrillation ventriculaire réanimée, et présentent rarement une torsade continue ou une instabilité. Ainsi, la prise en charge de ces patients consiste principalement à reconnaître et à prévenir les syncopes et les morts subites cardiaques futures, généralement à l’aide d’un débribrillateur implantable en plus des bêtabloquants. Les torsades dues à un long QT congénital peuvent être induites par l’utilisation de médicaments allongeant le QT.
Etiologies non-torsades de la TPMV
Le plus souvent dues à l’ischémie. Il s’agira presque toujours d’épisodes d’ischémie manifestes et sévères, avec des douleurs thoraciques et/ou des anomalies ECG ischémiques non équivoques. Également dus à une cardiomyopathie préexistante.
Gestion des TV polymorphes
La plupart des torsades sont autolimitées. Si elle ne se convertit pas spontanément, alors elle nécessite une défibrillation si le patient est instable. Si elle se convertit, alors elle est susceptible de récidiver, et le traitement vise à prévenir la récidive.
Traitement des épisodes aigus de torsades :
1. Cardioversion ou défibrillation si elle est active, surtout si elle est instable
2. Élimination de l’agent offensif en cas de QT long acquis
3. Correction de l’hypoK, même à des niveaux légèrement supranormaux
4. Administration de 2-4g de MgSO4 même si le taux de Mg est normal (une perfusion de 3-10 mg par minute peut être utile)
5. Seulement s’il s’agit d’un QT long acquis : stimulation bêta-adrénergique avec de l’isoprotérénol
6. Si ces mesures ne fonctionnent pas, la stimulation surmultipliée, généralement à une fréquence d’environ 100 pour empêcher toute pause, fonctionnera presque toujours (la stimulation transcutanée est très bien pour un soulagement temporaire en tant que pont vers la stimulation transveineuse).
7. La lidocaïne peut également être bénéfique car elle peut supprimer les PVC (post-dépolarisations précoces) qui initient la torsade si elles se produisent sur l’onde T.
10. Si c’est congénital, alors un bêta-blocage aigu peut être indiqué. J’essaierais d’abord l’esmolol, car il peut être désactivé. Cependant, il n’a pas de bêta-2 blocage et il n’est pas clair pour moi si cela est important et/ou nécessaire. Si l’esmolol ne fonctionne pas, il faut alors administrer du propranolol par voie intraveineuse. Le propranolol et le nadolol sont les meilleurs bêtabloquants à long terme pour le QT long congénital et le métoprolol, un bêtasélectif, n’est pas très efficace. Je ne sais pas si cela est dû à la sélectivité bêta.
Voici un cas fascinant de QT long congénital avec torsade. Il y a une grande discussion sur le rôle et la fonction du bêta-blocage dans le long QT congénital.
Thérapie du PMVT aigu sans torsade : similaire à la VT monomorphe
1. Cardioversion ou défibrillation si elle est active
2. Correction des désordres électrolytiques, en particulier l’hypoK ou l’hypoMg
3. Prévention de nouveaux épisodes avec de la lidocaïne ou de l’amiodarone, éventuellement un bêtabloquant comme l’esmolol (que vous éviterez dans toutes les torsades acquises à QT long).
4. Thérapies anti-ischémiques, pouvant aller jusqu’à la revascularisation
5. Le cardioverteur-défibrillateur implantable peut être nécessaire même en cas de revascularisation réussie
Retour à notre cas
La cardioversion n’est indiquée que lorsque le patient est en torsade, et ne fonctionnera que temporairement, car le patient entre et sort du rythme. La prévention de nouveaux épisodes est essentielle.
Dans ce cas, nous ne voyons un QT long que sur les PVC, mais pas dans les battements natifs du RBBB. Souvent, les torsades sont « dépendantes de la pause » et ne peuvent être vues que dans un complexe qui suit une longue pause. Il n’y a pas de douleur thoracique, et nous n’avons pas de preuve d’ischémie sur les complexes de l’ECG sinusal. Pour que la TV polymorphe soit due à une ischémie, il y a généralement des résultats ECG non équivoques d’ischémie. Tout ceci est donc suggestif de torsades, mais pas diagnostique. La patiente ne prenait aucun médicament connu pour allonger l’intervalle QT. Elle a seulement des antécédents de maladie de Graves et signale qu’elle a cessé de prendre tous les médicaments.
Lorsqu’elle n’est pas en TV, sa TA est élevée à 190/80 avec un pouls palpable de 90 et une saturation en oxygène de 99.
Un K initial est revenu normal. Le taux de Mg était inconnu à ce stade.
À t = 12, 2 grammes de magnésium IV ont été administrés.
À t = 13 minutes, 150 mg d’amiodarone ont été administrés
À t = 15 minutes, 100 mg de lidocaïne ont été administrés
À t = 30 minutes, il n’y a pas eu d’amélioration et un bolus et une perfusion d’esmolol ont été administrés. Il faut donner de l’isoprotérénol.
Le laboratoire de cathétérisme a été activé. Un autre 2 grammes de magnésium IV a été donné.
t = 64 minutes : Le K revient à 2,4 mEq/L (la valeur initiale était erronée). Cela suggère encore plus fortement une torsade. KCl donné dans la ligne centrale. Début de la perfusion d’amiodarone. Aspirine administrée par voie rectale.
t = 79 minutes : Procaïnamide 1500 mg sur 2 minutes. (La Procaïnamide peut être utile dans les PMVT sans torsade, mais elle est susceptible d’allonger le QT et de rendre les torsades plus instables. C’est également un inotrope négatif puissant et pourrait être dangereux en cas de mauvaise fonction du ventricule gauche.)
t = 97 minutes : patient emmené au laboratoire de cathétérisme :
Le patient a été emmené au laboratoire de cathétérisme et un stimulateur a été placé. Le rythme a été capturé avec une stimulation overdrive, puis ralenti. Il y avait une maladie coronaire diffuse, mais pas de lésion coupable (pas de syndrome coronarien aigu). La troponine était négative.
On a découvert que le patient était sous méthadone et qu’il était toxique à la méthadone. C’est l’un des nombreux médicaments qui provoque un QT long. Il s’agissait d’une torsade de pointes due à un QT long dû à la méthadone et à l’hypokaliémie.
Voici le 12-lead pendant la stimulation:
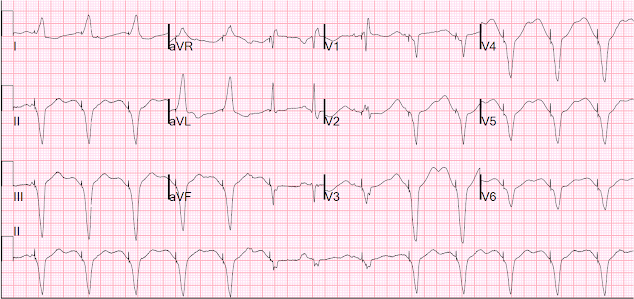
During Pacing
Voici un autre avec le stimulateur éteint, le jour suivant:
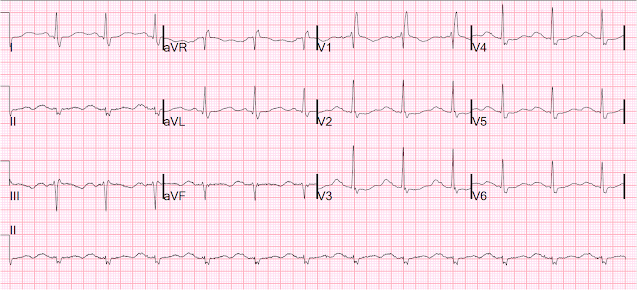
Sinus avec RBBB et QT très long
Et puis le quatrième jour :
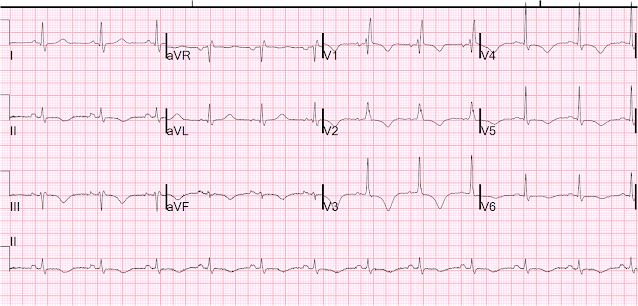
Inversions des ondes T, QT encore long
En raison de la demi-vie extraordinairement longue de la méthadone, il a fallu des jours pour que le QT se raccourcisse. En fin de compte, le patient s’en est bien sorti.
Commentaire sur l’utilisation de l’isoprotérénol dans le QT long congénital :
J’ai posé cette question à notre électrophysiologiste (Rehan Karim) :
« Je veux être certain d’avoir bien compris :
Pour le QT long congénital, le bêta-blocage est indiqué de façon chronique, et pour un patient avec une TV récurrente qui est à l’hôpital, on ne donnerait PAS d’isoprotérénol.
Seul le QT long acquis est « dépendant de la pause » et amélioré avec une fréquence cardiaque plus rapide, et le bêta-blocage n’est PAS indiqué. C’est plutôt l’isoprotérénol qui est indiqué (et la stimulation de surmultiplication).
Pouvez-vous me corriger sur ce point ? »
En d’autres termes :
Voici sa réponse :
« J’aimerais que les choses soient suffisamment claires pour tout mettre dans un format algorithmique… mais malheureusement ce n’est pas le cas. »
Cela dépend vraiment du type de QT long congénital auquel vous avez affaire, et même si vous le savez – les choses ne sont pas aussi simples.
Voici un exemple :
Le long QT congénital de type 3 est une mutation du canal sodique (SCN5A) – qui est le même gène que le syndrome de Brugada.
Le long QT de type 3 présente effectivement des torsades dépendantes de la pause. Cependant, les bêtabloquants sont toujours utilisés dans cette situation (après bien sûr que la stimulation auriculaire ait été instituée pour prévenir la bradycardie) – ceci principalement pour l’effet des bêtabloquants sur la diminution de la dispersion du QT.
Encore plus compliqué… le bloqueur des canaux sodiques de classe I-B (Mexilétine) est parfois utilisé pour le LQT-3.
À ma connaissance, les bêtabloquants ne sont probablement pas aussi efficaces dans le LQT-3 que dans les autres formes – mais ils sont toujours utilisés.
Donc, je ne pense pas qu’il soit possible d’arriver à une réponse Oui/Non avec les connaissances que nous avons à l’heure actuelle – les choses doivent être prises dans une perspective clinique.
Si quelqu’un a clairement des torsades dépendantes de la pause, et qu’il n’est pas stimulé – je n’utiliserai PAS de bêta-bloquant, mais j’essaierai plutôt d’augmenter la fréquence en utilisant l’isoprotérénol.
Le Dr Karim a ajouté :
c’est l’un des sujets qui prêtent à confusion – en fait, la plupart des arythmies génétiques / chanellopathies sont assez difficiles à gérer cliniquement. Nous sommes tellement habitués à voir les données de milliers de patients dans les essais cardiologiques – et puis nous arrivons dans de telles situations où le fardeau de la maladie n’est pas assez énorme pour nous donner des données autres que les registres des grands centres cliniques.