A klór kémiai elem a halogének közé sorolt nemfém. Carl Wilhelm Scheele fedezte fel 1774-ben.

Adatok zónája
| Besorolás: | A klór halogén és nem fém | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Szín: | zöldessárga | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomtömeg: | 35.453 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Állapot: | gáz | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Olvadáspont: | -101 oC , 172 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Forráspont: | -34 oC , 239 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronok: | 17 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Protonok: | 2,8,7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguráció: | 1s2 2s2 2p6 3s2 3p5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sűrűség 20oC-on: | 0. Hő, energiák, oxidáció, reakciók, Vegyületek, sugarak, vezetőképességek

Klór kémcsőben (Fotó: Ben Mills) 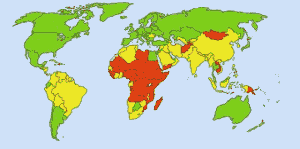
Tiszta ivóvíz: Image: Ionut_Cojocaru. A zöldövezetekben mindenki biztonságos vízhez juthat. A piros területeken az emberek legalább 25 százaléka nem jut kezelt vízhez. A sárga területek köztes állapotúak. Mielőtt az Egyesült Államok vízellátásában rutinszerűen használták volna a klórt, a tífusz évente 25 000 halálos áldozatot követelt. Ma a közüzemi vízellátás 98%-át klórral vagy klórvegyülettel kezelik. A tífusz ma már évente átlagosan egy áldozatot követel. (4) 
Carl Wilhelm Scheele, aki 1774-ben felfedezte a klórt. A klór felfedezéseDr. Doug Stewart
A klórt először 1774-ben Carl Wilhelm Scheele állította elő Svédországban. Scheele összegyűjtötte a pirolusit és a spiritus salis – egy alkímiai kifejezés, amely a só szellemét/lélegzetét jelenti – reakciójából felszabaduló gázt. Az új gáznak Scheele szerint “nagyon érezhető, fullasztó szaga volt, amely a tüdő számára igen nyomasztó… és a víznek enyhén savas ízt ad… a benne lévő levegő sárga színt kap…”. (1) Scheele megjegyezte az általa előállított új gáz nagyfokú reakcióképességét és fehérítő tulajdonságait is: “…minden fémet megtámadott… a rögzített lúgot konyhasóvá alakította át… minden növényi virág – piros, kék és sárga – rövid idő alatt fehérré vált; ugyanez történt a zöld növényekkel is… a rovarok azonnal elpusztultak. (1) Megfigyeléseinek pontossága ellenére Scheele tévesen úgy gondolta, hogy az új gáz a muriasav deflozált formája. A híres francia kémikus, Antoine Lavoisier úgy vélte, hogy az új gázt a még fel nem fedezett murium elem alapján oxymuriasavnak kellene nevezni. (2) * A klór valódi kilétével kapcsolatos zavart a flogiszton-elmélet okozta; a flogisztont a kémikusok az 1700-as évek nagy részében elfogadták – amíg maga Lavoisier meg nem cáfolta azt. A flogiszton egy “anyag” volt, amelyet az akkor megmagyarázhatatlan megmagyarázására használtak. Kényelmes módon negatív súlya volt, amikor kellett, és olyan reakciókat “magyarázott”, mint a rozsdásodás és az égés. Lavoisier volt a flógiszton bukásának építésze, aki kimutatta, hogy az oxigén kémiai reakciókban jobb magyarázatot ad, mint a flógiszton. (3) 1810-re tudományos konszenzus alakult ki arról, hogy a ma klórnak nevezett elem valójában egy oxigént tartalmazó vegyület. Sir Humphry Davy angol kémikus úgy találta, hogy a konszenzus téves; nem tudta az új sárgászöld gázt reakcióba hozni egy szénelektróddal, ami arra engedte következtetni, hogy az nem tartalmazhat oxigént. Foszforral és ammóniával végzett reakciókban bebizonyította, hogy az új gáz nem tartalmaz oxigént. Egy hatalmas, 2000 lemezes voltaelektródát használt, hogy megnézze, ki tudja-e vonni az oxigént a gáz foszfor- és kénvegyületeiből, de ismét nem talált oxigént. (1a) 1811-ben Davy arra a következtetésre jutott, hogy az új gáz valójában egy új elem. (1b) Klórnak nevezte el, a görög “chloros” szóból, ami halványzöldet vagy sárgászöldet jelent. Érdekes tények a klórról
 A klórt sósav és kálium-permanganát reakciójával állították elő.
megjelenés és jellemzőkÁrtalmas hatások: A klór mérgező gáz, amely irritálja a bőrt, a szemet és a légzőszerveket. Jellemzők: A klór zöldessárga, kétatomos, sűrű gáz, amelynek éles szaga van (a fehérítő szaga). A természetben nem fordul elő szabadon, mivel szinte minden más elemmel könnyen egyesül. A klór a természetben főleg konyhasó (NaCl), karnallit , és szilvit (KCl) formájában fordul elő. Folyékony és szilárd formában erős fehérítő, oxidáló és fertőtlenítő szer. A klór felhasználásaA klórt biztonságos ivóvíz előállítására használják. A klórvegyületeket főleg a higiénia, a cellulóz fehérítése, a fertőtlenítés és a textilfeldolgozás területén használják. A klórt klorátok előállítására is használják, és fontos szerepet játszik a szerves kémiában, olyan vegyületeket alkotva, mint a kloroform, a szén-tetraklorid, a polivinil-klorid és a szintetikus gumi. A klórvegyületek egyéb felhasználási területei közé tartoznak a színezékek, kőolajtermékek, gyógyszerek, fertőtlenítőszerek, rovarirtók, élelmiszerek, oldószerek, festékek és műanyagok. Bőség és izotópokBőség földkéreg: 145 rész/millió tömeg, 85 rész/millió mól Bőség Naprendszer: 8 rész/millió tömeg, 0,3 rész/millió mól Költség, tisztán: 0,15 $/100g Költség, ömlesztve: $/100g Forrás: A klórgázt kereskedelmi forgalomban nátrium-klorid (NaCl) elektrolízisével állítják elő tengervízből vagy sóbányákból származó sóoldatból. Izotópok: A klórnak 16 izotópja van, amelyek felezési ideje ismert, tömegszámai 31-től 46-ig terjednek. A természetben előforduló klór két stabil izotópjának, a 35Cl-nek és a 37Cl-nek a keveréke, amelyek természetes gyakorisága 75,8%, illetve 24,3%. 
Cite this PageOnline hivatkozáshoz, kérjük, másolja be az alábbiak egyikét: <a href="https://www.chemicool.com/elements/chlorine.html">Chlorine</a> vagy <a href="https://www.chemicool.com/elements/chlorine.html">Chlorine Element Facts</a> Az oldal tudományos dokumentumban való idézéséhez, kérjük, használja a következő MLA-konform idézést: "Chlorine." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/chlorine.html>. . |