L’elemento chimico cloro è classificato come alogeno e un non metallo. Fu scoperto nel 1774 da Carl Wilhelm Scheele.

Data Zone
| Classificazione: | Il cloro è un alogeno e un non metallo |
| Colore: | giallo-verde |
| Peso atomico: | 35.453 |
| Stato: | gas |
| Punto di fusione: | -101 oC , 172 K |
| Punto di ebollizione: | -34 oC , 239 K |
| Elettroni: | 17 |
| Protoni: | 17 |
| Neutroni nell’isotopo più abbondante: | 18 |
| Gusci di elettroni: | 2,8,7 |
| Configurazione degli elettroni: | 1s2 2s2 2p6 3s2 3p5 |
| Densità @ 20oC: | 0.003214 g/cm3 |
Mostra di più, tra cui: Calori, Energie, Ossidazione, Reazioni,
Composti, Raggi, Conducibilità
| Volume atomico: | 22,7 cm3/mol |
| Struttura: | strati di Cl2 nel solido |
| Durezza: | |
| Capacità termica specifica | 0,48 J g-1 K-1 |
| Calore di fusione | 6.406 kJ mol-1 di Cl2 |
| Calore di atomizzazione | 122 kJ mol-1 |
| Calore di vaporizzazione | 20.41 kJ mol-1 di Cl2 |
| 1a energia di ionizzazione | 1251,1 kJ mol-1 |
| 2a energia di ionizzazione | 2297.3 kJ mol-1 |
| 3a energia di ionizzazione | 3821.8 kJ mol-1 |
| Affinità elettronica | 349 kJ mol-1 |
| Numero minimo di ossidazione | -1 |
| Min. numero di ossidazione comune | -1 |
| Numero massimo di ossidazione | 7 |
| Numero massimo di ossidazione comune | 7 |
| Elettronegatività (Scala Pauling) | 3.16 |
| Volume di polarizzabilità | 2.2 Å3 |
| Reazione con aria | nessuna |
| Reazione con 15 M HNO3 | lieve, ⇒ HClOx, NOxCl, NOx |
| Reazione con 6 M HCl | lieve, ⇒ HOCl, Cl- |
| Reazione con 6 M NaOH | leggera, ⇒ OCl-, Cl- |
| Ossido(i) | Cl2O, ClO2, Cl2O7 |
| Idruro(i) | HCl |
| Cloruro(i) | Cl2 |
| Raggio atomico | 100 pm |
| Ionico raggio (1+ ione) | – |
| Raggio ionico (2+ ione) | – |
| Raggio ionico (3+ ione) | – |
| Raggio ionico (1- ione) | 167 pm |
| Raggio ionico (2-ione) | – |
| Raggio ionico (3-ione) | – |
| Conducibilità termica | 0.0089 W m-1 K-1 |
| Conducibilità elettrica | – |
| Punto di congelamento/fusione: | -101 oC , 172 K |

Cloro in provetta (Foto: Ben Mills)
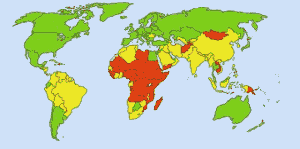
Acqua potabile sicura: Immagine: Ionut_Cojocaru. Nelle aree verdi tutti possono avere acqua sicura. Nelle aree rosse, almeno il 25% delle persone non può avere acqua trattata. Le aree gialle sono intermedie. Prima dell’uso di routine del cloro nelle forniture d’acqua degli Stati Uniti, la febbre tifoidea mieteva 25 000 vittime ogni anno. Oggi il 98% delle forniture di acqua pubblica sono trattate con cloro o un composto di cloro. La febbre tifoidea oggi miete circa una vittima all’anno, in media. (4)

Carl Wilhelm Scheele, che scoprì il cloro nel 1774.
Scoperta del cloro
Il cloro fu prodotto per la prima volta nel 1774 da Carl Wilhelm Scheele in Svezia. Scheele raccolse il gas rilasciato dalla reazione della pirolusite con lo spiritus salis – un termine alchemico che significa spirito/respiro di sale. Il nuovo gas aveva, secondo Scheele, “un odore soffocante molto percettibile, che era molto opprimente per i polmoni… e dà all’acqua un sapore leggermente acido… l’aria in esso acquista un colore giallo…” (1)
Scheele notò anche l’alta reattività e le qualità sbiancanti del nuovo gas che aveva fatto: “…tutti i metalli furono attaccati… l’alcali fisso fu convertito in sale comune… tutti i fiori vegetali – rossi, blu e gialli – divennero bianchi in breve tempo; la stessa cosa accadde anche con le piante verdi… gli insetti morirono immediatamente. (1)
Nonostante l’accuratezza delle sue osservazioni, Scheele pensava erroneamente che il nuovo gas fosse una forma dephlostiganata di acido muriatico.
Il famoso chimico francese Antoine Lavoisier credeva che il nuovo gas dovesse essere chiamato acido ossimuriatico sulla base dell’elemento ancora da scoprire murium. (2)
* La confusione sulla vera identità del cloro fu causata dalla teoria del flogisto; il flogisto era stato accettato dai chimici per la maggior parte del 1700 – fino a quando Lavoisier stesso non lo sfatò. Il flogisto era una “sostanza” usata per spiegare l’allora inspiegabile. Convenientemente, aveva un peso negativo quando era necessario, e ‘spiegava’ reazioni come la ruggine e la combustione.
Lavoisier fu l’architetto della caduta del flogisto, dimostrando che la chimica dell’ossigeno era una spiegazione migliore nelle reazioni chimiche di quanto lo fosse il flogisto. (3)
Nel 1810 il consenso scientifico era che l’elemento che ora chiamiamo cloro era in realtà un composto che conteneva ossigeno. Il chimico inglese Sir Humphry Davy scoprì che il consenso era sbagliato; non riusciva a far reagire il nuovo gas giallo-verde con un elettrodo di carbone, il che gli fece credere che potesse non contenere ossigeno. In reazioni con fosforo e ammoniaca, dimostrò che il nuovo gas non conteneva ossigeno. Usò un’enorme pila voltaica da 2000 piastre per vedere se poteva estrarre l’ossigeno dai composti di fosforo e zolfo del gas, ma di nuovo non trovò ossigeno. (1a)
Nel 1811, Davy concluse che il nuovo gas era in realtà un nuovo elemento. (1b) Lo chiamò cloro, dalla parola greca ‘chloros’, che significa verde pallido o giallo-verde.
Fatti interessanti sul cloro
- La prima reazione a catena scoperta non era una reazione nucleare; era una reazione chimica a catena. Fu scoperta nel 1913 da Max Bodenstein, che vide una miscela di gas di cloro e idrogeno esplodere se innescata dalla luce. Il meccanismo della reazione a catena fu completamente spiegato nel 1918 da Walther Nernst.
- Gli oceani della Terra contengono una grande quantità di cloro. Se questo cloro venisse rilasciato come gas, il suo peso sarebbe 5 volte superiore a quello dell’attuale atmosfera terrestre. (I nostri oceani contengono circa 2,6 x 1016 tonnellate metriche di cloro, principalmente come cloruro di sodio.)
- Il cloro non è solo abbondante nei nostri oceani; è il sesto elemento più abbondante nella crosta terrestre.
- L’esposizione a piccole quantità di cloro, anche per un breve periodo, può essere mortale. Le morti sono previste a 1 parte su mille di cloro nell’aria (o a volte a concentrazioni ancora più basse). (5)
- Il cloro è più pesante dell’aria. Quando viene rilasciato, forma una coltre velenosa che va alla deriva con il vento. Il cloro fu usato come arma chimica nella prima guerra mondiale, prima nel 1915 dall’esercito tedesco e poi dagli alleati occidentali. Non fu così “efficace” come si sperava, perché il cloro è facilmente individuabile dal suo forte odore. È anche solubile in acqua, e così i soldati potevano proteggersi dai suoi effetti peggiori respirando attraverso panni umidi.

Apparenza e caratteristiche
Effetti nocivi:
Il cloro è un gas tossico che irrita la pelle, gli occhi e il sistema respiratorio.
Caratteristiche:
Il cloro è un gas giallo-verdastro, biatomico, denso, con un odore acuto (l’odore della candeggina).
Non si trova libero in natura poiché si combina facilmente con quasi tutti gli altri elementi.
Il cloro si presenta in natura principalmente come sale comune (NaCl), carnallite e silvite (KCl).
Nella sua forma liquida e solida è un potente agente sbiancante, ossidante e disinfettante.
Usi del cloro
Il cloro è usato per produrre acqua potabile sicura.
I composti clorurati sono usati principalmente per la sanificazione, lo sbiancamento della polpa, i disinfettanti e la lavorazione tessile.
Il cloro è anche usato per la produzione di clorati ed è importante nella chimica organica, formando composti come il cloroformio, il tetracloruro di carbonio, il cloruro di polivinile e la gomma sintetica.
Altri usi dei composti del cloro includono coloranti, prodotti petroliferi, medicine, antisettici, insetticidi, prodotti alimentari, solventi, vernici e plastiche.
Abbondanza e isotopi
Abbondanza crosta terrestre: 145 parti per milione in peso, 85 parti per milione in mole
Abbondanza sistema solare: 8 parti per milione in peso, 0.3 parti per milione in mole
Costo, puro: $0.15 per 100g
Costo, sfuso: $ per 100g
Fonte: Il gas di cloro è prodotto commercialmente dall’elettrolisi del cloruro di sodio (NaCl) dall’acqua di mare o dalla salamoia delle miniere di sale.
Isotopi: Il cloro ha 16 isotopi la cui emivita è nota, con numeri di massa da 31 a 46. Il cloro presente in natura è una miscela dei suoi due isotopi stabili 35Cl e 37Cl con abbondanze naturali del 75,8% e 24,3% rispettivamente.

- Henry M. Leicester, Herbert S. Klickstein, A Source Book in Chemistry, 1400-1900., (1969) Harvard University Press. p111; 1a. p241.; 1b. p257.
- J.W. Mellor, A Comprehensive Treatise on Inorganic and Theoretical Chemistry., 1922, vol 2, Longmans, Green and Co., p21.
- Antoine Lavoisier, Memoires de l’ Academie royale des sciences 1783., 1786, p505-538.
- The Chlorine Tree.
- OSHA, Occupational Safety and Health Guideline for Chlorine.
Citare questa pagina
Per il collegamento online, si prega di copiare e incollare uno dei seguenti:
<a href="https://www.chemicool.com/elements/chlorine.html">Chlorine</a>
o
<a href="https://www.chemicool.com/elements/chlorine.html">Chlorine Element Facts</a>
Per citare questa pagina in un documento accademico, utilizzare la seguente citazione conforme a MLA:
"Chlorine." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/chlorine.html>.