L’elemento chimico cobalto è classificato come un metallo di transizione. Fu scoperto nel 1735 da George Brandt.

Data Zone
| Classificazione: | Il cobalto è un metallo di transizione |
| Colore: | bianco-bluastro |
| Peso atomico: | 58.9332 |
| Stato: | solido |
| Punto di fusione: | 1495 oC, 1768 K |
| Punto di ebollizione: | 2930 oC, 3203 K |
| Elettroni: | 27 |
| Protoni: | 27 |
| Neutroni nell’isotopo più abbondante: | 32 |
| Gusci di elettroni: | 2,8,15,2 |
| Configurazione degli elettroni: | 3d7 4s2 |
| Densità @ 20oC: | 8.90 g/cm3 |
Mostra di più: Calori, Energie, Ossidazione, Reazioni,
Composti, Raggi, Conducibilità
| Volume atomico: | 6.7 cm3/mol |
| Struttura: | hcp: hexagonal close pkd |
| Durezza: | 5.0 mohs |
| Capacità termica specifica | 0.42 J g-1 K-1 |
| Calore di fusione | 16.190 kJ mol-1 |
| Calore di atomizzazione | 426 kJ mol-1 |
| Calore di vaporizzazione | 373.3 kJ mol-1 |
| energia di prima ionizzazione | 758.4 kJ mol-1 |
| 2a energia di ionizzazione | 1646 kJ mol-1 |
| 3a energia di ionizzazione | 3232.2 kJ mol-1 |
| Affinità elettronica | 63,8 kJ mol-1 |
| Numero minimo di ossidazione | -1 |
| Numero minimo di ossidazione comune. | 0 |
| Numero massimo di ossidazione | 5 |
| Numero massimo di ossidazione comune | 3 |
| Elettronegatività (Scala Pauling) | 1.88 |
| Volume di polarizzabilità | 7.5 Å3 |
| Reazione con l’aria | moderata, w/ht ? Co3O4 |
| Reazione con 15 M HNO3 | vigoroso, ? Co(NO3)2, NOx |
| Reazione con 6 M HCl | mite, ? H2, CoCl2 |
| Reazione con 6 M NaOH | – |
| Ossido(i) | CoO, Co3O4 |
| Idruro(s) | Nessuno |
| Cloruro(s) | CoCl2 |
| Raggio atomico | 135 pm |
| Raggio ionico (ione 1+) | – |
| Raggio ionico (ione 2+) | 83.8 pm |
| Raggio ionico (ione 3+) | 71.8 pm |
| Raggio ionico (1-ione) | – |
| Raggio ionico (2-ione) | – |
| Raggio ionico (3- ione) | – |
| Conducibilità termica | 100 W m-1 K-1 |
| Conducibilità elettrica | 17.9 x 106 S m-1 |
| Punto di congelamento/fusione: | 1495 oC, 1768 K |
Scoperta del cobalto
Dai tempi antichi i composti di cobalto sono stati usati per produrre vetro blu e ceramica.
L’elemento fu isolato per la prima volta dal chimico svedese George Brandt nel 1735. Egli dimostrò che era la presenza dell’elemento cobalto a causare il colore blu nel vetro, non il bismuto come si pensava in precedenza.
Nel 1741 circa scrisse: “Come ci sono sei tipi di metalli, così ho anche dimostrato con esperimenti affidabili… che ci sono anche sei tipi di semimetalli: un nuovo semimetallo, cioè il cobalto, oltre al mercurio, al bismuto, allo zinco e ai regolatori di antimonio e arsenico.”
La parola cobalto deriva dal tedesco ‘kobold’, che significa goblin o folletto. L’immagine del cobalto qui sotto è di Ben Mills.


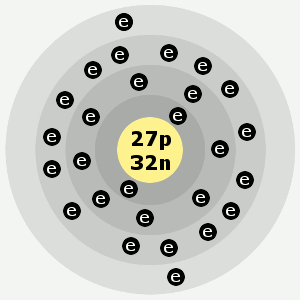
Gruppi di elettroni del cobalto
Apparenza e caratteristiche
Effetti nocivi:
Il cobalto e i suoi composti sono considerati leggermente tossici per contatto con la pelle e moderatamente tossici per ingestione.
Caratteristiche:
Il cobalto è un metallo bianco-bluastro, brillante, duro e fragile. È ferromagnetico.
Il metallo è chimicamente attivo, formando molti composti. Il cobalto rimane magnetico fino alla temperatura più alta di tutti gli elementi magnetici (ha un punto di Curie di 1121oC).
Usi del cobalto
Il cobalto è usato in leghe per parti di motori di aerei e in leghe resistenti alla corrosione/usura.
Il cobalto è ampiamente usato nelle batterie e nella galvanoplastica.
I sali di cobalto sono usati per impartire colori blu e verdi nel vetro e nella ceramica.
Il 60Co radioattivo è usato nel trattamento del cancro.
Il cobalto è essenziale per molte creature viventi ed è un componente della vitamina B12.
Il cobalto è anche usato nei magneti permanenti samario-cobalto. Questi sono usati nei pickup delle chitarre e nei motori ad alta velocità.
Abbondanza e Isotopi
Abbondanza crosta terrestre: 25 parti per milione in peso, 8 parti per milione in mole
Abbondanza sistema solare: 4 parti per milione in peso, 0.7 parti per milione di moli
Costo, puro: $21 per 100g
Costo, sfuso: $4.40 per 100g
Fonte: Il cobalto non si trova come elemento libero in natura. Si trova in minerali. I principali minerali di cobalto sono cobaltite (CoAsS), eritrite (arseniato idrato di cobalto), glaucodot (Co,Fe)AsS, e skutterudite (Co,Ni)As3. Il cobalto è generalmente prodotto come sottoprodotto delle miniere di nichel e rame.
Isotopi: Il cobalto ha 22 isotopi la cui emivita è nota, con numeri di massa da 50 a 72. Il cobalto presente in natura consiste del suo unico isotopo stabile, 59Co.

- Edward Smedley, Hugh James Rose, Henry John Rose, Encyclopaedia Metropolitana; or Universal Dictionary of Knowledge, 1845, Volume 4, p693 William Clowes and Sons.
Citare questa pagina
Citare questa pagina
Per il collegamento online, si prega di copiare e incollare uno dei seguenti:
<a href="https://www.chemicool.com/elements/cobalt.html">Cobalt</a>
o
<a href="https://www.chemicool.com/elements/cobalt.html">Cobalt Element Facts</a>
Per citare questa pagina in un documento accademico, utilizzare la seguente citazione conforme a MLA:
"Cobalt." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/cobalt.html>.