Michael D. Ober, MD
Christina M. Klais, MD
Emmett T. Cunningham Jr, MD, PhD, MPH
New York City
L’edema maculare rappresenta l’accumulo patologico di liquido extracellulare all’interno della retina, principalmente negli strati plessiformi esterni e nucleari interni, come risposta aspecifica a una rottura delle barriere emato-retiniche. Il ME è una causa frequente di perdita della vista in pazienti con diabete mellito, occlusione venosa retinica, uveite e in seguito a chirurgia intraoculare. Si verifica meno frequentemente nell’impostazione della trazione vitreoretinica, neovascolarizzazione coroideale e una serie di altre condizioni. Molte strategie sono state impiegate per gestire la ME con successo variabile. Questo articolo esamina le opzioni di trattamento disponibili per questa condizione comune.
 |
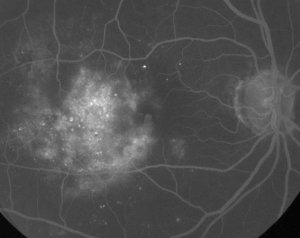 |
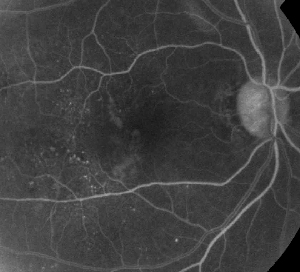
| Figura 1. A. Angiografia fluoresceina in fase iniziale di un paziente con retinopatia diabetica non proliferativa. I microaneurismi sono visti più prominentemente temporali alla fovea oltre alla perdita di fluoresceina nella zona avascolare foveale. | B. FA in fase avanzata dello stesso paziente che mostra perdite diffuse temporali e all’interno della zona avascolare foveale corrispondenti all’edema maculare diabetico. |
Diagnosi
La diagnosi clinica di ME è meglio fatta utilizzando una lente a contatto e la biomicroscopia stereoscopica con lampada a fessura del fundus. La ME si manifesta tipicamente come un rialzo irregolare all’interno della retina, spesso adiacente a lipidi intraretinici, microaneurismi e/o emorragie nei casi secondari a diabete mellito, occlusione vascolare o ischemia. Il liquido intraretinico può anche accumularsi in spazi cistici localizzati alla retina parafoveale con o senza anomalie vascolari adiacenti. Questo edema maculare cistoide (ECM) deriva più comunemente dall’infiammazione, dalla trazione localizzata o da un intervento chirurgico.
L’angiografia fluoresceinica è uno strumento essenziale nella diagnosi di ME. Nell’occhio normale, la fluoresceina è impedita a passare nella retina dalle barriere sangue-retina. Nella ME, tuttavia, le molecole di fluoresceina lasciano lo spazio intravascolare per entrare nella retina. I siti colpiti mostrano un’iperfluorescenza nei primi e medi fotogrammi che aumenta in area e intensità nei fotogrammi successivi (Vedi Figura 1). La FA non solo evidenzia l’edema per una facile visualizzazione e localizzazione del trattamento, ma crea anche una registrazione permanente per un confronto futuro. Una scala quantitativa a quattro gradi è stata sviluppata per la ME, in cui il grado 0 è nessuna iperfluorescenza perifoveale, il grado 1 è un’iperfluorescenza perifoveale incompleta, il grado 2 è una lieve iperfluorescenza a 360 gradi, il grado 3 è una moderata iperfluorescenza a 360 gradi con un’area iperfluorescente di circa 1 diametro del disco e il grado 4 è una grave iperfluorescenza a 360 gradi con un’area iperfluorescente di circa 1,5 diametri del disco.1,2 Mentre la FA è un mezzo sensibile per identificare la presenza di ME, fornisce relativamente poche informazioni sulla distribuzione anatomica del fluido, cioè diffusa o cistica o subretinica, e sulla gravità della perdita nel tempo. La FA non fornisce informazioni quantitative sull’ispessimento della retina. Non è sorprendente, quindi, che nel complesso questo sistema di classificazione bidimensionale basato sulla FA sia scarsamente correlato alla visione.3,4
La tomografia a coerenza ottica (OCT III, Carl Zeiss) è una tecnica di imaging non invasiva e senza contatto che fornisce un utile ausilio nella diagnosi della ME. Dirige un fascio di luce quasi infrarossa (830-nm) perpendicolarmente alla superficie della retina e analizza le proprietà dei riflessi. In 1,5 secondi, produce una singola immagine trasversale lineare ad alta risoluzione. Queste immagini possono visualizzare e persino misurare la retina ispessita e cistica che si trova nelle aree edematose. È anche utile per visualizzare le proprietà dell’interfaccia vitreoretinica e dimostra efficacemente quando la trazione vitreale gioca un ruolo nella formazione della ME (vedi Figura 2).
Uno studio ha utilizzato l’OCT per esaminare 84 occhi con ME secondaria a uveite, che ha fornito il vantaggio aggiunto di rivelare o confermare la presenza di membrane epiretiniche e distacco di retina sierosa nel 41 e 20 per cento dei casi, rispettivamente.5 Lo studio ha trovato una moderata correlazione tra lo spessore della retina e la diminuzione dell’acuità visiva, anche se il grado di correlazione è variato tra gli studi e altri ricercatori hanno riportato correlazioni deboli,6 moderate,7 e forti8,9,10 utilizzando diversi metodi statistici in diverse popolazioni di pazienti, compresi i pazienti con retinopatia diabetica, uveite e ECM.
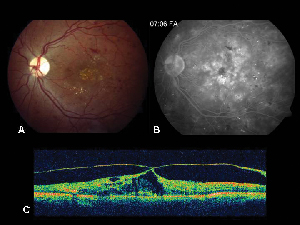
Figura 2. A. Fotografia del fundus a colori dell’occhio sinistro di un paziente con retinopatia diabetica non proliferativa e essudazione lipidica dentro e intorno alla fovea. B. La FA in fase avanzata rivela un edema maculare nella macula centrale. C. La tomografia a coerenza ottica dimostra l’interfaccia vitreoretinica anormale così come l’edema maculare.
Un altro gruppo ha riferito che l’OCT era efficace quanto la FA nel rilevare il ME e superiore alla FA nel descrivere la distribuzione assiale del liquido.6 L’OCT ha anche la capacità di identificare alcuni pazienti con ME non visualizzati con la FA, come in alcuni casi di ECM cronica in cui il tipo di perdita attiva meglio visualizzata con la FA è minima o addirittura assente, o quando l’esame del fundus è compromesso dalla presenza di opacità media, come nei pazienti con ialosi asteroidea.11
L’analizzatore di spessore retinico (RTA, Talia Technology, Israele) è una simile tecnica di imaging senza contatto che permette la quantificazione dello spessore retinico. Produce 16 scansioni trasversali parallele su un’area di 3×3 mm quadrati di retina analizzando i riflessi di un impulso di luce verde (540 nm) diretto obliquamente e trasmesso per 0,3 secondi. Sia l’OCT che la RTA hanno dimostrato un’eccellente precisione nelle loro singole misurazioni dello spessore della retina, e un confronto diretto delle tecnologie ha dimostrato una correlazione statisticamente significativa tra le loro misurazioni. Mentre la RTA ha il vantaggio di una rapida acquisizione con forse meno artefatti, sembra essere meno efficace nella misurazione dello spessore retinico rispetto all’OCT in presenza di opacità mediali.12
Un altro studio ha confrontato lo spessore foveale con RTA e OCT in 30 occhi sani. Lo spessore foveale medio negli occhi normali è stato misurato a 181 µm e 153 µm per RTA e OCT, rispettivamente. Gli autori hanno concluso che la RTA occasionalmente produce falsi valori elevati e quindi ha un’affidabilità ridotta rispetto all’OCT.13 Al contrario, un’analisi di pazienti con retinopatia diabetica non proliferativa lieve ha rilevato che la RTA era più sensibile dell’OCT nell’identificare le aree di ispessimento retinico durante le fasi iniziali della ME diabetica.14
 |
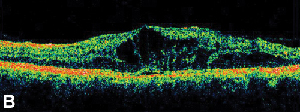 |
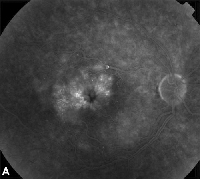
| Figura 3. A. Angiogramma fluoresceinico in fase avanzata di un paziente con edema maculare cistoide. | B. Tomografia a coerenza ottica che mostra i grandi spazi cistici alla fovea. |
Trattamenti -Medici
I farmaci antinfiammatori non steroidei topici sono il trattamento più comune per il ME dopo l’intervento di cataratta (Vedi Figura 3). Questi agenti sono diretti a diminuire i livelli di prostaglandina intraoculare, che sono stati implicati nella patogenesi della ME. Studi in doppio maschera, randomizzati, attivi e controllati con placebo che includevano pazienti sottoposti a chirurgia della cataratta hanno riportato effetti antinfiammatori da preparazioni oftalmiche applicate per via topica all’1% di indometacina, 0,03% di flurbiprofene, 0,5% di ketorolac e 0,1% di diclofenac.15,16 Diclofenac 0,1% e ketorolac 0,5% di soluzioni oftalmiche, tuttavia, sono gli unici FANS applicati per via topica specificamente approvati dalla Food and Drug Administration per questa indicazione. È stato riscontrato che la terapia che combina un corticosteroide topico e gocce di FANS ha un’efficacia maggiore nel trattamento della ME rispetto all’uno o all’altro farmaco da solo.16 Anche se non approvati dalla FDA, i FANS topici sono spesso usati prima dell’intervento di cataratta per prevenire la ME postoperatoria.
L’acetazolamide orale è occasionalmente usata nel trattamento della ME secondaria a condizioni infiammatorie e retinite pigmentosa, in particolare quando i FANS topici e i corticosteroidi falliscono. Diversi studi prospettici, mascherati, crossover che confrontano l’acetazolamide e il placebo in pazienti con ME dovuta a una varietà di cause. Uno studio crossover a cinque cicli in 41 pazienti ha trovato una risposta riproducibile, caratterizzata da una risoluzione parziale o completa della ME, in più della metà dei pazienti con malattia retinica ereditaria o infiammatoria, ma nessuna risposta da quelli con malattie vascolari retiniche primarie.17 L’acetazolamide da 500 mg/giorno o per via orale è risultata più efficace di quella da 250 mg/giorno nel trattamento della ME in pazienti con ME secondaria a RP.18 Questo studio ha osservato un miglioramento in 10 dei 12 pazienti trattati.
Un altro gruppo ha concluso che i pazienti di età inferiore ai 55 anni con ME attribuita a iridociclite cronica avevano più probabilità di rispondere a 500 mg di acetazolamide b.i.d. rispetto ai pazienti più anziani.19 Uno studio recente ha suggerito che l’acetazolamide può essere efficace anche per il trattamento della ME indotta dal diabete.20
I corticosteroidi sono potenti agenti antinfiammatori che sono usati frequentemente nel trattamento della ME. Hanno molteplici meccanismi d’azione, tra cui la stabilizzazione della barriera emato-retinica e l’inibizione dei mediatori pro-infiammatori. Le modalità di somministrazione includono la somministrazione topica, l’iniezione perioculare, l’iniezione intravitreale e la somministrazione sia orale che endovenosa. Mentre i corticosteroidi per via orale e endovenosa raggiungono certamente livelli terapeutici all’interno del vitreo, essi espongono i pazienti al rischio aggiuntivo di complicazioni sistemiche, e sono quindi solitamente riservati ai pazienti con uveite minacciosa per la vista nel contesto della malattia sistemica. Le gocce di corticosteroidi topici sono all’altra estremità dello spettro di sicurezza, ma la loro capacità di raggiungere il segmento posteriore è limitata.
Le iniezioni di sub-Tenone offrono un’alternativa per fornire dosi relativamente elevate di corticosteroidi all’occhio con minori rischi di complicazioni sistemiche.21 Anche se non ci sono stati studi randomizzati e controllati, l’iniezione di corticosteroidi sub-Tenone è stata usata efficacemente nel trattamento dell’edema maculare per molti anni. La tecnica più comune utilizza un ago corto da 25 gauge posizionato attraverso la congiuntiva bulbare superotemporale nello spazio sub-Tenone mentre il paziente guarda in direzione inferonasale. L’ago viene fatto avanzare posteriormente lungo il globo utilizzando un movimento laterale per evitare la penetrazione involontaria del globo, fino a quando il mozzo raggiunge il sito di ingresso congiuntivale, quando il farmaco viene consegnato. Un rapporto comprendeva 20 pazienti consecutivi con uveite intermedia associata a perdita della vista che sono stati trattati con un’iniezione sub-Tenone di 40 mg di triamcinolone acetonide.22 Anche se non tutti i pazienti hanno dimostrato ME su FA, il 67% è migliorato di due linee di visione dopo un trattamento. I rischi di questa procedura includono una pressione intraoculare persistentemente elevata, cataratta, ptosi e penetrazione intraoculare tra gli altri.
Di recente, l’uso dell’iniezione intravitreale di triamcinolone acetonide (Kenalog, 4,0 mg) è aumentato a causa della sua potente capacità di migliorare la ME refrattaria secondaria al diabete mellito (Vedi Figura 4), occlusioni venose retiniche, infiammazione e altre cause idiopatiche.23-26 Gli studi preliminari mostrano una drastica riduzione dell’ispessimento retinico, una diminuzione della perdita di fluoresceina e un miglioramento visivo, che può essere marcato in alcuni pazienti. Anche se l’effetto è temporaneo e dura tipicamente da tre a sei mesi o meno, la ME di solito risponde alla re-iniezione. L’uso di corticosteroidi intravitreali è associato a un rischio del 30-40% di pressione intraoculare persistentemente elevata e a un rischio del 10% circa di cataratta che richiede un intervento chirurgico. Il National Eye Institute sta attualmente arruolando pazienti per SCORE, lo studio standard care vs. corticosteroide per l’occlusione della vena retinica, che confronta iniezioni intravitreali di triamcinolone (dosi da 1 e 4 mg) con cure standard (osservazione e/o trattamento laser a griglia) in pazienti con ME secondaria a occlusione della vena. Lo studio seguirà un totale di 1.260 pazienti e continuerà il trattamento per 36 mesi.
La ME si verifica anche nella degenerazione maculare legata all’età (Vedi Figura 5). L’iniezione intravitreale di triamcinolone acetonide è attualmente allo studio per l’uso combinato con la terapia fotodinamica per il trattamento della AMD neovascolare (Visudyne con triamcinolone acetonide intravitreale, VisTA). Uno studio sottolinea l’importanza del triamcinolone intravitreale che precede l’applicazione della PDT in pazienti con edema maculare e CNV.27 Gli autori teorizzano che la verteporfina può fuoriuscire negli spazi intraretinici cistici portando a danni ai fotorecettori della retina normale adiacente una volta che il farmaco è fotoattivato, mentre la precedente risoluzione dell’edema retinico può prevenire questa complicazione. La pre-somministrazione di corticosteroidi può anche servire a smussare qualsiasi elevazione indotta dalla PDT nei livelli intraoculari di VEGF.
Le iniezioni intravitreali stesse sono associate a piccoli, ma definiti rischi di effetti collaterali gravi, potenzialmente accecanti, tra cui l’endoftalmite infettiva, il distacco di retina, l’emorragia, l’ipertensione oculare, la cataratta e l’ipotonia.28 Le linee guida pubblicate di recente per le iniezioni intravitreali tentano di stabilire un approccio di best-practice per questa tecnica sempre più utilizzata. Le raccomandazioni del gruppo di consenso hanno affrontato le considerazioni pre-iniezione, compresi gli antibiotici, la valutazione del glaucoma, l’uso dei guanti e il trattamento delle anomalie palpebrali preesistenti, nonché l’importanza di evitare un’eccessiva manipolazione delle palpebre prima e durante la procedura. Il regime peri-iniezione raccomandato includeva l’uso di un anestetico topico e/o subcongiuntivale, iodio povidone topico e uno speculum palpebrale. Gli autori hanno sottolineato l’importanza del monitoraggio della IOP e della visualizzazione diretta del fondo dopo l’iniezione per verificare la perfusione del nervo ottico, la localizzazione intravitreale del triamcinolone e l’assenza di emorragia associata all’iniezione o di distacco della retina. Hanno anche sottolineato l’importanza dell’educazione del paziente nei confronti dei sintomi precoci delle potenziali complicazioni e di un accurato follow-up.29
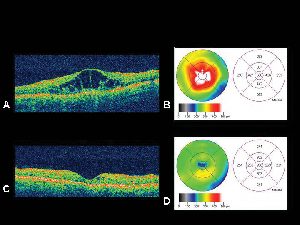
Figura 4. A. Immagine di tomografia a coerenza ottica di un occhio con edema maculare diabetico con corrispondente mappa di spessore retinico B. generata dall’OCT. C. OCT dello stesso paziente un mese dopo l’iniezione intravitreale triamcinolone acetonide con mappa corrispondente spessore retinico. D. Risoluzione dell’edema maculare. L’acuità visiva è migliorata da 20/200 a 20/80 dopo il trattamento.
Alcuni studi stanno studiando dispositivi alternativi di somministrazione di corticosteroidi a lungo termine da usare all’interno dell’occhio. Uno studio prevede il posizionamento chirurgico di un pellet di fluocinolone acetonide incorporato su un montante di plastica con rilascio controllato di steroidi per tre anni. Conosciuto come l’impianto intravitreale Envision, di Bausch & Lomb e Control Delivery Systems, viene inserito attraverso la pars plana e suturato alla sclera. Uno studio di fase II/III randomizzato e mascherato ha confrontato l’impianto Envision TD in 80 pazienti randomizzati a 0.5- vs. 2.0-mg di fluocinolone acetonide vs. lo standard di cura costituito da fotocoagulazione laser o osservazione. Dopo sei mesi, una riduzione statisticamente significativa del ME e della gravità della retinopatia diabetica è stata vista con l’impianto 0.5-mg rispetto alla cura standard. Inoltre, non ci sono state differenze nell’incidenza di effetti avversi gravi. Il braccio da 2,0 mg dello studio è stato interrotto presto a causa dei risultati osservati in un secondo studio in cui non è stato notato alcun vantaggio rispetto a 0,5 mg. Un secondo studio ha arruolato 278 pazienti con uveite posteriore non infettiva randomizzati a ricevere un impianto di Retisert da 0,59 mg o da 2,1 mg nell’occhio colpito o, in casi bilaterali, nell’occhio più gravemente colpito. Dopo due dosi e 34 settimane, c’era un tasso di recidiva significativamente più basso negli occhi con l’impianto (10 vs. 55.7 per cento, p<0.0001) con una diminuzione dell’uso di corticosteroidi sistemici/terapia immunosoppressiva (59.0 per cento al basale vs. 13.7 per cento a 34 settimane) così come l’uso di steroidi sub-Tenon e topici. C’è stato un miglioramento significativo dell’acuità visiva (p<0,05). Gli eventi avversi più comuni hanno incluso la progressione della cataratta e l’aumento della pressione intraoculare che ha richiesto una procedura di filtraggio nell’8,6%. (Jaffe G. Invest Ophthalmol Vis Sci. 2004; 44 ARVO E-Abstract #3369.)
Un altro studio coinvolge Posurdex di Allergan, un pellet di desametasone bioerodabile iniettato nello spazio vitreo che rilascia il farmaco per 50-160 giorni. I risultati di uno studio di fase II hanno rivelato che sia il pellet da 350 µg che quello da 700 µg hanno migliorato significativamente la percentuale di pazienti con un miglioramento della vista di due o più linee (27,2% e 35,7% per 350 µg e 700 µg, rispettivamente), nonché un miglioramento della vista di tre o più linee (13% e 19,4%, per 350 µg e 700 µg, rispettivamente) a 180 giorni rispetto al placebo. Finora, non è stato riportato un aumento dell’incidenza della cataratta, anche se l’aumento della IOP è stato visto in circa il 15% dei pazienti.
Trattamenti -Laser
Più recentemente, Macugen di Eyetech e Pfizer è stato studiato in uno studio di fase II controllato, randomizzato, a doppia maschera, multicentrico, a dosi variabili, su 172 pazienti con ME diabetica. Lo studio ha esaminato tre dosi (0.3 mg, 1.0 mg, 3.0 mg) rispetto alle iniezioni di sham somministrate ogni sei settimane per tre iniezioni. Mentre prima del laser focale/griglia, agli investigatori è stato chiesto di arruolare solo pazienti in cui si sentivano a proprio agio nel differire il laser focale/griglia per almeno 12 settimane. Ulteriori iniezioni e/o fotocoagulazione focale/griglia sono state somministrate a discrezione dello sperimentatore dalla settimana 18 alla 30. Le valutazioni finali sono state condotte alla settimana 36, sei settimane dopo l’ultima iniezione prevista. Complessivamente, i soggetti assegnati a ricevere Macugen hanno avuto migliori risultati visivi, hanno mostrato una maggiore probabilità di riduzione dello spessore della retina centrale e sono stati ritenuti meno propensi a richiedere un’ulteriore terapia laser rispetto ai pazienti con sham.31 Attualmente è previsto uno studio confermativo di fase III.
La fotocoagulazione laser focale/griglia rimane lo standard di cura per il trattamento della ME diabetica. L’Early Treatment Diabetic Retinopathy Study ha dimostrato che i pazienti trattati con il laser a griglia avevano una riduzione del 50% della perdita visiva moderata, definita come un raddoppio dell’angolo visivo o una diminuzione di tre linee della visione, rispetto all’osservazione.30 Anche se l’esatto meccanismo con cui il laser riduce la ME è sconosciuto, si ritiene che promuova la formazione di giunzioni strette tra le cellule RPE, oltre a ridurre la domanda di ossigeno dai fotorecettori e aumentare la perfusione di ossigeno dalla coroide.31 L’EDTRS ha identificato i pazienti idonei alla fotocoagulazione laser focale come aventi ME clinicamente significativa. Questo è stato definito come soddisfare uno dei seguenti tre criteri: 1) ispessimento retinico situato entro 500 µm dalla fovea; 2) essudati duri a meno di 500 µm dalla fovea associati a un ispessimento retinico adiacente; o 3) un’area di edema di 1 diametro del disco o superiore, qualsiasi parte della quale si trovi a meno di 1 diametro del disco dalla fovea. L’EDTRS non distingue però tra ME focale, che corrisponde ad un ispessimento locale della retina adiacente ai microaneurismi, e ME diffuso, che si riferisce ad un ispessimento generalizzato del polo posteriore. L’evidenza aneddotica mostra che la ME diabetica focale risponde bene al laser focale/griglia mentre la varietà diffusa più frequentemente fallisce il trattamento laser e richiede una gestione alternativa.
 |
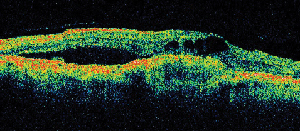 |
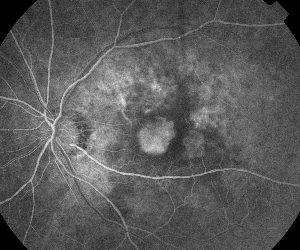
| Figura 5. A. Angiogramma fluoresceina precoce che mostra la classica neovascolarizzazione subfoveale. | B. La corrispondente tomografia a coerenza ottica rivela aree di accumulo di fluido sottoretinico e intraretinico, oltre a dimostrare la neovascolarizzazione (freccia). |
Trattamenti -Chirurgia
Il primo gruppo che ha riportato i benefici della vitrectomia e della separazione della ialoide posteriore in pazienti con ME diabetica ha suggerito che esiste un sottogruppo di pazienti in cui la trazione vitreale e i distacchi maculari poco profondi contribuiscono all’ispessimento della retina.32 Ciò è stato successivamente confermato con l’OCT, portando ad un affinamento delle indicazioni per questa tecnica.33,34 Le tre serie più grandi35,36,37 di pazienti sottoposti a vitrectomia per ME diabetica che non rispondevano a trattamenti meno invasivi hanno analizzato rispettivamente 59, 58 e 65 pazienti. Hanno riferito che il 47%, il 53% e il 45%, rispettivamente, dei loro pazienti sono migliorati nella visione di due linee o più. L’ultimo di questi ha riportato gravi complicazioni postoperatorie sviluppate in una minoranza di pazienti tra cui distacco della retina (1,5 per cento), rubeosis iridis (4,6 per cento) membrana epiretinica (13,8 per cento), emorragia vitreale ricorrente (1,5 per cento), e depositi di essudato duro foveale (4,6 per cento), mentre le complicazioni rivelato il secondo gruppo incluso membrane epiretiniche in 10,2 per cento e cataratta in 63,2 per cento degli occhi fachici. Diverse altre serie di casi hanno mostrato risultati simili, tuttavia, tutti erano non randomizzati, senza controllo placebo, e utilizzando diversi criteri di inclusione ed esclusione. Inoltre, le tecniche chirurgiche sono anche diverse, lasciando le indicazioni esatte per la vitrectomia in pazienti con ECM aperte all’interpretazione.
L’ECM rimane una delle principali cause di perdita visiva nonostante la varietà di trattamenti disponibili. La fotocoagulazione laser rimane parte integrante della gestione dell’ECM dovuta a diabete, ischemia e occlusioni vascolari. I FANS topici e i corticosteroidi sono attualmente il metodo principale per controllare la ME post-operatoria, mentre l’acetazolamide rimane un mezzo efficace per trattare in pazienti selezionati con ME secondaria a uveite e retinite pigmentosa. Il ruolo dei corticosteroidi intravitreali nella terapia della ME si sta espandendo, ma rimane limitato dagli effetti collaterali e dalla durata dell’effetto. I perfezionamenti nelle tecniche chirurgiche continueranno ad aggiungere una nuova dimensione alla ME che non risponde al trattamento meno invasivo, mentre i progressi nella farmacoterapia e nella somministrazione di farmaci oculari promettono di giocare un ruolo nella prevenzione e nella gestione di tutte le cause e i tipi di ME.
Il dottor Ober è un collega in chirurgia vitreoretinica presso l’Edward S. Harkness Eye Institute della Columbia University College of Physicians and Surgeons, e il LuEsther T. Mertz Retinal Research Center del Manhattan Eye, Ear, and Throat Hospital. Contattatelo al 210 East 64th St., 8th Fl, New York, NY 10021; e-mail: [email protected]; o (212) 605 3777 o fax (212) 605 3795.
La dott.ssa Klais è borsista della retina al LuEsther T. Mertz Retinal Research Center. Contattatela allo stesso indirizzo, ai numeri di telefono o di fax, o via e-mail all’indirizzo [email protected].
Il dottor Cunningham è professore clinico di oftalmologia e direttore del Servizio Uveite alla New York University, School of Medicine. È anche un dipendente della Eyetech Pharmaceuticals Inc.Contattatelo al Vitreous-Retina-Macula Consultants of New York, 460 Park Ave., New York, N.Y. 10022, via e-mail [email protected], o per telefono/fax al (212) 861 9797.
1. Spaide RF, Yannuzzi LA, Sisco LJ. Edema maculare cistoide cronico e predittori di acuità visiva. Ophthalmic Surg 1993;24:262-267.
2. Yannuzzi LA. Una prospettiva sul trattamento dell’edema maculare cistoide afachico. Surv Ophthalmol 1984;28:540-553
3. Chang A, Spaide RF, Yannuzzi LA. Edema maculare cistoide post-chirurgico. In: Guyer DR, Yannuzzi LA, Chang S, et al. Retina, Vitreo, Macula. Saunders. Philadelphia. 1999;1:239-255.
4. Nussenblatt RB, Kaufman SC, Palestina AG, et al. Ispessimento maculare e acuità visiva. Misurazione in pazienti con edema maculare cistoide. Ophthalmology 1987;94:1134-9.
5. Markomichelakis NN, Halkiadakis I, Pantelia E, et al. Modelli di edema maculare in pazienti con uveite: valutazione qualitativa e quantitativa utilizzando la tomografia a coerenza ottica. Oftalmologia 2004;111:946-53.
6. Antcliff RJ, Stanford MR, Chauhan DS, et al. Confronto tra tomografia a coerenza ottica e angiografia fluoresceina del fondo per il rilevamento di edema maculare cistoide in pazienti con uveite. Ophthalmology 2000; 107:593-9.
7. Otani T, Kishi S, Maruyama Y. Modelli di edema maculare diabetico con tomografia a coerenza ottica. Am J Ophthalmol 1999;127:688-93.
8. Hee MR, Puliafito CA, Wong C, et al. Valutazione quantitativa dell’edema maculare con la tomografia a coerenza ottica. Arch Ophthalmol 1995;113:1019-29.
9. Nussenblatt RB, Kaufman SC, Palestina AG, et al. Ispessimento maculare e acuità visiva. Misurazione in pazienti con edema maculare cistoide. Oftalmologia 1987;94:1134-9.
10. Ozdek SC, Erdinc MA, Gurelik G, et al. Valutazione tomografica a coerenza ottica dell’edema maculare diabetico: confronto con i risultati angiografici e clinici della fluoresceina. Ophthalmologica 2005;219:86-92.
11. Browning DJ, Fraser CM. Tomografia a coerenza ottica per rilevare l’edema maculare in presenza di ialosi asteroidea. Am J Ophthalmol 2004;137:959-961.
12. Polito A, Shah SM, Haller JA et al. Confronto tra analizzatore di spessore retinico e tomografia a coerenza ottica per la valutazione dello spessore foveale in occhi con malattia maculare. Am J Ophthalmol 2002;134:240-51.
13. Neubauer AS, Priglinger S, Ullrich S, et al. Confronto dello spessore foveale misurato con l’analizzatore di spessore retinico e la tomografia a coerenza ottica. Retina 2001;21:596-601.
14. Pires I, Bernardes RC, Lobo CL, Soares MA, Cunha-Vaz JG. Spessore retinico in occhi con retinopatia non proliferativa lieve in pazienti con diabete mellito di tipo 2: confronto delle misure ottenute dall’analisi dello spessore retinico e dalla tomografia a coerenza ottica. Arch Ophthalmol 2002 Oct;120(10):1301-6.
15. Flach AJ. Inibitori della ciclo-ossigenasi in oftalmologia. Surv Ophthalmol 1992;36:259-284.
16. Heier JS, Topping TM, Baumann W, Dirks MS, Chern S. Ketorolac versus prednisolone versus terapia combinata nel trattamento dell’edema maculare cistoide pseudofachico acuto. Oftalmologia 2000;107:2034-8.
17. Cox SN, Hay E, Bird AC. Trattamento dell’edema maculare cronico con acetazolamide. Arch Ophthalmol 1988;106:1190-5.
18. Fishman GA, Gilbert LD, Fiscella RG, Kimura AE, Jampol LM. Acetazolamide per il trattamento dell’edema maculare cronico nella retinite pigmentosa. Arch Ophthalmol 1989;107:1445-52.
19. Farber MD, Lam S, Tessler HH, Jennings TJ, Cross A, Rusin MM. Riduzione dell’edema maculare da parte dell’acetazolamide in pazienti con iridociclite cronica: uno studio prospettico randomizzato crossover. Br J Ophthalmol 1994;78:4-7.
20. Giusti C, Forte R, Vingolo EM, Gargiulo P. L’acetazolamide è efficace nel trattamento dell’edema maculare diabetico? Uno studio pilota. Int Ophthalmol 2001;24:79-88.
21. Jennings T, Rusin MM, Tessler HH, Cunha-Vaz JG. Iniezioni di corticosteroidi nel sottotenone posteriore in pazienti con uveite edema maculare cistoide. Jpn J Ophthalmol 1988;32:385-91.
22. Helm CJ, Holland GN. Gli effetti dell’iniezione sottotenone posteriore di triamcinolone acetonide in pazienti con uveite intermedia. Am J Ophthalmol 1995;120:55-64.
23. Benhamou N, Massin P, Haouchine B, Audren F, et al. Triamcinolone intravitreale per edema maculare pseudofachico refrattario. Am J Ophthalmol 2003;135:246-9.
24. Jonas JB, Kreissig I, Degenring RF. Triamcinolone acetonide intravitreale come trattamento dell’edema maculare nell’occlusione centrale della vena retinica. Graefes Arch Clin Exp Ophthalmol. 2002;240:782-3.
25. 25. Martidis A, Duker JS, Greenberg PB, Rogers AH, et al. Triamcinolone intravitreale per edema maculare diabetico refrattario. Oftalmologia 2002; 109: 920-7.
26. 26. Scott IU, Flynn HW Jr, Rosenfeld PJ. Triamcinolone acetonide intravitreale per l’edema maculare cistoide idiopatico. Am J Ophthalmol 2003;136:737-9.
27. 27. Freund KB, Klais CM, Eandi CM, et al. Sequenced Combined Intravitreal Triamcinolone and Indocyanine Green Angiography Guided Photodynamic Therapy for Retinal Angiomatous Proliferation. Arch Ophthalmol, In Press.
28. 28. Jager RD, Aiello LP, Patel SC, Cunningham ET Jr. Rischi di iniezione intravitreale: una revisione completa. Retina. 2004 Oct;24(5):676-98.
29. 29. Aiello LP, Brucker AJ, Chang S, et al. Linee guida in evoluzione per le iniezioni intravitreali. Retina 2004 Oct;24(5 Suppl):S3-19.
30. .G.Jaffe, Fluocinolone Acetonide Uveitis Study Group. Fluocinolone Acetonide Intravitreal Implant for Uveitis Affecting the Posterior Segment of the Eye. ARVO 2004, poster #3369.
31. Il gruppo di studio sulla retinopatia diabetica Macugen. Uno studio di fase II randomizzato, in doppia maschera, di pegaptanib, un aptamatore del fattore di crescita endoteliale anti-vascolare, per l’edema maculare diabetico. Ophthalmology, In press.
32. 30. Fotocoagulazione per l’edema maculare diabetico. Trattamento precoce Retinopatia diabetica Studio rapporto numero 1. Arch Ophthalmol 1985;103:1796-806.
33. Christoforidis JB, D’Amico DJ. Trattamenti chirurgici e altri trattamenti dell’edema maculare diabetico: un aggiornamento. Int Ophthalmol Clin 2004;44:139-60.
34. Lewis H, Abrams GW, Blumenkranz MS, Campo RV. Vitrectomia per trazione maculare diabetica ed edema associato a trazione ialoidale posteriore. Ophthalmology 1992;99:753-9.
35. Kaiser PK, Riemann CD, Sears JE, Lewis H. Distacco di trazione maculare ed edema maculare diabetico associato a trazione ialoidale posteriore. Am J Ophthalmol 2001;131:44-9.
36. Lewis H. Il ruolo della vitrectomia nel trattamento dell’edema maculare diabetico. Am J Ophthalmol 2001;131:123-5.
37. Pendergast SD. Vitrectomia per l’edema maculare diabetico associato ad una ialoide posteriore premaculare tesa. Curr Opin Ophthalmol 1998;9:71-5.
38. Tachi N, Ogino N. Vitrectomia per edema maculare diffuso in casi di retinopatia diabetica. Am J Ophthalmol 1996;122:258-60.
39. Yamamoto T, Hitani K, Tsukahara I, Yamamoto S, et al. Cambiamenti di spessore retinico precocemente postoperatorio e complicazioni dopo vitrectomia per edema maculare diabetico. Am J Ophthalmol 2003;135:14-9.
.