ABSTRACT: 2018年以降、HIV治療に利用できる抗レトロウイルス薬(ARV)が拡大した。 イバリズマブ・ウイックやフォステムサビルなど、新たな作用機序を持つ新しいタイプのARVが承認された。 また、ビクテグラビル/エムトリシタビン/テノホビル アラフェナミドやドルテグラビル/ラミブジンなど、従来からある薬剤の配合錠の承認もあった。 最後に、エムトリシタビン/テノホビル アラフェナミドを曝露前予防に使用するなど、従来からあるARV自体の承認適応が拡大している。
US Pharm. 2020:45(10):17-25.
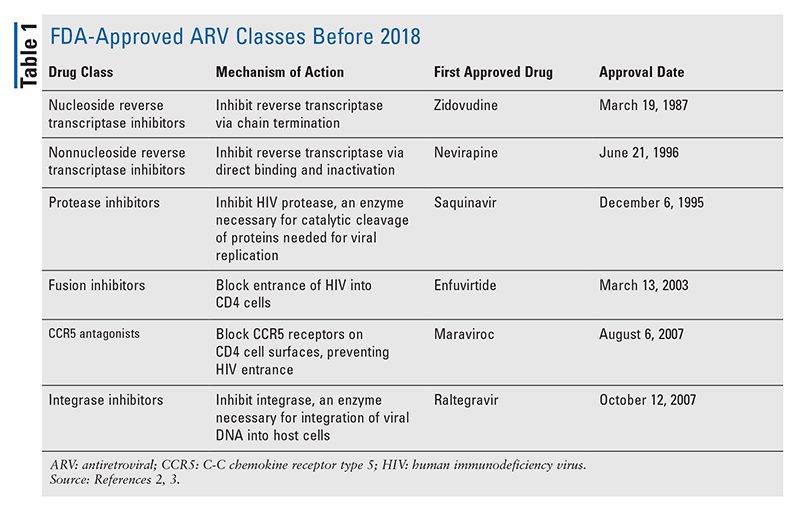
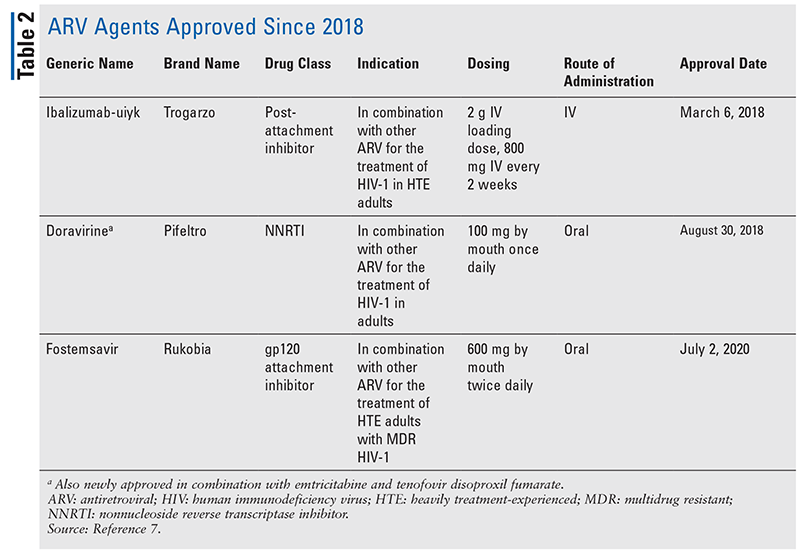
HIVの治療のための抗レトロウイルス(ARV)剤の主力は、長年にわたり、ほとんど同じ一握りの薬物クラスで構成されています。 HIVの治療は、最初にFDAに承認されたARVのクラスであるヌクレオシド逆転写酵素阻害剤(NRTI)で試みられた。 徐々に、より多くのクラスが発見され、様々な、しばしば複雑なレジメンで治療できるようになりました(表1)1-3 2007年のラルテグラビルの承認以降、新しいHIV薬の承認は、主に再利用可能な薬剤と新しい併用薬になりました。 これは、2018年に10年以上ぶりの新規ARVであるibalizumab-uiykが承認されたことで変わりました4。 Ibalizumab-uiykに続いて、同年末に新しい非ヌクレオシド系逆転写酵素阻害薬(NNRTI)のdoravirine、2020年に新しい付着阻害薬のfostemsavirがすぐに承認されました(TABLE2)5-7
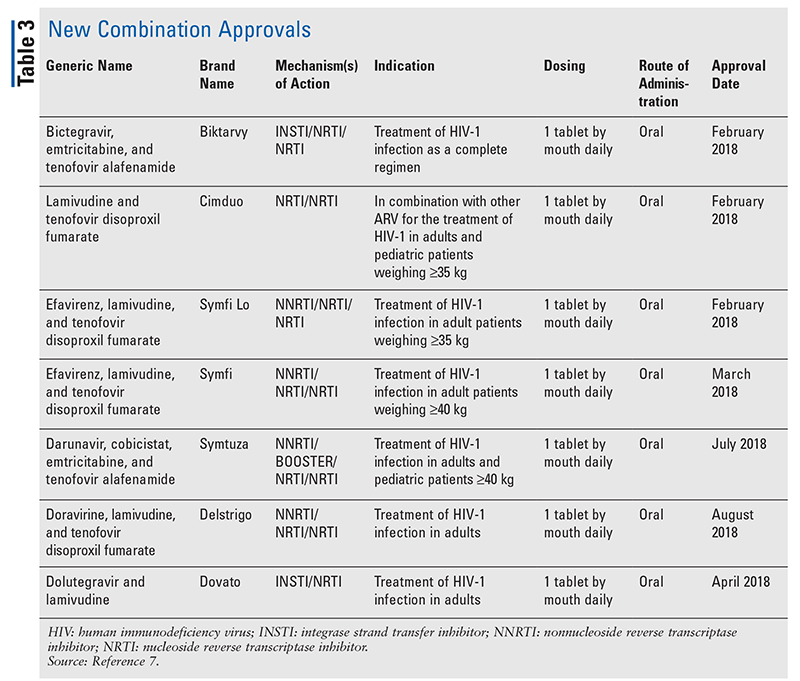
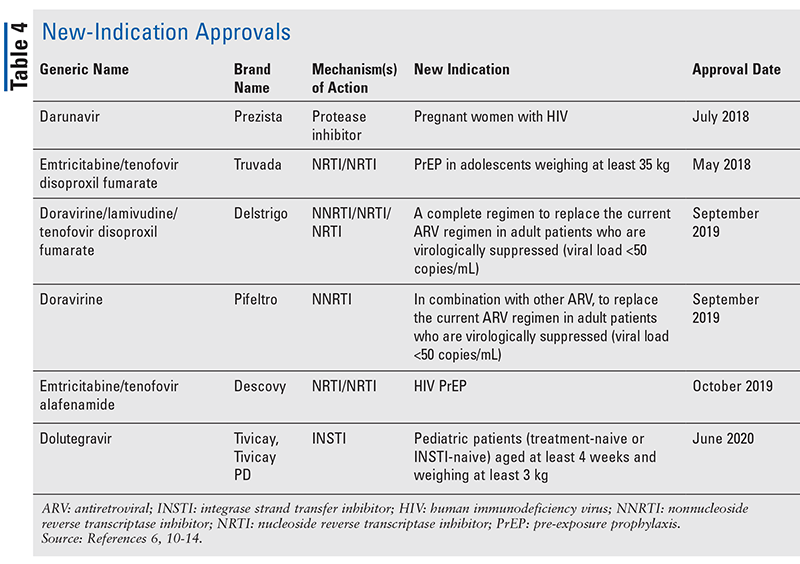
新規薬剤はしばしば最も刺激的な新薬承認ですが、ARVは他の方法で改善されています。 多くのHIVレジメンの膨大な錠剤の負担を考えると、新しく承認されたARVの組み合わせ(表3)は、患者の生活をずっと楽にすることができる。 このような薬剤を使用し、必要な錠剤の負担を制限することで、アドヒアランスと全体的なアウトカムが改善することが実証されています8,9 また、以前に利用可能なARVの承認された適応が拡大し(表4)、特定の患者集団と適応に新しい選択肢を提供しています10-14
2018年から多くの新しい承認がありますが、本論文では新しく承認された薬剤の4つと新しい適応1つをプロファイルに記載します。 これらの承認は、利用可能になりつつある多種多様な新薬のサンプルを示すとともに、HIVの治療において独自の機会を提供するいくつかの新しい選択肢を強調するために選択されました。
Ibalizumab-Uiyk(Trogarzo)
Ibalizumab-uiykは注射用の組み換えモノクロナル抗体で、CD4細胞の表面タンパク質に結合してHIV-1の融合と細胞への進出に必要な付着後段階を防ぐ構造変化を引き起こします。 HIVの治療に使用される唯一のモノクローナル薬である。 本剤は、そのユニークな結合特異性により、多くのモノクローナル薬で懸念される免疫抑制を引き起こすことなく、ウイルスの侵入を阻害します。15 本剤は、他のARVsとの併用により、現在のARV治療レジメンが無効な多剤耐性(MDR)HIV-1の高度治療経験成人(HTE)に対する治療に適応されています4。
ibalizumab-uiykの承認は、ウイルス量が1,000コピー/mL以上で、NRTI、NNRTI、プロテアーゼ阻害剤の少なくとも1つに対する耐性が証明された40人のHTE患者を対象に実施した試験に基づいています。 また、少なくとも6カ月間の治療歴があり、最近治療が失敗した患者を対象としました。 試験には3つの期間があり、まず6日間、ベースラインのウイルス量が確認されました(対照期間)。 7日目には、標準的なARTレジメンに加え、2,000mgのイバライズマブ-uiykのローディング投与を行いました(機能的単剤投与期間)。 14日目にウイルス量を再評価し、HIV感染に対する適切な活性を確保するためにレジメンを監視・調整した。 イバリスマブ-uiyk 800 mgを試験終了まで2週間ごとに静脈内投与した(維持期間)。 主要評価項目は、対照期間と機能的単剤療法期間とのウイルス量減少の割合の差、特に全体のウイルス量が³ 0.5 log10減少した患者の割合を比較した。 対照期間では、3%の患者がこのような減少を示したのに対し、機能的単剤療法期間では、83%の患者が規定のウイルス量の減少を示しました。 本試験に基づき、ibalizumab-uiykの承認用量は、ローディング用量として1回2000mgを静脈内投与し、その後2週間ごとに800mgを静脈内投与することとしています。 イバリスマブ・ユイレックに関連する主な副作用は、吐き気、めまい、下痢でした。
フォステムサビル(ルコビア)
フォステムサビルは、MDR HIV-1が知られているHTE成人の併用療法、特に潜在的耐性、不耐性、または安全性の考慮のために現在のARTが失敗した患者に適応される新しいARVです4 FDA承認の最初の付着阻害剤です。 酵素活性化により活性分子テムサビルとなり、CD4細胞へのウイルス付着に必要なウイルスエンベロープ糖タンパク質であるgp120に結合します。 これにより、CD4細胞へのウイルスの侵入を阻止し、ウイルスの複製を効果的に停止させる。 この新しいメカニズムにより、フォステムサビルは、他の多くのARVに見られるような選択圧による耐性を誘発する可能性が低くなっています6,17
フォステムサビルの安全性と有効性は、371人のHIV-1患者を含む無作為二重盲検プラセボ対照臨床試験(BRIGHTE)において評価されました16,17。 メインコホートでは、ベースラインのARTレジメンに加え、フォステムサビル600mg 1日2回またはプラセボを合計8日間投与されました。 8日目の評価では、フォステムサビル投与群では、血清中のウイルス性HIV-RNA濃度が有意に低下したことが確認されました。 この初期治療期間の後、全例がフォステムサビル600mg1日2回投与に移行しました。 24週目には53%が検出不能のウイルス抑制効果を示し、96週目には60%まで抑制効果が向上しました。 肝酵素の上昇を含むより重篤な反応は、B型またはC型肝炎の併発患者で報告されました。17,18 その他の試験では、頭痛、発疹、下痢などの軽度の発生が報告されています。 活性代謝物であるテムサビルはCYP3A4で代謝されるため、血清テムサビル濃度の低下を防ぐためにカルバマゼピン、リファンピン、セント・ジョーンズ・ワートなどの強い誘導剤を避ける必要があります17-19。
Bictegravir/Emtricitabine/Tenofovir Alafenamide (Biktarvy)
Bictegravir/emtricitabine/tenofovir alafenamide (BIC/FTC/TAF) は新しいインテグラーゼ阻害剤と2種類のヌクレオシド・ヌクレオチド逆転写酵素阻害剤の配合錠で1日1回の固定用量を投与しています。 ビクタビは、ビクテグラビル50mg(インテグラーゼ鎖切断酵素阻害剤)、エムトリシタビン200mg(NRTI)、テノホビルアラフェナミド25mg(NRTI)から構成されています。 BIC/FTC/TAFは、ART歴のないHIV-1感染成人における完全なレジメンとして、あるいは少なくとも3カ月間安定したARVレジメンでウイルス学的に抑制(ウイルス量50ポンド/mL)され、治療失敗や各成分に対する耐性歴がない患者の現在のARTレジメンからの置き換えに適応されています。 最も重要なのは、他のARVを必要としない1錠の完全なレジメンであることです20
BIC/FTC/TAF は、4つの臨床試験を経て2018年に承認されました。 臨床試験のうち2つは、ART歴のない患者を対象に、BIC/FTC/TAFの有効性と安全性を検証したものである。 試験1489(無作為化、BIC/FTC/TAF対アバカビル/ドルテグラビル/ラミブジン)、試験1490(無作為化、BIC/FTC/TAF対ドルテグラビル+エムシタビン/テノホビル アラフェナミド )です。21,22 試験1489では、主要評価項目であるウイルス量<50copies/mLをBIC/FTC/TAF群92%、ABC/DTG/3TC群93%で達成した(治療差-0.6%、95%信頼区間 , -4.8%~3.6% )。 試験1490では、主要評価項目であるウイルス量<8693>50copies/mLをBIC/FTC/TAF群の89%、DTG+FTC/TAF群の93%で達成した(治療差-3.5%、95%CI、-7.9%~1.0%)。21,22
他の2試験は、現在のARTレジメンからBIC/FTC/TAFに切り替えられるであろうウイルス学的抑制患者におけるBIC/FTC/TAFの有効性と安全性を検証したものである。 試験1844(無作為化、ドルテグラビル+アバカビル/ラミブジンまたはABC/DTG/3TCからBIC/FTC/TAFへの切り替え)および試験1878(オープンラベル、アタザナビルまたは昇圧ダルナビル+アバカビル/エムトリシタビンまたはエムトリシタビン/テノホビル ジソプロキシルフマラテからBIC/FTC/TAFへの切り替え)である。23,24試験において、主要評価項目であるウイルス学的抑制状態(ウイルス量50コピー/mL)を失った患者は、BIC/FTC/TAF群では1%、オリジナルレジメン群では<1%に認められた(治療差0.7%、95%CI, -1.0%~2.8% )。 1878試験では、主要評価項目であるウイルス学的抑制状態を失った患者は、BIC/FTC/TAF群2%、オリジナルレジメン群2%に認められた(治療差0.0%、95%CI、-2.5%から2.5%)23、24
BIC/FTC/TAF は1日1回食物と同時にまたは食物のない状態で口から投与されます。 患者さんに見られた最もよく報告された副作用は、下痢、吐き気、頭痛でした20-24
ドルテグラビル/ラミブジン(ドバト)
INSTIとNRTIの組み合わせドルテグラビル/ラミブジン(DTG/3TC)は、2019年に承認されました。 治療歴のない成人患者におけるHIV-1感染症の治療として、初の2剤併用固定用量完全レジメンです。 これは、従来必要とされていた3剤投与の標準治療レジメンの選択肢と対照的です。 これは、副作用や避けられない薬物相互作用のために、より一般的な3剤併用レジメンのいずれにも耐えられない患者に機会を提供するものである可能性があります25,26。
ドルテグラビル/ラミブジン併用療法の有効性と安全性は、GEMINI-1およびGEMINI-2の2つの同一試験で実証されています。27これらの試験には、合計1,433人のHIV-1感染、治療歴のない成人が登録され、ドルテグラビル50mg+ラミブジン150mgの2剤併用投与、またはドルテグラビル+エムトリシタビン+テノホビルジソプロキシルフマル酸塩の3剤併用投与のいずれかに無作為に割り付けられました。 主要評価項目であるウイルス量<50copies/mLの達成については、2つの試験の結果をプールしたところ、DTG/3TCは2剤併用療法患者716人の91%、3剤併用療法患者717人の93%(治療差:-1.7%、95%CI、 -4.4~1.1 %)において非劣性を示しました。 また、プールされた試験では、2剤併用療法では3剤併用療法に比べ、薬物関連有害事象の発現数が少ないことが示されました(それぞれ716例中126例、717例中169例)。 有効性が劣らず、忍容性プロファイルも同様であったため、保健福祉省は、DTG/3TC合剤をHIV/AIDSガイドラインに、ほとんどのHIV患者に対する推奨初期レジメンとして含めることができました27
ドルテグラビル/ラミブジン合剤は、食事の有無にかかわらず1日1回口から投与されます。 患者に見られる最も一般的な副作用は、頭痛、吐き気、下痢、疲労、不眠症です。 2剤併用錠であるにもかかわらず、完全な治療レジメンであるため、他のARV薬と一緒に投与する必要はありません25-27。
Emtricitabine/Tenofovir Alafenamide for Pre-exposure Prophylaxis (PrEP)
2012年以降、PrEPのFDA承認オプションはFTC/ TDFのみでした11が、2019年に、構造的にも類似する配合薬、エムシタビン/テノフォビル アラフェナミド (FTC/TAF) 13が承認されて変わりました。 現在では、性交渉によるHIV感染のリスクが高い未感染者のPrEPに使用することが適応となっています。
PrEPの承認は、最近のDISCOVER試験に基づいており、男性と性交渉を持ち、HIV-1感染のリスクがある男性およびトランスジェンダー女性において、FTC/TAFと標準治療のFTC/TDFを比較する無作為二重盲検試験で、HIV-1感染のリスクを低減することができました7。 本試験は、無作為化二重盲検並行群間比較試験として実施され、最低48週間の追跡調査を行い、50%以上の参加者が無作為化後96週間の追跡調査を受けています。 5,399名の被験者が登録され、いずれかの群に1対1で割り付けられた。 本試験の主要目的は、100人年当たりのHIV-1感染の発生率を評価することであった。 FTC/TAF群の2,694人のうち、7人(0.16/100人年)でHIV-1感染が確認されました。 FTC/TDF群2,693名では、15名(0.34/100人年)にHIV-1感染が認められました。 これらの発生率は、HIVに感染するリスクのある試験参加者において、FTC/TAFがFTC/TDFに対して非劣性であることを示し、最終的にFDAがFTC/TAFの適応症にPrEPを追加することを可能にしました13
HIV療法におけるFTC/TAFの位置づけはまだ不明であると考えられています。 HIV治療の他の分野では使用されているが、この設定における代替薬に対する利点は、まだ決定的にされていない。 TAFは、TDFと類似していますが、TDFの副作用である骨密度変化と腎機能障害の発生率が低い可能性があります。 しかし、この差は十分に確立されておらず、コビシスタットやリトナビルのような薬物動態ブースターを含まないレジメンでは、この利点は臨床的に重要ではない可能性を示唆するデータもある。 27-29
結論
HIVの複雑さと耐性の可能性により、ARV療法は患者にとってすぐに負担になる可能性がある。 2018年から現在に至るまで、医療界では、HIVの治療のためにFDAが承認したARV療法が広く拡大しています。 これらの治療法には、新しい固定用量配合錠、これまで市販されていた薬とは異なるメカニズムで作用する新薬、さらには既存の薬に対する新しい適応症が含まれています。 これらの新薬はすでに現在の治療ガイドラインに影響を及ぼしており、患者がより長く、より健康的な生活を送るのに役立つ可能性があります。 内容は、専門家のアドバイスに代わるものではありません。 この記事で提供されるいかなる情報への信頼も、あくまでご自身の責任において行ってください
1. Vella S, Schwartländer B, Sow SP, et al. 抗レトロウイルス療法の歴史と、世界の資源が乏しい地域での実施について。 AIDS. 2012;26(10):1231-1241.
2. Arts EJ, Hazuda DJ. HIV-1抗レトロウイルス薬治療。 Cold Spring Harb Perspect Med. 2012;2(4):a007161.
3. Chaudhuri S, Symons JA, Deval J. Innovation and trends in the development and approval of antiviral medicines: 1987-2017年およびそれ以降。 Antiviral Res. 2018;155:76-88.
4. トロガルツォ(イバリスマブ-ウイーク)添付文書. モントリオール、ケベック州。 Theratechnologies Inc; March 2018.
5. ピフェルトロ(ドラビリン)添付文書. Whitehouse Station, NJ: Merck & Co, Inc; March 2019.
6. ルコビア(フォステムサビル)添付文書. リサーチトライアングルパーク、ノースカロライナ州。 GlaxoSmithKline; July 2020.
7. Pan F, Chernew ME, Fendrick AM. 固定用量配合薬が処方薬の服薬アドヒアランスに与える影響。 J Gen Intern Med. 2008;23(5):611-614.
8. Verma AA, Khuu W, Tadrous M,et al. Fixed-dose combination antihypertensive medications, adherence, and clinical outcomes: a population-based retrospective cohort study.高血圧薬の合剤、アドヒアランス、および臨床的アウトカム:人口ベースのレトロスペクティブコホート研究。 PLoS Med. 2018;15(6):e1002584.
9. 米国国立衛生研究所(National Institutes of Health). HIVinfo. FDAが承認したHIV医薬品. hivinfo.nih.gov/understanding-hiv/fact-sheets/fda-approved-hiv-medicines. 2020年9月22日アクセス
10. プレジスタ(ダルナビル)添付文書. Titusville, NJ: Janssen Therapeutics; May 2019.
11. Truvada (emtricitabine/tenofovir disoproxil fumarate) パッケージインサート. フォスターシティ、カリフォルニア州。 Gilead Sciences, Inc; June 2004/2020.
12. デルストリゴ(ドラビリン/ラミブジン/テノホビルジソプロキシルフマレート)添付文書。 White House Starion, NJ: Merck & Co, Inc; August 2018.
13. デスコビー(エムトリシタビン/テノホビル・アラフェナミド)添付文書. フォスターシティ、カリフォルニア州。 Gilead Sciences, Inc; 2019年12月.
14. チビケイ(ドルテグラビル)添付文書. リサーチトライアングルパーク、ノースカロライナ州。 GlaxoSmithKline; June 2020.
15. アイアコブSA、アイアコブDG. CD4受容体を標的とするイバリズマブ、HIV治療における新たな分子。 Front Microbiol. 2017;8:2323.
16. Emu B, Fessel J, Schrader S, et al.多剤耐性HIV-1に対するイバリズマブの第3相試験. N Engl J Med. 2018;379:645-654.
17. Li Z, Zhou N, Sun Y, et al. プロドラッグBMS-663068の活性成分であるHIV-1付着阻害剤BMS-626529のCD4非依存性ウイルスおよび他の侵入阻害剤に耐性のHIV-1エンベロープに対する活性を示す。 Antimicrob Agents Chemother. 2013:57(9):4172-4180.
18. Kozal M、Aberg J、Pialoux G. 多剤耐性HIV-1感染症の成人患者におけるフォステムサビルの投与。 N Engl J Med. 2020;382(13):1232-1243.
19. Cahn P, Fink V, Patterson P. Fostemsavir: a new CD4 attachment inhibitor(フォステムサビル:新しいCD4アタッチメント阻害剤). Curr Opin HIV AIDS. 2018;13(4):341-345.
20. ビクタビ(ビクテングラビル/エムトリシタビン/テノホビルアラフェナミド)添付文書. フォスターシティ、カリフォルニア州。 Gilead Sceinces, Inc; February 2018.
21. Gallant J, Lazzarin A, Mills M, et al. Bictegravir, emtricitabine, and tenofovir alafenamide versus dolutegravir, abacavir, and lamivudine for initial treatment of HIV-1 infection (GS-US-380-1489): a double-blind, multicentre, phase 3, randomised controlled non-inferiority trial.ビックテグラビル、エムトリシタビン、テノホビル アラフェナミドとドルテグラビル、アバカビル、ラミブジンの比較:HIV-1感染の初期治療における二重盲検、多施設、第3相、無作為化対照非劣性試験。 Lancet. 2017;390(10107):2063-2072.
22. Sax PE, Pozniak A, Montes M, et al. HIV-1感染の初期治療における、ビクテグラビル、エムトリシタビン、テノホビル アラフェナミドのコフォーミュレーションとドルテグラビル、エムトリシタビン、テノホビル アラフェナミドとの比較(GS-US-380-1490):無作為化二重盲検、マルチセンター、フェーズ3、非劣性試験. Lancet. 2017;390(10107):2073-2082.
23. Malina JM, Ward D, Brar I, et al.ウイルス学的に抑制された成人のHIV-1におけるドルテグラビル+アバカビル+ラミブジンから固定用量ビクテグラビル、エミトリシタビン、テノホビル アラフェナミドへの切り替え: 48週目の無作為化、二重盲検、マルチセンター、アクティブコントロール、フェーズ3、非劣性試験結果. Lancet HIV. 2018;5(7):E357-E365.
24. Daar ES, De Jesus E, Ruane P, et al.ウイルス学的に抑制された成人のHIV-1におけるブーストプロテアーゼ阻害剤ベースのレジメンからビクテグラビル、エムトリシタビン、テノホビル アラフェナミド固定用量への切り替えの有効性と安全性:無作為化オープンラベル、マルチセンター、フェーズ3、非劣性試験の48週間結果。 Lancet HIV. 2018;5(7):e347-e356.
25. ドバト(ドルテグラビル/ラミブジン)添付文書. リサーチトライアングルパーク、ノースカロライナ州。 グラクソ・スミスクライン。 2020年3月.
26. スコットLJ. ドルテグラビル/ラミブジン単剤レジメン:HIV-1感染症におけるレビュー。 Drugs. 2020;80(1):61-72.
27. Cahn P, Madero JS, Arribas JR, et al. GEMINI Study Team.(ジェミニ研究チーム). 抗レトロウイルス薬未使用の成人 HIV-1 感染症患者におけるドルテグラビル+ラミブジン vs ドルテグラビル+テノホビル ジソプロキシルフマル酸塩+エムトリシタビン(GEMINI-1 および GEMINI-2):2 つの多施設共同二重盲検無作為化非劣性フェーズ 3 試験による第 48 週結果。 Lancet. 2019;393(10167):143-155.
28. Mayer KH, Molina JM, Thompson MA, et al. Emtricitabine and tenofovir alafenamide vs. emtricitabine and tenofovir disoproxil fumarate for HIV preexposure prophylaxis (DISCOVER): randomised, double-blind multicentre, active-controlled, phase three non-inferiority trialの主要な結果。 Lancet. 2020;396(10246):239-254.
29. ヒルA、ヒューズSL、ゴッサムD、ポズニアックAL. テノホビル アラフェナミド対テノホビル ジソプロキシルフマレート:有効性と安全性に真の差はあるか? J Virus Erad. 2018;4(2):72-79.