De VSEPR theorie is in staat om de vormen van moleculen die eenzame paren bevatten te verklaren en te voorspellen. In zo’n geval worden zowel de lone paren als de bindingsparen geacht elkaar af te stoten en te vermijden. Aangezien er bijvoorbeeld twee bindingen in het SnCl2-molecuul zijn, zou men verwachten dat het lineair is zoals BeCl2. Als we echter het Lewis-diagram tekenen, vinden we zowel een eenzaam paar als twee bindingsparen in de valentieschil van het Sn-atoom:
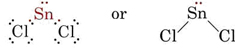_Chloride.jpg?revision=1&size=bestfit&width=235&height=48)
Een eenzaam paar beïnvloedt ook de structuur van ammoniak, NH3. Aangezien dit molecuul de octetregel volgt, wordt het N-atoom omgeven door vier elektronenparen:
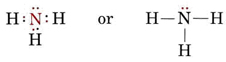
Als deze paren allemaal equivalent waren, zouden we verwachten dat de hoek tussen hen de regelmatige tetrahedrale hoek van 109,5° zou zijn. Experimenteel blijkt de hoek iets kleiner te zijn, namelijk 107°. Ook dit komt doordat het lone paar “dikker” is dan de bindingsparen en ze dichter bij elkaar kan drukken.
De elektronische structuur van het H2O-molecuul is vergelijkbaar met die van NH3, behalve dat één bindingspaar is vervangen door een lone paar:
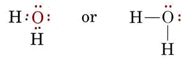
Voorbeeld : Moleculaire Geometrie
Schets en beschrijf de geometrie van de volgende moleculen: (a) GaCl3, (b) AsCl3, en (c) AsOCl3.
Oplossing
a) Aangezien het element gallium tot groep III behoort, heeft het drie valentie-elektronen. Het Lewisdiagram voor GaCl3 is dus
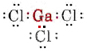
Omdat er drie bindingsparen en geen eenzame paren rond het Ga-atoom zijn, concluderen we dat de drie Cl-atomen trigonaal gerangschikt zijn en dat alle vier atomen in hetzelfde vlak liggen.
b) Arsenicum behoort tot groep V en heeft dus vijf valentie-elektronen. De Lewis-structuur voor AsCl3 is dus
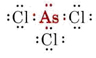
Omdat er een lone paar aanwezig is, is de vorm van dit molecuul een trigonale piramide, met de As-kern iets boven een gelijkzijdige driehoek van Cl-kernen.
c) Het Lewisdiagram voor AsOCl3 is vergelijkbaar met dat van AsCl3.

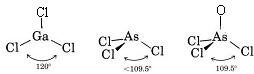
De VSEPR-theorie kan ook worden toegepast op moleculen die vijf en zes valentie-elektronenparen bevatten, waarvan sommige eenzame paren zijn. We hebben dergelijke soorten hier niet opgenomen omdat de meerderheid van de verbindingen in de door ons beschreven categorieën vallen.
Bijdragers
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, en Adam Hahn.