Het chemische element chloor wordt geclassificeerd als halogeen en een niet-metaal. Het werd in 1774 ontdekt door Carl Wilhelm Scheele.

Data Zone
| Classificatie: | Chloor is een halogeen en een niet-metaal |
| Kleur: | groengeel |
| Atomisch gewicht: | 35.453 |
| Staat: | gas |
| Smeltpunt: | -101 oC , 172 K |
| Kookpunt: | -34 oC , 239 K |
| Elektronen: | 17 |
| Protonen: | 17 |
| Neutronen in meest voorkomende isotoop: | 18 |
| Elektronenschillen: | 2,8,7 |
| Elektronenconfiguratie: | 1s2 2s2 2p6 3s2 3p5 |
| Dichtheid bij 20oC: | 0.003214 g/cm3 |
Toon meer, o.a.: Warmte, Energieën, Oxidatie, Reacties,
Samenstellingen, Stralen, Geleidbaarheden
| Atomair volume: | 22,7 cm3/mol | |
| Structuur: | lagen van Cl2 in vaste stof | |
| Hardheid: | ||
| Specifieke warmtecapaciteit | 0,48 J g-1 K-1 | |
| Fusiehitte | 6..406 kJ mol-1 van Cl2 | |
| Warmte bij atomisatie | 122 kJ mol-1 | |
| Warmte bij verdamping | 20.41 kJ mol-1 van Cl2 | |
| 1ste ionisatie-energie | 1251.1 kJ mol-1 | |
| 2ste ionisatie-energie | 2297.3 kJ mol-1 | |
| 3e ionisatie-energie | 3821.8 kJ mol-1 | |
| Elektronenaffiniteit | 349 kJ mol-1 | |
| Minimaal oxidatiegetal | -1 | |
| Min. gemeenschappelijk oxidatiegetal | -1 | |
| Maximaal oxidatiegetal | 7 | |
| Max. gemeenschappelijk oxidatiegetal | 7 | |
| Elektronegativiteit (Pauling Schaal) | 3.16 | |
| Polariseerbaarheidsvolume | 2.2 Å3 | |
| Reactie met lucht | geen | |
| Reactie met 15 M HNO3 | mild, ⇒ HClOx, NOxCl, NOx | |
| Reactie met 6 M HCl | mild, ⇒ HOCl, Cl- | |
| Reactie met 6 M NaOH | mild, ⇒ OCl-, Cl- | |
| Oxide(s) | Cl2O, ClO2, Cl2O7 | |
| Hydride(n) | HCl | |
| Chloride(n) | Cl2 | |
| Atomaire straal | 100 pm | |
| Ionische radius (1+ ion) | – | |
| Ionstraal (2+ ion) | – | |
| Ionstraal (3+ ion) | – | |
| Ionstraal (1- ion) | 167 pm | |
| Ionstraal (2-ion) | – | |
| Ionstraal (3-ion) | – | |
| Warmtegeleidingscoëfficiënt | 0.0089 W m-1 K-1 | |
| Elektrisch geleidingsvermogen | – | |
| Vries-/Smeltpunt: | -101 oC , 172 K |

Chloor in reageerbuis (Foto: Ben Mills)
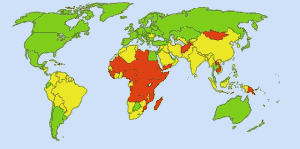
Veilig drinkwater: Beeld: Ionut_Cojocaru. In groene gebieden kan iedereen veilig water krijgen. In rode gebieden kan ten minste 25 procent van de mensen geen behandeld water krijgen. Gele gebieden zijn tussengebieden. Vóór het routinematige gebruik van chloor in de watervoorziening van de VS eiste buiktyfus 25 000 dodelijke slachtoffers per jaar. Tegenwoordig wordt 98% van het openbare water behandeld met chloor of een chloorverbinding. Tyfus eist nu gemiddeld één slachtoffer per jaar. (4)

Carl Wilhelm Scheele, die in 1774 chloor ontdekte.
Ontdekking van chloor
Chloor werd in 1774 voor het eerst geproduceerd door Carl Wilhelm Scheele in Zweden. Scheele verzamelde het gas dat vrijkwam door de reactie van pyrolusiet met spiritus salis – een alchemistische term die geest/zoutadem betekent. Het nieuwe gas had, volgens Scheele, “een zeer waarneembare verstikkende geur, die zeer benauwend was voor de longen… en geeft het water een licht zure smaak… de lucht erin krijgt een gele kleur…” (1)
Scheele merkte ook de hoge reactiviteit en de blekende kwaliteiten op van het nieuwe gas dat hij had gemaakt: “…alle metalen werden aangevallen… vaste alkali werd omgezet in gewoon zout… alle plantaardige bloemen – rood, blauw en geel – werden in korte tijd wit; hetzelfde gebeurde ook met groene planten… insecten stierven onmiddellijk. (1)
Ondanks de nauwkeurigheid van zijn waarnemingen dacht Scheele ten onrechte dat het nieuwe gas een gedeflostileerde vorm van muriatisch zuur was.
De beroemde Franse scheikundige Antoine Lavoisier meende dat het nieuwe gas oxymuriatisch zuur moest worden genoemd, gebaseerd op het nog niet ontdekte element murium. (2)
* De verwarring over de ware identiteit van chloor werd veroorzaakt door de flogistontheorie; flogiston was gedurende het grootste deel van de jaren 1700 door chemici aanvaard – totdat Lavoisier zelf het ontkrachtte. Phlogiston was een ‘stof’ die werd gebruikt om het toen onverklaarbare te verklaren. Gemakshalve had het een negatief gewicht wanneer dat nodig was, en ‘verklaarde’ het reacties als roesten en verbranden.
Lavoisier was de architect van de ondergang van phlogiston, door te laten zien dat de chemie van zuurstof een betere verklaring was in chemische reacties dan phlogiston was. (3)
Tegen 1810 was de wetenschappelijke consensus dat het element dat we nu chloor noemen, eigenlijk een verbinding was die zuurstof bevatte. De Engelse scheikundige Sir Humphry Davy ontdekte dat de consensus onjuist was; hij kon het nieuwe geelgroene gas niet laten reageren met een houtskoolelektrode, wat hem deed geloven dat het misschien geen zuurstof bevatte. In reacties met fosfor en ammoniak toonde hij aan dat het nieuwe gas geen zuurstof bevatte. Hij gebruikte een enorme plaatvoltaïsche hoop van 2000 om te zien of hij zuurstof kon onttrekken aan de fosfor- en zwavelverbindingen van het gas, maar ook hier vond hij geen zuurstof. (1a)
In 1811 concludeerde Davy dat het nieuwe gas in feite een nieuw element was. (1b) Hij noemde het chloor, van het Griekse woord ‘chloros,’ dat bleekgroen of geelgroen betekent.
Interesting Facts about Chlorine
- De eerste ontdekte kettingreactie was geen kernreactie; het was een chemische kettingreactie. Zij werd ontdekt in 1913 door Max Bodenstein, die een mengsel van chloor- en waterstofgassen zag exploderen wanneer het door licht werd teweeggebracht. Het mechanisme van de kettingreactie werd in 1918 volledig verklaard door Walther Nernst.
- De oceanen van de aarde bevatten een grote hoeveelheid chloor. Als dit chloor als gas zou vrijkomen, zou het 5x zo zwaar zijn als de totale huidige atmosfeer van de aarde. (Onze oceanen bevatten ongeveer 2,6 x 1016 ton chloor, voornamelijk in de vorm van natriumchloride.)
- Chloor is niet alleen overvloedig aanwezig in onze oceanen; het is het zesde meest voorkomende element in de aardkorst.
- Blootstelling aan kleine hoeveelheden chloor, zelfs voor een korte tijd, kan dodelijk zijn. Dodelijke slachtoffers worden verwacht bij 1 deel op de duizend chloor in de lucht (of soms bij nog lagere concentraties). (5)
- Chloor is zwaarder dan lucht. Wanneer het vrijkomt, vormt het een giftige deken die met de wind meedrijft. Chloor werd als chemisch wapen gebruikt in de Eerste Wereldoorlog, eerst in 1915 door het Duitse leger en daarna door de westelijke geallieerden. Het was niet zo “doeltreffend” als men had gehoopt, omdat chloor gemakkelijk wordt ontdekt door zijn sterke geur. Het is ook in water oplosbaar, zodat soldaten zich tegen de ergste effecten konden beschermen door vochtige doeken in te ademen.

Opzicht en kenmerken
Schadelijke effecten:
Chloor is een giftig gas dat de huid, de ogen en de luchtwegen irriteert.
Kenmerken:
Chloor is een groengeel, diatomisch, dicht gas met een scherpe geur (de geur van bleekwater).
Het wordt in de natuur niet vrij aangetroffen, omdat het zich gemakkelijk met bijna alle andere elementen verbindt.
Chloor komt in de natuur vooral voor als keukenzout (NaCl), carnalliet , en sylviet (KCl).
In vloeibare en vaste vorm is het een krachtig bleek-, oxidatie- en ontsmettingsmiddel.
Toepassingen van chloor
Chloor wordt gebruikt voor de productie van veilig drinkwater.
Gechloreerde verbindingen worden meestal gebruikt voor sanitaire voorzieningen, het bleken van pulp, ontsmettingsmiddelen, en textielverwerking.
Chloor wordt ook gebruikt voor de vervaardiging van chloraten en het is belangrijk in de organische chemie, waarbij verbindingen worden gevormd zoals chloroform, tetrachloorkoolstof, polyvinylchloride en synthetisch rubber.
Andere toepassingen van chloorverbindingen zijn kleurstoffen, aardolieproducten, medicijnen, antiseptica, insecticiden, voedingsmiddelen, oplosmiddelen, verf en kunststoffen.
Bundantie en isotopen
Bundantie aardkorst: 145 delen per miljoen gewicht, 85 delen per miljoen mol
Bundantie zonnestelsel: 8 delen per miljoen gewicht, 0,3 delen per miljoen mol
Kosten, zuiver: $ 0,15 per 100g
Kosten, bulk: $ per 100g
Bron: Chloorgas wordt commercieel geproduceerd door de elektrolyse van natriumchloride (NaCl) uit zeewater of pekel uit zoutmijnen.
Isotopen: Chloor heeft 16 isotopen waarvan de halveringstijd bekend is, met massanummers 31 tot 46. Natuurlijk voorkomend chloor is een mengsel van zijn twee stabiele isotopen 35Cl en 37Cl met natuurlijke abundanties van respectievelijk 75,8% en 24,3%.

- Henry M. Leicester, Herbert S. Klickstein, A Source Book in Chemistry, 1400-1900., (1969) Harvard University Press. p111; 1a. p241.; 1b. p257.
- J.W. Mellor, A Comprehensive Treatise on Inorganic and Theoretical Chemistry., 1922, vol 2, Longmans, Green and Co., p21.
- Antoine Lavoisier, Memoires de l’ Academie royale des sciences 1783., 1786, p505-538.
- The Chlorine Tree.
- OSHA, Occupational Safety and Health Guideline for Chlorine.
Cite this Page
Voor online-linking, kopieer en plak een van de volgende:
<a href="https://www.chemicool.com/elements/chlorine.html">Chlorine</a>
of
<a href="https://www.chemicool.com/elements/chlorine.html">Chlorine Element Facts</a>
Voor het citeren van deze pagina in een academisch document, gebruik dan de volgende MLA-conforme citatie:
"Chlorine." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/chlorine.html>.