Antibiotica roeien pathogene infecties uit en redden levens – maar daarbij verstoren ze ook de integriteit van het intestinale microbioom. Hoewel veel artsen de noodzaak erkennen van het herstellen van het microbiële evenwicht van een patiënt na een antibioticakuur, begrijpen veel minder artsen hoe ze dit effectief kunnen doen.
Volgens Amie Skilton, ND, is herstel van de darmflora zowel kunst als wetenschap. Goed uitgevoerd, kan het een wereld van verschil maken voor patiënten. In sommige gevallen kan het patiënten zelfs helpen de ziekte te overwinnen waarvoor de antibiotica in eerste instantie werden voorgeschreven.
Maar er is meer voor nodig dan alleen een probioticum uit de winkel aanbevelen en er het beste van hopen.
De Centers for Disease Control meldden afgelopen voorjaar dat van de 154 miljoen recepten voor antibiotica die elk jaar in dokterspraktijken en op spoedeisende hulpafdelingen worden uitgeschreven, 30 procent onnodig is. Het merendeel van de buitensporige recepten, ontdekte de CDC, werden uitgedeeld voor aandoeningen van de luchtwegen veroorzaakt door virussen zoals verkoudheid, virale keelpijn, bronchitis, en sinus- en oorinfecties, die niet reageren op antibiotica. Het gebruik van deze geneesmiddelen “brengt patiënten onnodig in gevaar voor allergische reacties of de soms dodelijke diarree, Clostridium difficile.”
Het plaatje wordt nog gecompliceerder door het feit dat antibiotica niet alleen vanuit dokterspraktijken worden verspreid; ze worden ook rijkelijk aan vee gevoerd en uitgebreid op producten gespoten, waardoor minieme maar biologisch actieve sporen achterblijven in het voedsel dat mensen vervolgens consumeren.
Dosis, timing bepalen impact
Als antibiotica infectieveroorzakende micro-organismen doden, vernietigen ze ook niet-selectief gemeenschappen van nuttige darmbacteriën, waardoor de stabiliteit van het intestinale microbioom wordt verzwakt. Deze grootschalige vernietiging kan massaal zijn; experimentele gegevens uit een studie waarbij qPCR werd gebruikt, wijzen op een tot 10-voudige vermindering van het aantal bacteriële isolaten onmiddellijk na behandeling met antibiotica (Panda, S. et al. PLoS One. 2014; 9(4): e95476).
“Het is echt een decimerend effect,” zegt Dr. Skilton, een natuurgeneeskundig arts en kruidendokter bij de Elysium Clinic of Natural Medicine, Sydney, NSW, Australië.
In een webinar gesponsord door Holistic Primary Care en Bioceuticals, schetste ze de talloze effecten van antibiotica op het menselijke microbioom, waarbij ze opmerkte dat niet alle antibiotica even destructief zijn voor darmbacteriën.
De mate waarin deze medicijnen de darmmicrobiota beschadigen, hangt af van het type medicijn, de duur van de behandeling en de frequentie van gebruik, zei Skilton. Bepaalde antibiotica veroorzaken bijvoorbeeld een grotere afgifte van endotoxinen en cytokinen dan andere. Hogere dagelijkse doses hebben meer effect. Langdurig gebruik van hoge doses antibiotica kan extreme schade aan het microbioom veroorzaken die jaren van hersteltherapie kan vergen om terug te draaien, als het al kan worden teruggedraaid.
En in tegenstelling tot wat vaak wordt gedacht, kunnen intraveneuze antibiotica dezelfde negatieve invloed hebben op de darmflora als orale geneesmiddelen. “Lange tijd werd gedacht dat intraveneuze geneesmiddelen de darm zouden omzeilen en niet dezelfde impact zouden hebben. We weten nu dat dit niet waar is.”
De timing van de toediening van antibiotica maakt ook een verschil. Mensen die al vroeg in hun leven vaak antibiotica gebruiken, zijn kwetsbaarder voor veel soorten ziekten als ze ouder worden. In een paper dat eerder dit jaar werd gepubliceerd, toonden onderzoekers een associatie aan tussen antibioticagebruik tijdens de kindertijd en latere slechte neurocognitieve uitkomsten, waarbij werd gesuggereerd dat antibioticagebruik in het eerste levensjaar van een patiënt geassocieerd was met kleine maar statistisch significante verschillen in cognitieve, gedrags- en stemmingsmaatregelen tijdens de kindertijd (Slykerman, R. et al. Acta Paediatr. 2017; 106(1): 87-94).
Anderen hebben foetale en vroege kindertijd blootstelling aan antibiotica gekoppeld aan de latere ontwikkeling van astma later in het leven (Örtqvist, A. et al. Brit Med J. 2014; 349. doi: https://doi.org/10.1136/bmj.g6979). Antibiotica zijn ook in verband gebracht met obesitas en gewichtstoename bij zowel kinderen als volwassenen (Million, M. et al. Clin Microbiol & Infec. 2013; 19(4): 305-313). Onderzoekers schrijven deze veranderingen toe aan de veranderde microbiële samenstelling van de darm.
Antibiotica kunnen het vrijkomen van giftige lipopolysacchariden (LPS) veroorzaken, grote moleculen die worden aangetroffen in de buitenmembranen van ziekteverwekkende Gram-negatieve bacteriën. Sommigen suggereren dat door antibiotica veroorzaakte LPS-afgifte kan bijdragen tot de ontwikkeling van septische shock bij patiënten die worden behandeld voor ernstige infecties veroorzaakt door Gram-negatieve bacteriën. Anderen hebben aangetoond dat LPS een immuunrespons uitlokt door het vrijkomen van ontstekingsbevorderende cytokinen, een probleem dat verergert na behandeling met antibiotica, merkte Skilton op in haar webinar (Wu, T. et al. Toxicol Lett. 2009; 191(2-3): 195-202).
Vanuit het oogpunt van een ziekteverwekker is de productie van LPS een overlevingsstrategie. Deze moleculen interacteren op celoppervlakken om een barrière te vormen, waardoor antibiotica en andere hydrofobe verbindingen niet kunnen binnendringen en Gram-negatieve bacteriën zelfs in barre omgevingen kunnen leven (Zhang, G. et al. Curr Opin Microbiol. 2013; 16(6): 779-785).
Hoe de flora te herstellen
Probiotica zijn één aspect in een alomvattende strategie om de darmflora te herstellen na antibiotica. Gezien de microbiële diversiteit van een gezond darmecosysteem adviseert Skilton producten te gebruiken die veel verschillende soorten nuttige microben bevatten, in plaats van “monocropping” met een of twee afzonderlijke stammen.
Als algemene regel adviseert ze een maand probiotica voor elke week dat een patiënt antibiotica heeft gehad. Ook mensen die langdurig antibiotica hebben gebruikt, hebben langdurig herstel nodig. Ze benadrukte dat er voor de meeste mensen geen gezondheidsrisico’s verbonden zijn aan langdurige probioticasuppletie.
Patiënten die IV antibiotica krijgen, moeten ook commensale probiotica nemen. Sommige artsen die zich hiervan bewust zijn, starten de probiotica al vier uur na een IV antibioticadosis.
Rebuilding the Glycocalyx
Mensen die langdurig of meerdere antibioticakuren hebben gehad, vertonen doorgaans een ernstige erosie van de glycocalyx die normaal de darmmicrovilli omhult. Dit gaat meestal gepaard met een verlies van penseelranden en een duidelijke vermindering van de secretorische IgA-productie.
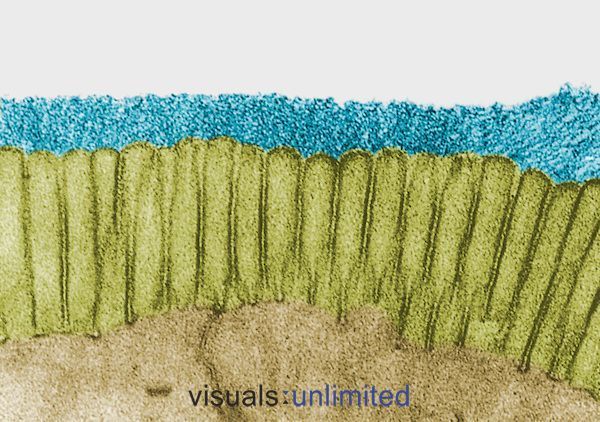 In sommige gevallen worden deze veranderingen veroorzaakt door de effecten van antibiotica zelf. In andere gevallen weerspiegelen ze het effect van de infectie waarvoor de antibiotica werden voorgeschreven. Hoe dan ook, het effect is hetzelfde: de vorming van een micro-omgeving die gastvrij is voor opportunistische ziekteverwekkers zoals Candida, maar steeds moeilijker voor normale commensale bacteriën.
In sommige gevallen worden deze veranderingen veroorzaakt door de effecten van antibiotica zelf. In andere gevallen weerspiegelen ze het effect van de infectie waarvoor de antibiotica werden voorgeschreven. Hoe dan ook, het effect is hetzelfde: de vorming van een micro-omgeving die gastvrij is voor opportunistische ziekteverwekkers zoals Candida, maar steeds moeilijker voor normale commensale bacteriën.
Schimmelinfecties gaan bijna altijd gepaard met onvoldoende IgA-productie, omdat Candida zowel glycocalyx als sIgA als brandstof verbruikt. Het wordt een vicieuze cirkel: lage IgA veroorzaakt Candida, die IgA verder uitput. Chronische urineweginfecties en slijmvliesinfecties zoals spruw zijn rode vlaggen voor een lage sIgA-productie, aldus Skilton.
Zonder een gezonde glycocalyx hebben organismen als Lactobacillen en Bifidobacillen grote moeite zich te vestigen. In deze context zal suppletie met gewone probiotica meestal falen.
“Zelfs als je de beste probiotica ter wereld aanbeveelt, kunnen ze niet blijven plakken en koloniseren als de glycocalyx is uitgehold,” legde Dr. Skilton uit. “Je kunt de symptomen van de spijsverteringsorganen verergeren door probiotica te geven, als het vermogen om glycocalyx te produceren is aangetast.”
Om in deze gevallen een gezondere micro-omgeving te herstellen, moet je gebruik maken van de unieke eigenschappen van Saccharomyces boulardii, een antibioticaresistente probiotische gist die oorspronkelijk geïsoleerd werd uit lycheefruit in Indochina. Hoewel het geen echt commensaal organisme is, is S. boulardii een krachtige inducer van de glycocalyxproductie en IgA-secretie. Het stimuleert ook borstelgrensenzymen en bevordert de polyamineproductie, die de intestinale microvilli voedt en nuttig kan zijn bij de genezing van colitis ulcerosa, de ziekte van Crohn en het prikkelbare darmsyndroom.
S. boulardii is in staat om te werken in de context van zeer pathogene antibioticaresistente bacteriën zoals Clostridium difficile en is daadwerkelijk gebruikt als een preventieve therapie tegen C. difficile-geassocieerde diarree (Goldstein, E. et al. Clin Infect Dis. 2015; 60 (suppl_2): S148-S158). S. boulardii kan enkele van de toxische effecten van enterotoxine A verminderen door de binding van toxine A-receptoren te remmen en de vorming van enterotoxine B te voorkomen.
Maar het meest opmerkelijke is het vermogen van het middel om snel het beschadigde endotheel te koloniseren en pathogene gisten te verdringen, terwijl het tegelijkertijd een gezondere micro-omgeving creëert voor commensale bacteriën. “S. boulardii dwingt in feite een fysieke evacuatie van de Candida,” zei Dr. Skilton en merkte op dat het specifiek actief is tegen 7 van de 8 meest voorkomende pathogene Candida-soorten. De enige uitzondering is C. tropicalis.
“Zie de situatie als de nasleep van een orkaan die een dorp treft. De antibiotica zijn de orkaan. S. boulardii is als de aannemer die binnenkomt en de schade aan het dorp herstelt. Je kunt het dorp dan opnieuw bevolken met commensalen.”
BioCeuticals, een Australisch bedrijf dat alleen nutraceutica gebruikt, heeft onlangs een product geïntroduceerd met de naam SB Floractiv, dat 250 mg S. boulardii (ook wel S. cereviciae genoemd) per capsule bevat.
Voor patiënten die langdurig antibiotica hebben gebruikt, begin langzaam met één capsule (250 mg) per dag gedurende 3-4 dagen, verhoog dan tot twee per dag gedurende nog eens 3-4 dagen, en verhoog dan in een vergelijkbaar stapsgewijs patroon tot vier per dag (1000 mg) die gedurende de rest van een periode van 4 weken moet worden voortgezet.
S. boulardii is zeer veilig, en de enige echte contra-indicatie is bij patiënten met echte IgE-gemedieerde reacties op gisten, zich uitend als anafylaxie of  netelroos. Wel is het belangrijk om te weten dat sommige patiënten in de eerste dagen na inname van S. boulardii een merkbare “darmspoeling” kunnen ervaren, omdat de probiotische gist de Candida-soorten verdringt. Het afsterven van de candida kan er ook toe leiden dat mensen zich ziek voelen. Volgens Dr. Skelton is vier weken intensieve S. boulardii suppletie bij 9 van de 10 patiënten voldoende om een gezonde glycocalyxlaag te herstellen en een adequate IgA secretie op gang te brengen. Dit vormt dan de basis voor een veel effectievere herstelronde met een meerstammig probioticum.
netelroos. Wel is het belangrijk om te weten dat sommige patiënten in de eerste dagen na inname van S. boulardii een merkbare “darmspoeling” kunnen ervaren, omdat de probiotische gist de Candida-soorten verdringt. Het afsterven van de candida kan er ook toe leiden dat mensen zich ziek voelen. Volgens Dr. Skelton is vier weken intensieve S. boulardii suppletie bij 9 van de 10 patiënten voldoende om een gezonde glycocalyxlaag te herstellen en een adequate IgA secretie op gang te brengen. Dit vormt dan de basis voor een veel effectievere herstelronde met een meerstammig probioticum.
Bioceuticals heeft een product ontwikkeld dat speciaal is bedoeld voor gebruik na antibiotica. Het heet BioFloractiv 500 en bevat 500 miljard CFU’s, 12 soorten en 14 stammen van nuttige bacteriën. Dr. Skilton beveelt een maximum van 14 dagen aan, hoewel een week van dagelijkse therapie voldoende is voor de meesten, volgens Skilton.
Patiënten met prikkelbaar darmsyndroom of de ziekte van Crohn kunnen echter een langere ondersteuning nodig hebben om een gezond microbioom op te bouwen na het nemen van antibiotica.
Een alomvattende aanpak
Probiotica zijn slechts een deel van het plaatje. En als een patiënt geen probiotica kan verdragen, is dat een teken dat het immuunsysteem niet goed functioneert.
“Je moet eerst alle aspecten van het zenuwstelsel aanpakken, vooral de sympathische dominantie, die van invloed kunnen zijn op het spijsverteringskanaal,” zegt Dr. Skilton. Zij vond in veel gevallen visolie, zink, vitamine A en colostrum waardevol. De laatste, “is echt goed voor het herstel van sIgA. Doe dit een week of zo voordat je probiotica probeert.” Supplementen met glibberige iep en glutamine kunnen in sommige gevallen ook helpen.
Plantaardige medicijnen zoals oregano-olie, tea tree olie, of pau d’arco extract kunnen helpen om het maag-darmkanaal te ontdoen van pathogene gist. Maar Dr. Skilton benadrukte dat deze de IgA-productie niet stimuleren, en chronische schimmelinfecties gaan bijna altijd gepaard met een laag IgA. Deze natuurlijke gist-boosters mogen nooit tegelijk met S. boulardii worden gebruikt; deze “vriendelijke” gist is net zo kwetsbaar voor dingen als oregano en tea tree als de pathogene gisten.
Een aantal probiotische en prebiotische voedingsmiddelen kan helpen bij het proces van darmherstel. Tom O’Bryan, DC, oprichter van de Gluten Summit en het Certified Gluten Practitioner trainingsprogramma, beveelt een aantal voedingsmiddelen aan om te eten – en een aantal om te vermijden – bij de wederopbouw van de darm na een antibioticabehandeling.
“Wanneer je darm is aangetast, wil je je darm niet belasten,” zegt O’Bryan. “Belastende” voedingsmiddelen zijn tarwe, zuivel, suiker, ongezonde vetten en gefrituurde producten. Deze voedingsmiddelen, merkt hij op, “gooien benzine op het vuur” van een herstellend darmstelsel.
Aan de andere kant moet men veel voedsel eten dat de groei van gezonde commensale organismen bevordert. O’Bryan beveelt organische gestoofde appels aan, gekookt tot ze zacht en glanzend zijn, als een goede optie. Het koken van appels, legt hij uit, maakt pectine vrij – een oplosbare vezel die brandstof levert voor nuttige bacteriën.
De pectine die aanwezig is in gestoofde appels kan ook helpen bij het genezen van een beschadigd darmslijmvlies en het afdichten van de scheuren in een lekkende darm, waardoor grote voedselmoleculen er niet doorheen glippen.
Op vergelijkbare wijze helpt collageen bij het afdichten van een lekkende darm. O’Bryan moedigt patiënten die herstellen van een antibioticakuur ook aan om kippenbouillon te eten, een goede bron van collageen, dat ook fungeert als een natuurlijk prebioticum, dat de gezonde bacteriën in de darm voedt.
Butyraat – een natuurlijke stof die in de darm wordt gemaakt – is een andere belangrijke speler in het herstel van darmbacteriën. O’Bryan legt uit dat de cellen die de binnenkant van de darm bekleden zich snel reproduceren en dat butyraat de wederopbouw van nieuwe cellen voedt. Onvoldoende butyraatproductie en een trage omzet van darmcellen maken het lichaam kwetsbaarder voor de ontwikkeling van kankercellen, wat resulteert in een hoger risico op darmkanker.
Een scala aan prebiotische groenten en fruit, waaronder bananen, zoete aardappelen en andere knollen, helpen bij de wederopbouw van het darmmicrobioom, door onoplosbare vezels te leveren die goede – maar geen schadelijke – bacteriën voeden.
Gegiste, ongepasteuriseerde groenten zoals zuurkool, kimchi en gefermenteerde bieten, zijn een andere uitstekende bron van natuurlijke probiotica. Elke groente produceert verschillende families van nuttige bacteriën tijdens de fermentatie, merkt O’Bryan op, en moedigt patiënten aan om twee keer per dag een vorkje gefermenteerde groenten te eten. “De sleutel tot gezondheid in je darmen is de diversiteit van je microbioom,” stelt hij, erop wijzend dat duizenden verschillende bacteriefamilies in de darmen leven en met elkaar samenwerken, met zeer uiteenlopende gevolgen voor onze gezondheid.
EINDE